Reacción electrocíclica
En química orgánica, una reacción electrocíclica es un tipo de reordenamiento pericíclico donde el resultado neto es que un enlace pi se convierte en un enlace sigma o viceversa. Estas reacciones generalmente se clasifican según los siguientes criterios:
- Las reacciones pueden ser fotoquímicas o térmicas.
- Las reacciones pueden ser ya sea la apertura del anillo o el cierre del anillo (electrociclización).
- Dependiendo del tipo de reacción (fotoquímica o térmica) y del número de electrones pi, la reacción puede ocurrir a través de un mecanismo conrotante o desrotador.
- El tipo de rotación determina si se formará el cis o el isómero trans del producto.
Ejemplos clásicos
La reacción de ciclación de Nazarov es una reacción electrocíclica denominada que convierte divinilcetonas en ciclopentenonas.
Un ejemplo clásico es la reacción térmica de apertura del anillo del 3,4-dimetilciclobuteno. El isómero cis produce exclusivamente cis,trans-hexa-2,4-dieno mientras que el isómero trans produce el trans,trans dieno:
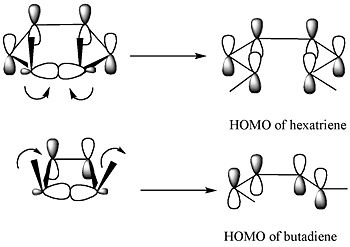
Este curso de reacción se puede explicar con un análisis simple a través del método de orbitales frontera: el enlace sigma en el reactivo se abrirá de tal manera que los orbitales p resultantes tendrán la misma simetría que el HOMO del producto ( un hexadieno). La única manera de lograr esto es a través de una apertura de anillo conrotatoria que da como resultado fases opuestas para los lóbulos terminales.

Estereoespecificidad de reacciones electrocíclicas
Al realizar una reacción electrocíclica, a menudo es deseable predecir la geometría cis/trans del producto de la reacción. El primer paso en este proceso es determinar si una reacción se produce mediante conrotación o disrotación. La siguiente tabla muestra las reglas de selectividad para reacciones electrocíclicas térmicas y fotoquímicas.
| Sistema | Thermally induced (ground state) | Inducido fotoquímicamente (Estado excitado) |
|---|---|---|
| Incluso # de conjugación | Conrotatory | Disrotatory |
| Extraño de conjugación | Disrotatory | Conrotatory |
Para el ejemplo que se da a continuación, la reacción térmica del (trans,cis,trans)-octa-2,4,6-trieno se producirá a través de un mecanismo disrotatorio. Después de determinar el tipo de rotación, se puede determinar si el producto será cis o trans examinando la molécula inicial. En el siguiente ejemplo, la disrotación hace que ambos metilos apunten hacia arriba, lo que provoca que el producto sea cis-dimetilciclohexadieno.
Además, la torquoselectividad en una reacción electrocíclica se refiere a la dirección de la rotación. Por ejemplo, una reacción conrotante todavía puede girar en dos direcciones, produciendo productos enantioméricos. Una reacción torquoselectiva restringe una de estas direcciones de rotación (partial o completamente) para producir un producto en exceso enantiomérico.

Mecanismo de reacciones térmicas
Reglas de Woodward-Hoffmann
Luego se pueden construir diagramas de correlación, que conectan los orbitales moleculares del reactivo con los del producto que tienen la misma simetría, para los dos procesos.
Estos diagramas de correlación indican que solo se permite una simetría con una apertura de anillo conrotatoria de 3,4-dimetilciclobuteno, mientras que solo se permite una simetría con una apertura de anillo disrotatoria de 5,6-dimetilciclohexa-1,3-dieno. Esto se debe a que sólo en estos casos se produciría una superposición orbital máxima en el estado de transición. Además, el producto formado estaría en un estado fundamental en lugar de en un estado excitado.
Teoría de los orbitales moleculares de frontera
Según la teoría de los orbitales moleculares de frontera, el enlace sigma en el anillo se abrirá de tal manera que los orbitales p resultantes tendrán la misma simetría que el HOMO del producto.
Para el 5,6-dimetilciclohexa-1,3-dieno, solo un modo disrotatorio daría como resultado que los orbitales p tuvieran la misma simetría que el HOMO del hexatrieno. Por otro lado, para el 3,4-dimetilciclobuteno, sólo un modo conrotatorio daría como resultado que los orbitales p tuvieran la misma simetría que el HOMO del butadieno.
Mecanismo de reacciones fotoquímicas
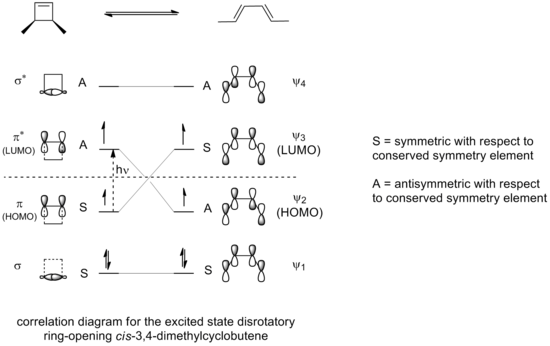
Si la apertura del anillo de 3,4-dimetilciclobuteno se llevara a cabo en condiciones fotoquímicas, la electrociclación resultante se produciría a través de un modo disrotatorio en lugar de un modo conrotatorio, como se puede ver en el diagrama de correlación para la reacción de apertura del anillo en estado excitado permitido. .
Solo un modo disrotatorio, en el que la simetría alrededor de un plano de reflexión se mantiene durante toda la reacción, daría como resultado una superposición orbital máxima en el estado de transición. Además, una vez más, esto daría como resultado la formación de un producto que está en un estado excitado de estabilidad comparable al estado excitado del compuesto reactivo.
Reacciones electrocíclicas en sistemas biológicos
Las reacciones electrocíclicas ocurren con frecuencia en la naturaleza. Una de las electrociclaciones más comunes es la biosíntesis de vitamina D3.
El primer paso implica la apertura conrotatoria del anillo de 7-deshidrocolesterol inducida fotoquímicamente para formar previtamina D3. Un cambio de [1,7]-hidruro forma luego vitamina D3.
Otro ejemplo es la biosíntesis propuesta de la aranotina, una oxepina natural y sus compuestos relacionados.
La epoxidación enzimática de dicetopiperazina derivada de fenilalanina forma el óxido de areno, que sufre una reacción de electrociclación de apertura de anillo disrotatorio 6π para producir la oxepina no ciclada. Después de una segunda epoxidación del anillo, el nitrógeno nucleofílico cercano ataca al carbono electrófilo, formando un anillo de cinco miembros. El sistema de anillos resultante es un sistema de anillos común que se encuentra en el aranotin y sus compuestos relacionados.
El diterpenoide de benzonorcaradieno (A) se reorganizó en el diterpenoide de benzocicloheptatrieno isosalvipuberlina (B) hirviendo una solución de cloruro de metileno. Esta transformación puede concebirse como una reacción electrocíclica disrotatoria, seguida de dos desplazamientos suprafaciales de hidrógeno 1,5-sigmatrópico, como se muestra a continuación.
Reacciones electrocíclicas en síntesis orgánica
Una reacción electrocíclica que se estudia a menudo es la apertura térmica conrotatoria del anillo del benzociclobuteno. El producto de la reacción es un ortoquinodimetano muy inestable, pero esta molécula puede quedar atrapada en una endoadición con un dienófilo fuerte, como el anhídrido maleico, al aducto de Diels-Alder. Se encuentra que el rendimiento químico para la apertura del anillo del benzociclobutano representado en el esquema 2 depende de la naturaleza del sustituyente R. Con un disolvente de reacción como el tolueno y una temperatura de reacción de 110 °C, el el rendimiento aumenta al pasar de metilo a isobutilmetilo y a (trimetilsilil)metilo. El aumento de la velocidad de reacción del compuesto de trimetilsililo puede explicarse por la hiperconjugación del silicio, ya que el enlace βC-Si debilita el enlace ciclobutano C-C mediante la donación de electrones.

Se descubrió una reacción biomimética en cascada electrocíclica en relación con el aislamiento y la síntesis de ciertos ácidos endiándricos:

Las reacciones electrocíclicas asimétricas son un campo emergente en la síntesis orgánica contemporánea. Las reacciones más comúnmente estudiadas en este campo son la síntesis de β-lactama 4π Staudinger y la reacción de 4π Nazarov; La catálisis asimétrica de ambas reacciones se ha controlado mediante el uso de un auxiliar quiral, y la reacción de Nazarov se ha realizado catalíticamente utilizando ácidos quirales de Lewis, ácidos de Brønsted y aminas quirales.