Reacción de Stetter
La reacción Stetter es una reacción utilizada en la química orgánica para formar enlaces carbono-carbono a través de una reacción de 1,4 adición que utiliza un catalizador nucleófílico. Mientras que la reacción relacionada de 1,2 adición, la condensación de benzoina, se conocía desde la década de 1830, la reacción de Stetter no fue informada hasta 1973 por el Dr. Hermann Stetter. La reacción proporciona compuestos de 1,4-dicarbonilo sintéticamente útiles y derivados relacionados de aldehídos y aceptores de Michael. A diferencia de los 1,3-dicarbonilos, a los que se accede fácilmente a través de la condensación de Claisen, o 1,5-dicarbonilos, que comúnmente se fabrican utilizando una reacción de Michael, los 1,4-dicarbonilos están desafiando los sustratos a sintetizar, pero son materiales de partida valiosos para varios. Transformaciones orgánicas, incluida la síntesis PAAL -Knorr de furanos y pirroles. Los catalizadores tradicionalmente utilizados para la reacción de Stetter son las sales de tiazolio y el anión cianuro, pero el trabajo más reciente hacia la reacción asimétrica de Stetter ha encontrado que las sales de triazolium son efectivas. La reacción de Stetter es un ejemplo de química de Umpolung, ya que la polaridad inherente del aldehído se invierte mediante la adición del catalizador al aldehído, lo que hace que el centro de carbono nucleofílico en lugar de electrofílico.

Mecanismo
Como la reacción de Stetter es un ejemplo de química de umpolung, el aldehído se convierte de electrófilo a nucleófilo bajo las condiciones de reacción. Esto se logra mediante la activación de algún catalizador, ya sea cianuro (CN−) o sal de tiazolio. Para el uso de cualquiera de los catalizadores, el mecanismo es muy similar; la única diferencia es que con las sales de tiazolio, el catalizador debe desprotonarse primero para formar las especies catalíticas activas. El catalizador activo puede describirse como la combinación de dos formas de resonancia contribuyentes: un iluro o un carbeno, los cuales presentan el carácter nucleofílico en el carbono. El iluro de tiazolio o CN− puede luego agregarse al sustrato de aldehído, formando una cianhidrina en el caso de CN− o el intermediario de Breslow en el caso de la sal de tiazolio. El intermedio de Breslow fue propuesto por Ronald Breslow en 1958 y es un intermedio común para todas las reacciones catalizadas por tiamina, ya sea in vitro o in vivo.

Una vez que se forma el sintón "aldehído nucleofílico", ya sea como cianhidrina o estabilizado por un iluro de tiazolio, la reacción puede seguir dos vías. La vía más rápida es la autocondensación con otra molécula de aldehído para dar productos de benzoína. Sin embargo, la condensación de benzoína es completamente reversible y, por lo tanto, no interfiere con la formación de productos en la reacción de Stetter. De hecho, se pueden utilizar benzoínas en lugar de aldehídos como sustratos para lograr la misma transformación general de Stetter, porque las benzoínas se pueden restaurar a sus precursores de aldehído en las condiciones de reacción. La vía deseada hacia el producto de Stetter es la adición 1,4 del aldehído nucleofílico a un aceptor de tipo Michael. Después de la adición 1,4, la reacción es irreversible y, en última instancia, se forma el 1,4-dicarbonilo cuando se expulsa el catalizador para regenerar CN− o el iluro de tiazolio.

Ámbito
La reacción de Stetter produce clásicamente difícil de acceder a compuestos 1,4-dicarbonilo y derivados relacionados. La reacción tradicional de Stetter es bastante versátil, trabajando en una amplia variedad de sustratos. Los aldehídos aromáticos, los aldehídos heteroaromáticos y las benzoinas pueden usarse como precursores de aniones de acilo con sal de tiazolio y catalizadores de cianuro. Sin embargo, los aldehídos alifáticos solo se pueden utilizar si se usa una sal de tiazolio como catalizador, ya que sufren reacción lateral de condensación de aldol cuando se usa un catalizador de cianuro. Además, los ésteres α, β-no saturados, cetonas, nitrilos, nitros y aldehídos son todos los aceptores de Michael apropiados con cualquier catalizador. Sin embargo, el alcance general de las reacciones de estetter asimétricas es más limitado. Las reacciones de estetter asimétricas intramoleculares disfrutan de una gama de aceptores aceptables de Michael y precursores de aniones de acilo en esencialmente cualquier combinación. Las reacciones estetter asimétricas intramoleculares pueden utilizar aldehídos aromáticos, heteroaromáticos y alifáticos con un éster, β-β-insaturado β atado, cetona, tioester, malonato, nitrilo o amida Weinreb. Se ha demostrado que los nitros y aldehídos α, β-insaturados no son adecuados de Michael Aceptores y han disminuido notablemente el exceso enantiomérico en tales reacciones. Otra limitación encontrada con las reacciones de estetter asimétricas intramoleculares es que solo los sustratos que resultan en la formación de un anillo de seis miembros muestran un exceso enantiomérico sintéticamente útil; Los sustratos que forman anillos de cinco y siete miembros no reaccionan ni muestran bajainducción esteregráfica. Por otro lado, las reacciones asimétricas intermoleculares están bastante limitadas a combinaciones específicamente coincidentes de precursores de anión acil y aceptador de Michael, como un aldehído alifático con un nitroalkeno. Además, estos sustratos tienden a activarse bastante, ya que la reacción de estetter asimétrico intermolecular todavía se encuentra en las primeras etapas del desarrollo.

Variaciones
Se han desarrollado varias variaciones de la reacción de Stetter desde su descubrimiento en 1973. En 2001, Murry et al informó una reacción estetter de aldehídos aromáticos sobre derivados de acilimina para dar productos α-amido cetonos. Los aceptores de acilimina se generaron in situ a partir de sustratos de α-tosilamida, que sufrieron eliminación en presencia de base. Se observaron rendimientos buenos a excelentes (75-90%). Las investigaciones mecanicistas mostraron que las benzoinas correspondientes no eran sustratos adecuados, contrarios a las reacciones tradicionales de Stetter. A partir de esto, los autores concluyen que la reacción de las aciliminas de Stetter está bajo control cinético, en lugar del control termodinámico.

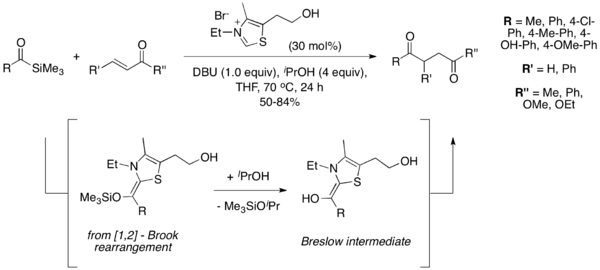
Otra variación de la reacción de Stetter implica el uso de 1,2-dicarbonilos como precursores del anión acil intermedio. En 2005, Scheidt y sus colegas informaron el uso de piruvato de sodio, que pierde CO 2 para formar el intermedio Breslow. Del mismo modo, en 2011 Bortolini y sus colegas demostraron el uso de α-diketonas para generar un anión acil. En las condiciones que desarrollaron, la 2,3-butadienona se escinde después de la adición al catalizador de tiazolio para liberar acetato de etilo y generar el intermedio Breslow necesario para que la reacción de Stetter continúe.

Además, demostraron la economía atómica y la utilidad de utilizar una α-dicetona cíclica para generar el producto de Stetter con un éster etílico unido. La reacción se lleva a cabo a través del mismo mecanismo que la versión acíclica, pero el éster generado por el ataque del etanol permanece unido al producto. Sin embargo, las condiciones solo permiten la generación de ésteres etílicos, debido a la necesidad de etanol como disolvente. La sustitución del etanol por tert-butanol no produjo ningún producto. Los autores especulan que esto se debe a la diferencia de acidez entre los dos disolventes alcohólicos.
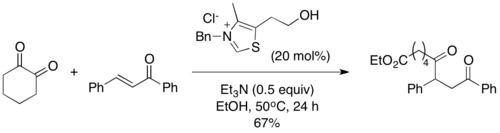
En 2004, Scheidt y sus colaboradores introdujeron los acil silanos como sustratos competentes en la reacción de Stetter, una variación que denominaron "reacción sila-Stetter". En sus condiciones de reacción, el catalizador de tiazolio induce una transposición de Brook [1,2], seguida de una desililación con un aditivo de isopropanol para dar el intermedio de Breslow común de la reacción tradicional de Stetter. Se descubrió que el paso de desililación era necesario y la reacción no se lleva a cabo sin un aditivo alcohólico. Los acil silanos son menos electrofílicos que los aldehídos correspondientes, lo que evita los subproductos típicos de tipo benzoína que se observan a menudo en la reacción de Stetter.
Reacción asimétrica de Stetter
La primera variante asimétrica de la reacción de Stetter fue descrita en 1996 por Enders et al., empleando un catalizador de triazolio quiral 1. Posteriormente, se describieron otros catalizadores para reacciones de Stetter asimétricas, entre ellos 2, 3 y 4.

El éxito del catalizador de Rovis Group ' s 2 los llevó a explorar más a fondo esta familia de catalizadores y expandir su uso para reacciones asimétricas de estetter. En 2004, informaron la formación enantioselectiva de centros cuaternarios de aldehídos aromáticos en una reacción de estetter intramolecular con un catalizador ligeramente modificado. El trabajo adicional extendió el alcance de esta reacción para incluir aldehídos alifáticos también. Posteriormente, se demostró que la geometría de olefina del aceptador de Michael dicta la diastereoselectividad en estas reacciones, por lo que el catalizador dicta la enantioselectividad de la formación inicial de la formación de enlaces de carbono y la minimización de la cepa alílica dicta la protonación intramolecular diastereoselectiva.

Las dificultades inherentes al control de la enantioselectividad en las reacciones intermoleculares hicieron que el desarrollo de una reacción de Stetter asimétrica intermolecular fuera un desafío. Si bien Enders había informado sobre un exceso enantiomérico limitado a principios de los años 1990 para la reacción de n-butanal con chalcona, las condiciones para una reacción de Stetter intermolecular asimétrica útil para la síntesis no se informaron hasta 2008, cuando los grupos de Enders y Rovis publicaron dichas reacciones. El grupo de Enders utilizó un catalizador basado en triazolio para efectuar el acoplamiento de aldehídos aromáticos con derivados de chalcona con rendimientos moderados. La publicación simultánea del grupo de Rovis también empleó un catalizador basado en triazolio e informó sobre la reacción de Stetter entre glioxamidas y alquilidenemalonatos con rendimientos buenos a excelentes.

ROVIS y sus compañeros de trabajo posteriormente exploraron la reacción estetter intermolecular asimétrica de aldehídos heterocíclicos y nitroalkenos. Durante la optimización de esta reacción, se descubrió que un catalizador con un esqueleto fluorado enormemente mejoró en la reacción en la reacción. Se propuso que la columna vertebral fluorada ayuda a bloquear la conformación del catalizador de una manera que aumenta la enantioselectividad. Otros estudios computacionales sobre este sistema verificaron que la atracción estereoelectrónica entre la carga negativa parcial en desarrollo en el nitroalkeno en el estado de transición y la carga positiva parcial del dipolo C-F es responsable del aumento del exceso enantiomérico observado con el uso del catalizador con backbone con backbone fluoración. Si bien este es un avance marcado en el área de reacciones de estetter asimétricas intermoleculares, el alcance del sustrato es limitado y el catalizador está optimizado para los sustratos específicos que se utilizan.

Otra contribución al desarrollo de reacciones estetter intermoleculares asimétricas provino de Glorius y sus compañeros de trabajo en 2011. Demostraron la síntesis de α-aminoácidos enantioselectivamente al utilizar n -acacylamido acrilato como el aceptador conjugado. Significativamente, la reacción se puede ejecutar en una escala de 5 mmol sin pérdida de rendimiento o enantioselectividad.

Aplicaciones
La reacción de Stetter es una herramienta efectiva en la síntesis orgánica. Los productos de la reacción de Stetter, 1,4-dicarbonilos, son restos valiosos para la síntesis de moléculas complejas. Por ejemplo, el trost y los compañeros de trabajo emplearon una reacción de Stetter como un paso en su síntesis de rac -ácido hirsético C. El acoplamiento intramolecular de un aldehído alifático con un éster α, β-no insuficiente se llevó a los deseos deseados 1,4-dicarbonilo tricíclico con un rendimiento del 67%. Este intermedio se convirtió en rac -ácido cival c en siete pasos más.

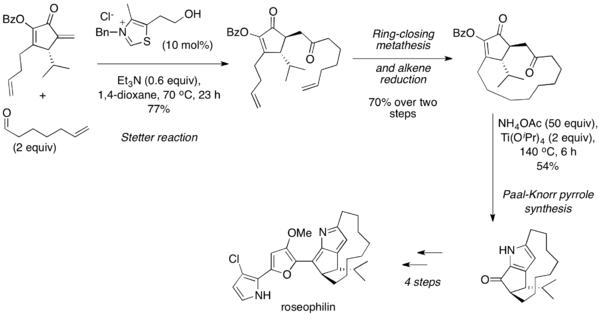
La reacción de Stetter se usa comúnmente en secuencia con la síntesis PAAL-Knorr de furanos y pirroles, que un 1,4-dicarbonilo sufre condensación consigo mismo o en presencia de una amina bajo condiciones ácidas de alta temperatura. En 2001, Tius y sus compañeros de trabajo informaron la síntesis total asimétrica de rosofilina que utiliza una reacción intermolecular de Stetter para acoplar un aldehído alifático con un enone cíclico. Después de la metátesis de cierre de anillo y la reducción de alqueno, el producto 1,4-dicarbonilo se convirtió en un pirrol a través de la síntesis PAAL-Knorr y se elaboró aún más al producto natural.
En 2004, se informó una secuencia de Knorr de acoplamiento-isomerización-estetter-paul de un solo recipiente. Este procedimiento primero utiliza la química de acoplamiento cruzado de paladio para acoplar haluros de arilo con alcoholes proparggylic para dar cetonas α, β-no saturadas, que luego pueden sufrir una reacción de Stetter con un aldehído. Una vez que se forma el compuesto de 1,4-dicarbonilo, el calentamiento en presencia de ácido le dará al furano, mientras que el calentamiento en presencia de cloruro de amonio y ácido le dará al pirrol. Toda la secuencia se realiza en una potencia sin trabajo o purificación entre pasos.

ma y colegas desarrollaron un método alternativo para acceder a los furanos utilizando la reacción de Stetter. En su informe, los 3-aminofuranos se sintetizan en condiciones de estetter para acoplar aldehídos aromáticos con dimetil acetilenedicarboxilato (DMAD), por lo que la ylida de tiazolio se hidroliza por la aromatización del producto furano. Como el Thiazolium se destruye en estas condiciones, no es catalítico y debe usarse en cantidades estequiométricas.
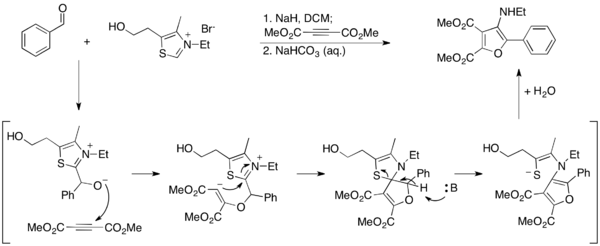
Elaboraron aún más sobre este trabajo desarrollando un método en el que los 2-aminofuranos se sintetizan por ciclación en un nitrilo. En este método, el Tiazolium Ylide se emplea catalíticamente y se genera el producto de amina libre.

Relacionados
- Baylis – Reacción de Hitler
Referencias
- ^ a b c d e Stetter, H. Angew. Int. Ed. 1976, 15639.
- ^ Stetter, H. y Schreckenberg, M. Angew. Chem. Ed Engl. 1973, 1281.
- ^ Albright, J. D. Tetraedro 1983, 393207.
- ^ Respira, R. J. Am. Chem. Soc. 1958, 803719.
- ^ a b c de Alaniz, J. R.; Kerr, M. S.; Moore, J. L.; Rovis, T. J. Org. Chem. 2008, 732033.
- ^ a b Jousseaume, T.; Wurz, N. E.; Glorius, F. Angew. Int. Ed. 2011, 501410.
- ^ Murry, J. A.; Frantz, D. E.; Soheili, A.; Tillyer, R.; Grabowski, E. J. J.; Reider, P. J. J. Am. Chem. Soc. 2001, 123- 9696.
- ^ Myers, M. C.; Bharadwaj, A. R.; Milgram, B. C.; Scheidt, K. A. J. Am. Chem. Soc. 2005, 127- 14675.
- ^ Bortolini, O.; Fantin, G.; Fogagnolo, M.; Giovannini, P.; Massi, A.; Pacifico, S. Org. Biomol. Chem. 2011, 98437.
- ^ Mattson, A. E.; Bharadwaj, A. R.; Scheidt, K. A. J. Am. Chem. Soc. 2004, 1262314.
- ^ Mattson, A. E.; Bharadwaj, A. R.; Zuhl, A. M.; Scheidt, K. A. "Thiazolium-Catalyzed Additions of Acylsilanes: A General Strategy for Acyl Anion Addition Reactions." J. Org. Chem. 2006, 71- 5715. doi:10.1021/jo060699c
- ^ Enders, D.; Breuer K.; Runsink, J.; Teles, J. H. Helv. Chim. Acta 1996, 791899.
- ^ Kerr, M. S.; de Alaniz, J. R.; Rovis, T. J. Am. Chem. Soc. 2002, 124- 10298.
- ^ Pesch, J.; Harms, K.; Bach, T. Eur. J. Org. Chem. 20042025.
- ^ Mennen, S. M.; Blank, J. T.; Tran-Dubé, M. B.; Imbriglio, J. E.; Miller, S. J. Comuna. 2005- 195.
- ^ Kerr, M. S.; Rovis, T. J. Am. Chem. Soc. 2004, 1268876.
- ^ Moore, J. L.; Kerr, M. S.; Rovis, T. Tetraedro 2006, 6211477.
- ^ de Alaniz, J. R.; Rovis, T. J. Am. Chem. Soc. 2005, 1276284.
- ^ Enders, D. Enzymemimetic C-C y C-N Bond Formations. In Síntesis estereoselectiva; Ottow, E., Schoellkopf, K., Schulz, B.-G., eds.; Springer-Verlag: Berlin-Heidelberg, 1994; pp 63-90.
- ^ Enders, D.; Han, J.; Henseler, A. Comuna. 2008, 3989.
- ^ Liu, Q.; Perreault, S.; Rovis, T. J. Am. Chem. Soc. 2008, 130- 14066.
- ^ DiRocco, D. A.; Oberg, K. M.; Dalton, D. M.; Rovis, T. J. Am. Chem. Soc. 2009, 131- 10872.
- ^ Um, J. M.; DiRocco, D. A.; Noey, E. L.; Rovis, T.; Houk, K. N. J. Am. Chem. Soc. 2011, 13311249.
- ^ Trost, B.M.; Shuey, C. D.; DiNinno, F., Jr.; McElvain, S. S. J. Am. Chem. Soc. 1979, 1011284.
- ^ Harrington, P. E.; Tius, M. A. J. Am. Chem. Soc. 2001, 1238509.
- ^ Braun, R. U.; Müller, T. J. J. Síntesis 2004, 142391.
- ^ Ma, C.; Yang, Sí. Org Lett. 2005, 71343.
- ^ Liu, P.; Lei, M.; Ma, L.; Hu, L. Synlett 2011, 81133.