Reacción de petasis
La reacción de Petasis (alternativamente llamada reacción de Petasis boro-Mannich (PBM)) es la reacción de múltiples componentes de una amina, un carbonilo y un vinil- o ácido aril-borónico para formar aminas sustituidas.
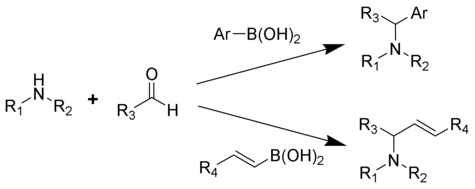
Reportado en 1993 por Nicos Petasis como un método práctico para la síntesis de un agente antifúngico geométricamente puro, la naftifina. En la reacción de Petasis, el grupo vinilo del ácido organoborónico actúa como nucleófilo. En comparación con otros métodos para generar alil aminas, la reacción de Petasis tolera un andamio multifuncional, con una variedad de aminas y ácidos organoborónicos como posibles materiales de partida. Además, la reacción no requiere condiciones anhidras o inertes. Como síntesis suave y selectiva, la reacción de Petasis es útil para generar α-aminoácidos y se utiliza en química combinatoria y descubrimiento de fármacos.
Ámbito de reacción y aplicaciones sintéticas
La amina se condensa con el carbonilo seguido de la adición del ácido borónico.

Una de las características más atractivas de la reacción de Petasis es la estabilidad de los ácidos vinilborónicos. Con la llegada del acoplamiento Suzuki, muchos están disponibles comercialmente.

También se informaron otros métodos para generar ácidos borónicos.
En la reacción de Petasis se tolera una amplia variedad de grupos funcionales, incluidos alcoholes, ácidos carboxílicos y aminas. Los sustratos conocidos que son compatibles con las condiciones de reacción incluyen ésteres de vinilboronato, ésteres de arilboronato y organotrifluoroboratos de potasio. Además, se puede utilizar una variedad de aminas sustituidas distintas de las aminas secundarias. Se han descrito aminas aromáticas terciarias, hidracinas, hidroxilaminas, sulfonamidas e indoles.
Síntesis de alilaminas
Los ácidos vinilborónicos reaccionan con los aductos de aminas secundarias y paraformaldehído para dar alilaminas terciarias. La geometría del doble enlace del ácido vinilborónico de partida se conserva en el producto final:
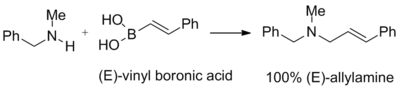
Esta reacción se utilizó para sintetizar naftifina.

Síntesis de aminoácidos
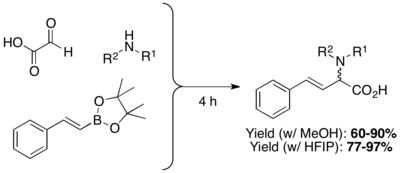
Los aminoácidos β,γ-insaturados y N-sustituidos se preparan mediante la condensación de ácidos organoborónicos, boronatos o ésteres borónicos con aminas y ácidos glioxílicos. Los disolventes próticos altamente polares hexafluoroisopropanol (HFIP) pueden acortar el tiempo de reacción y mejorar el rendimiento.
Además de los ácidos vinilborónicos, también se pueden utilizar ácidos arilborónicos y otros derivados heterocíclicos en el acoplamiento multicomponente de Petasis. El posible alcance del sustrato incluye grupos tienilo, piridilo, furilo y benzofuranilo, 1-naftilo y arilo con sustituyentes donadores o atractores de electrones.

El clopidogrel racémico, un agente antiplaquetario, se sintetizó en dos pasos mediante la reacción de Petasis.

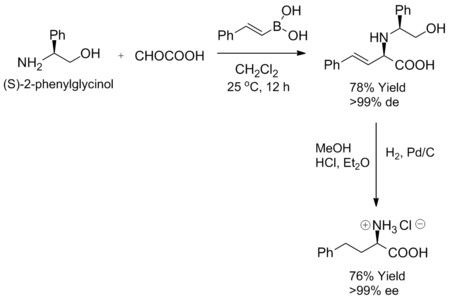
La reacción de Petasis exhibe altos grados de estereocontrol cuando se utiliza una amina quiral o un aldehído como sustrato. Cuando ciertas aminas quirales, como el (S)-2-fenilglicinol, se mezclan con un α-cetoácido y un ácido vinilborónico a temperatura ambiente, la alilamina correspondiente se forma como un único diastereómero. Además, la pureza enantiomérica se puede conseguir mediante hidrogenación del producto diastereoselectivo.
Síntesis no convencional de ácidos carboxílicos
Aparte de los aminoácidos, la reacción PBM también se puede utilizar para preparar ácidos carboxílicos, aunque con mecanismos no convencionales. En el caso de indoles sustituidos con N como equivalente de amina, la reacción comienza con el ataque nucleofílico de la posición 3 del indol sustituido con "N" al aldehído electrófilo, seguido de formación del "complejo ate" 1 mediante la reacción del ácido borónico con el ácido carboxílico. Luego, el intermedio se deshidrata, seguido de la migración del grupo boronato-alquilo para proporcionar el producto final de ácido carboxílico. Se tolera una amplia gama de ácidos arilborónicos, mientras que no se informa el uso de ácidos vinilborónicos. Los indoles "N"-no sustituidos reaccionan muy lentamente en condiciones de reacción normales, lo que confirma el mecanismo siguiente.

Las aminas aromáticas terciarias se pueden utilizar en la reacción de Petasis como otro equivalente de amina nucleófila. El mecanismo es similar al caso del indol N-sustituido. La reacción se lleva a cabo en condiciones duras (reflujo de 24 horas en 1,4-dioxano), pero el ácido carboxílico resultante se obtiene con un rendimiento razonable. El uso de α-cetoácidos en lugar de ácido glioxílico no disminuye los rendimientos. También se pueden utilizar derivados de benceno 1,3,5-trioxigenados en lugar de aminas aromáticas terciarias.

Síntesis de derivados del ácido iminodicarboxílico
Cuando se utilizan como nucleófilos de nitrógeno, los aminoácidos pueden proporcionar diversos derivados del ácido iminodicarboxílico. Generalmente se observa una alta diastereoselectividad y el estereocentro recién formado suele compartir la misma configuración con el aminoácido inicial. Esta reacción funciona bien en disolventes altamente polares (por ejemplo, agua, etanol, etc.). También se pueden utilizar péptidos con terminal de nitrógeno desprotegido como equivalente de nucleófilo de nitrógeno. Petasis y sus compañeros prepararon enalaprilat, un inhibidor de la ECA, con este método.

Síntesis de heterociclos peptidomiméticos
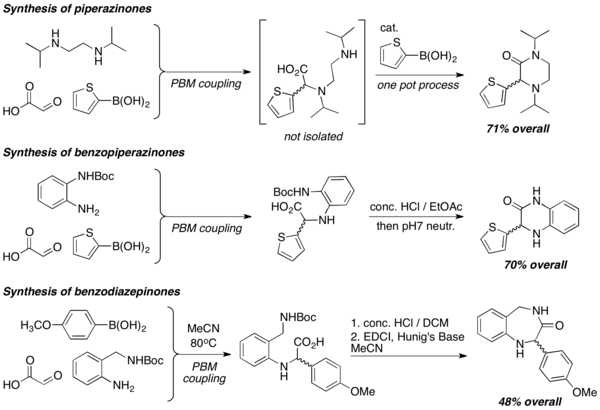
Cuando se utilizan diaminas en reacciones de PBM, se preparan eficientemente heterociclos de diversas estructuras, como piperazinonas, benzopiperazinonas y benzodiazepinonas. Las reacciones de lactamización se emplean comúnmente para formar heterociclos, generalmente en condiciones fuertemente ácidas.
Síntesis de aminoalcoholes
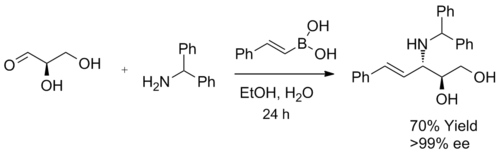
Cuando se utiliza un α-hidroxialdehído como sustrato en la síntesis de β-aminoalcoholes, se genera un único diastereómero. Esta reacción forma exclusivamente antiproducto, confirmado mediante espectroscopía de RMN 1H. El producto no sufre racemización y cuando se utilizan α-hidroxialdehídos enantioméricamente puros, se puede lograr un exceso enantiomérico. Se cree que el ácido borónico reaccionó primero con el grupo hidroxilo quiral, proporcionando un boronato de alquenilo nucleofílico, seguido de una migración intramolecular selectiva de caras del grupo alquenilo hacia el carbono de iminio electrófilo, formando el enlace C-C deseado de manera irreversible.
La diastereoselectividad puede surgir de la reacción de la conformación más estable (y, en este caso, más reactiva) del complejo ate, donde se minimiza la tensión alílica 1,3.

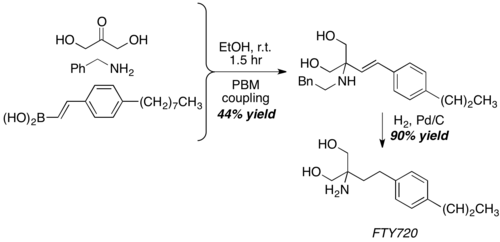
Con dihidroxiacetona, un equivalente de aldehído poco convencional, la reacción de Petasis proporciona la estructura central de FTY720, un potente agente inmunosupresor.
Síntesis de aminopolioles y aminoazúcares
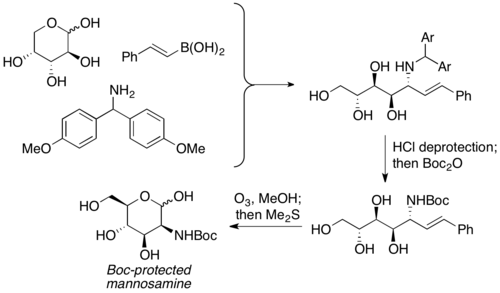
Petasis y compañeros de trabajo informaron sobre el uso de carbohidratos desprotegidos como componente carbonilo en reacciones de PBM. Se utiliza como equivalente de aldehídos α-hidroxilo con quiralidad preexistente, y el producto aminopoliol suele proporcionar un rendimiento de moderado a bueno, con excelente selectividad. Se puede utilizar una amplia variedad de carbohidratos, así como nucleófilos de nitrógeno (por ejemplo, aminoácidos), para proporcionar productos altamente enriquecidos estereoquímicamente. Los productos de aminopoliol pueden luego sufrir reacciones adicionales para preparar aminoazúcares. Petasis utilizó esta reacción para preparar manosamina protegida con Boc a partir de D-arabinosa.
Aplicaciones en síntesis enantioselectiva
Con nucleófilo de amina quiral
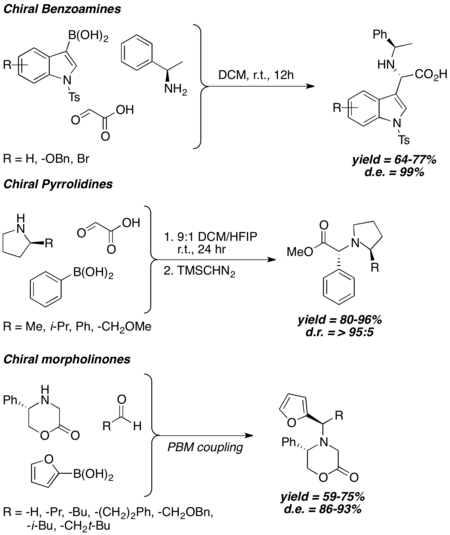
En términos generales, cuando se utiliza una amina quiral en el acoplamiento de Petasis, el resultado estereoquímico de la reacción de Petasis está fuertemente correlacionado con la quiralidad de la amina, y se observa una diastereoselectividad alta a excelente incluso sin el uso de grupos inductores quirales voluminosos. Se ha demostrado que las bencilaminas quirales, las pirrolidinas 2-sustituidas y las 2-morfolinonas 5-sustituidas inducen un exceso diastereomérico de bueno a excelente en diferentes condiciones de reacción de Petasis.
Con iones quirales de N-aciliminio
Ion quiral N-aciliminio "materiales de partida" generalmente se preparan mediante deshidratación in situ de hemiaminal cíclico. También llevan un grupo hidroxilo quiral que está cerca del carbono iminio; Los ácidos borónicos reaccionan con tales grupos hidroxilo quirales para formar una especie de boronato quiral y rica en electrones, seguido de una transferencia de boronato vinilo/arilo intramolecular y selectiva lateralmente al carbono de iminio. Por lo tanto, la reacción es altamente diastereoselectiva, siendo la transferencia cisboronato aril/vinilo la vía predominante. Se ha demostrado que las hidroxipirrolidinas y las hidroxi-γ- y δ-lactamas reaccionan de forma muy diastereoselectiva, con un rendimiento de bueno a excelente. Sin embargo, tales procedimientos se limitan al uso de ácidos vinílicos o arilborónicos ricos en electrones únicamente.

(±)-6-Desoxicastanospermina se preparó en 7 pasos a partir del éster vinilborónico. El precursor acíclico clave de la desoxicastanospermina (A) se forma primero condensando éster vinilborónico 1 con hidroxipirrolidina 2 protegida con Cbz con un acoplamiento PBM, seguido de dihidroxilación y protección con TBS. Luego se somete a ciclación intramolecular a través de una secuela de reducción y formación de imina en un solo recipiente, seguida de desprotección de TBS, para producir (±) -6-desoxicastanospermina.
![Deoxycastanospermine synthesis.[30]](https://upload.wikimedia.org/wikipedia/commons/thumb/d/da/Deoxycastanospermine_synthesis.png/600px-Deoxycastanospermine_synthesis.png)
Con catalizador de tiourea
La reacción enantioselectiva tipo Petasis transforma las quinolinas en 1,2-dihidroquinolinas quirales respectivas (producto) utilizando ácidos alquenilborónicos y un catalizador de tiourea quiral:

Los cloroformiatos son necesarios como agentes activadores electrofílicos. Además, se requiere una funcionalidad 1,2-aminoalcohol en el catalizador para que la reacción se desarrolle estereoselectivamente.

Con bifenoles quirales
Los α-aminoácidos quirales con diversas funcionalidades se obtienen convenientemente mezclando boronatos de alquenilo dietilo, aminas secundarias, glioxilatos y catalizador de bifenol quiral en tolueno en un solo recipiente:

Esta reacción tolera una amplia gama de funcionalidades, tanto en el lado de los alquenilo boronatos como en el de la amina secundaria: la riqueza electrónica de los sustratos no afecta el rendimiento y la enantioselectividad, y los sustratos estéricamente exigentes (alquenilo boronatos dialquilsustituidos y aminas con α-estereocentro) solo comprometen ligeramente la enantioselectividad. Las tasas de reacción varían según el caso.
Bajo las condiciones informadas, los sustratos de ácidos borónicos no lograron proporcionar ninguna enantioselectividad. Además, en el sistema de reacción se utiliza un tamiz molecular de 3 Å. Si bien los autores no proporcionaron el motivo de tal uso en el artículo, se especuló que los tamices moleculares de 3 Å actúan como captadores de agua y previenen la descomposición de los alquenil dietil boronatos en sus respectivos ácidos borónicos. El catalizador podría reciclarse de la reacción y reutilizarse sin comprometer el rendimiento o la enantioselectividad.
Más recientemente, Yuan y sus compañeros de trabajo del Instituto de Química Orgánica de Chengdu de la Academia de Ciencias de China combinaron ambos enfoques (catalizador de tiourea quiral y bifenol quiral) en un solo catalizador, informando por primera vez sobre el sistema catalítico capaz de realizar operaciones enantioselectivas. Reacción de petasis entre salicilaldehídos, aminas secundarias cíclicas y ácidos aril o alquenilborónicos:

En una aplicación, la reacción de Petasis se utiliza para acceder rápidamente a un andamio multifuncional para síntesis divergente. Los reactivos son el lactol derivado del ácido L-fenil-láctico y acetona, éster metílico de l-fenilalanina y un ácido borónico. La reacción tiene lugar en etanol a temperatura ambiente para dar el producto, un anti-1,2-amino alcohol con un alto exceso diastereomérico.
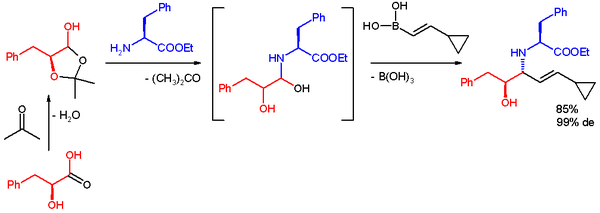
Observe que los autores no pueden evaluar el alcohol sin-1,2-amino con este método debido a la selectividad mecanística intrínseca, y los autores argumentan que dicha selectividad intrínseca obstaculiza su capacidad de acceder a la matriz completa de productos estereoisoméricos para el uso de pequeños cribado de moléculas. En un informe reciente, Schaus y sus colaboradores informaron que el sinaminoalcohol se puede obtener con las siguientes condiciones de reacción, utilizando un catalizador quiral de dibromo-bifenol desarrollado por su grupo:

Aunque la proporción entre syn y antidiastereoisómero varía de mediocre a buena (1,5:1 a 7,5:1), el alcance del sustrato para tales reacciones sigue siendo bastante limitado y se descubre que la diastereoselectividad depende del centro estereogénico en el material de partida de amina.
Reacción de petasis y síntesis total
Beau y sus compañeros de trabajo ensamblaron la estructura central de dihidropirano de los congéneres de zanamivir mediante una combinación de reacción PBM y secuencia de desprotección-ciclación promovida por hierro (III). Un α-hidroxialdehído 2 estereoquímicamente definido, una dialilamina y un ácido borónico protegido con dimetilcetal 1 se acoplan para formar el aminoalcohol 3 acíclico y estereoquímicamente definido, que luego sufre una ciclación promovida por el hierro (III) para formar un dihidropirano bicíclico 4. Selectivo la apertura de la porción de oxazolina del intermedio de dihidropirano 4 con agua o timetilsilil azida luego proporciona productos posteriores que tienen estructuras que se asemejan a los miembros de la familia Zanamivir.

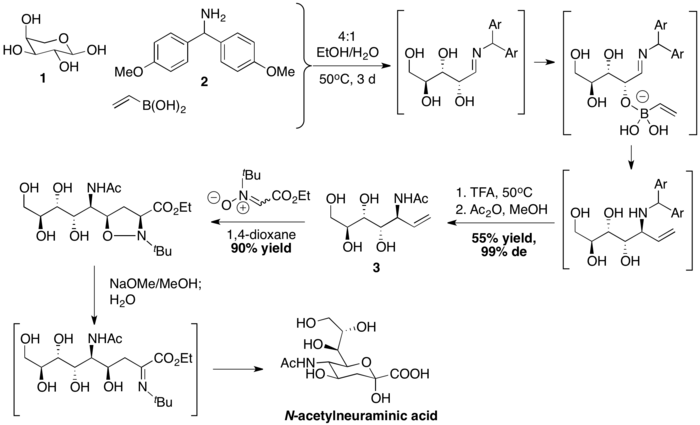
Wong y sus compañeros de trabajo prepararon ácido N-acetilneuramínico con un acoplamiento PBM, seguido de cicloadición de nitrona-[3+2]. El ácido vinilborónico se acopla primero con L-arabinosa 1 y bis(4-metoxifenil)metanamina 2 para formar una alilamina 3 estereoquímicamente definida. Luego, la secuencia de cicloadición dipolar, rotura del enlace N-O mediada por bases e hidrólisis completan la síntesis. del ácido N-acetilneuramínico.