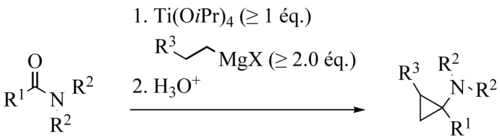Reacción de Kulinkovich
La reacción de Kulinkovich describe la síntesis orgánica de ciclopropanoles sustituidos mediante la reacción de ésteres con reactivos de dialquildialcoxititanio, que se generan in situ a partir de reactivos de Grignard que contienen un hidrógeno en posición beta y alcóxidos de titanio (IV) como el isopropóxido de titanio. Esta reacción fue descrita por primera vez por Oleg Kulinkovich y colaboradores en 1989.

Los catalizadores de titanio son ClTi(OiPr)3 o Ti(OiPr)4, ClTi(OtBu)3 o Ti(OtBu)4, los reactivos de Grignard son EtMgX, PrMgX o BuMgX. Los disolventes pueden ser Et2O, THF, tolueno. Grupos funcionales tolerados: Éteres R–O–R, R–S–R, iminas RN=CHR. Amidas, aminas primarias y secundarias. Los carbamatos normalmente no toleran las condiciones de reacción, pero los carbamatos de terc-butilo (derivados de N-Boc) sobreviven a la transformación.
También se conoce una versión asimétrica de esta reacción con un catalizador basado en TADDOL.
Mecanismo de reacción
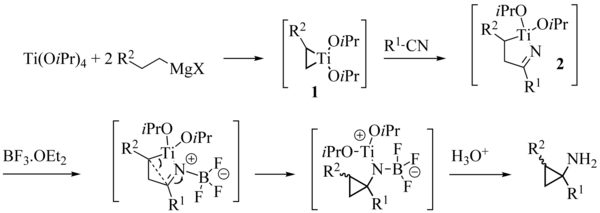
El mecanismo de reacción generalmente aceptado utiliza inicialmente dos etapas sucesivas de transmetalación del reactivo de Grignard comprometido, dando lugar a un complejo intermedio de dialquildiisopropoxititanio. Este complejo sufre una dismutación para dar una molécula de alcano y un titanaciclopropano 1. La inserción del grupo carbonilo del éster en el enlace carbono-titanio más débil, da lugar a un oxatitanaciclopentano 2 que se reordena en cetona 3. Por último, la inserción del grupo carbonilo de 3 en el enlace carbono-titanio residual forma un anillo de ciclopropano. En el estado de transición de esta etapa elemental, que es la etapa límite de la reacción, se recurrió a una interacción agóstica estabilizadora entre el hidrógeno beta y el grupo R2 y el átomo de titanio para explicar la diastereoselectividad observada. El complejo 4 obtenido es un compuesto de tetraalquiloxititanio capaz de desempeñar un papel similar al del tetraisopropiloxititanato de partida, que cierra el ciclo catalítico. Al final de la reacción, el producto se presenta principalmente en forma de alcoholato de magnesio 5, dando lugar al ciclopropanol tras hidrólisis por el medio de reacción.
Se ha estudiado computacionalmente el paso que conduce al titanaciclopropano. Aunque se ha propuesto que el complejo de dialquildiisopropoxititanio sufra una eliminación de hidrógeno β seguida de una eliminación reductora de C–H para dar el alcano y 1, se ha descubierto que la abstracción de hidrógeno β por el grupo alquilo, que conduce directamente a productos sin el intermedio hidruro de titanio, es un proceso más favorable.
A grandes rasgos, y en un sentido retrosintético formal, el titanaciclopropano 1 se comporta como un dianión 1,2 que se añade al éster dos veces: después de la primera adición al éster, el intermedio tetraédrico resultante 2 colapsa para dar β-titaniocetona 3, que sufre una segunda adición intramolecular para dar la sal de titanio del ciclopropanol (4). (Esta especie sufre luego una transmetalación con reactivo de Grignard para regenerar 1 y cerrar el ciclo catalítico y dar el producto en forma de sal de magnesio (5).)
El mecanismo de reacción ha sido objeto de análisis teórico, pero algunos puntos siguen sin estar claros. Kulinkovich ha propuesto complejos intermedios de titanio del tipo ato.
Intercambio de ligando con olefinas
En 1993, el equipo de Kulinkovich destacó la aptitud de los titanaciclopropanos para sufrir intercambio de ligandos con olefinas. Este descubrimiento fue importante, porque permitió acceder a ciclopropanoles más funcionalizados haciendo un uso económico del Grignard del que normalmente se deberían haber empleado al menos dos equivalentes para obtener buenos rendimientos. Cha y su equipo introdujeron el uso de reactivos de Grignard cíclicos, particularmente adaptados para estas reacciones.
La metodología se ha extendido a las reacciones intramoleculares
De Meijere variation
Con amidas en lugar de ésteres, el producto de reacción es un aminociclopropano en la variante De Meijere.
La reacción intramolecular también se conoce como:
Variación szymoniak
En la variante de Szymoniak el sustrato es un nitrilo y el producto de reacción un ciclopropano con un grupo amino primario.
El mecanismo de reacción es similar a la reacción de Kulinkovich:
Lectura adicional
- Kulinkovich, O. G.; Sviridov, S. V.; Vasilevski, D. A. (1991). "Titanium(IV) Isopropoxide-Catalyzed Formation of 1-Substituted Cyclopropanols in the Reaction of Ethylmagnesium Bromide with Methyl Alkanecarboxylates". Síntesis. 1991 (3): 234. doi:10.1055/s-1991-26431.
- Kulinkovich, O. G.; De Meijere, A. (2000). "1,n-Dicarbanionic Titanium Intermedios de los Organometálicos Monocarbanónicos y su aplicación en la síntesis orgánica". Chem. Rev. 100 (8): 2789 –834. doi:10.1021/cr980046z. PMID 11749306.
- Sato, F.; Urabe, H.; Okamoto, S. (2000). "Sintesis de complejos organotitanios de alkenes y alquinos y sus aplicaciones sintéticas". Chem. Rev. 100 (8): 2835 –86. doi:10.1021/cr990277l. PMID 11749307.
- Wu, Y.-D.; Yu, Z.-X. (2001). "Un estudio teórico sobre el mecanismo y la diastereoselectividad de la reacción hidroxiciclopropanación Kulinkovich". J. Am. Chem. Soc. 123 (24): 5777 –86. doi:10.1021/ja010114q. PMID 11403612.
- Kulinkovich, O. G. (2004). "Alquilamiento de derivados de ácido carboxílico con reactivos dialkoxytitanacyclopropano". Russ. Chem. Bull. 53 5): 1065 –1086. doi:10.1023/B:RUCB.0000041303.52400.ca. S2CID 98642553.
- Wolan, A.; Six, Y. (2010). "Transformaciones sintéticas mediadas por la combinación de alkoxides titanio(IV) y reactivos grignard: Cuestiones de selectividad y aplicaciones recientes. Parte 1: Reacciones de derivados de carbono y nitriles". Tetraedro. 66: 15–61. doi:10.1016/j.tet.2009.10.050.
- Wolan, A.; Six, Y. (2010). "Transformaciones sintéticas mediadas por la combinación de alkoxides titanio(IV) y reactivos Grignard: Cuestiones de selectividad y aplicaciones recientes. Parte 2: Reacciones de las siglas, alambiques y alquinos". Tetraedro. 66 (17): 3097 –3133. doi:10.1016/j.tet.2010.01.079.
- Corey, E. J.; Rao, S. A.; Noe, M. C. (1994). "Catalytic Diastereoselective Synthesis of Cis-1,2-Disubstituted Cyclopropanols from Esters Using a Vicinal Dicarbanion Equivalent". Journal of the American Chemical Society. 116 (20): 9345. doi:10.1021/ja00099a068.
Referencias
- ^ a b Cha, Jin Kun; Kulinkovich, Oleg G. (2012). "El Kulinkovich cyclopropanation de derivados del ácido carboxílico". Reacciones orgánicas. 77: 1 –159. doi:10.1002/0471264180.or077.01. ISBN 978-0471264187.
- ^ Kulinkovich, O. G.; Sviridov, S. V.; Vasilevskii, D. A.; Pritytskaya, T. S. (1989). "Reacción de bromuro de etilomagnesio con ésteres de ácido carboxílico en presencia de tetraisopropoxytitanio". Zh. Org. Khim. 25: 2244.
- ^ Bertus, Philippe (11 de noviembre de 2019). "De las especies de dialquiltitanio a Titanacyclopropanes: un estudio de Ab Initio". Organometallics. 38 (21): 4171 –4182. doi:10.1021/acs.organomet.9b00509. ISSN 0276-7333.
- ^ Wu, Y.-D. and Yu, Z.-X. (2001). "Un estudio teórico sobre el mecanismo y la diastereoselectividad de la reacción hidroxiciclopropanación Kulinkovich". J. Am. Chem. Soc. 123 (24): 5777 –86. doi:10.1021/ja010114q. PMID 11403612.
{{cite journal}}: CS1 maint: múltiples nombres: lista de autores (link) - ^ Kulinkovich, O. G.; Kananovich, D. G. (2007). "Procedimiento avanzado para la preparación decis-1,2-Dialkylcyclopropanols – Mecanismo Complejo Ate Modificado para Ciclopropanación Mediada de Titanio de Esteres Carboxílicos con Reagentes Grignard". Eur. J. Org. Chem. 2007 (13): 2121–32. doi:10.1002/ejoc.200601035.
- ^ Kulinkovich, O. G.; Savchenko, A. I.; Sviridov, S. V.; Vasilevski, D. A. (1993). "Titanium(IV) Isopropoxide-catalysed Reaction of Ethylmagnesium Bromide with Ethyl Acetate in the Presence of Styrene". Mendeleev Commun. 3 (6): 230 –31. doi:10.1070/MC1993v003n06ABEH000304.
- ^ Lee, J. Kim, H.; Cha, J. K. (1996). "Una nueva variante de la hidroxiciclopropanación Kulinkovich. Reductive Coupling of Carboxylic Esters with Terminal Olefins". J. Am. Chem. Soc. 118 (17): 4198 –99. doi:10.1021/ja954147f.
- ^ Kasatkin, A.; Sato, F. (1995). "Sintesis digestiva de ciclopropanols trans-1,2-disustituidos de esteres homoallyl o bis-homoallyl a través de substitución nucleófilo tándem intramolecular y reacciones de adición de carbono intramolecular mediadas por Ti(OPr-i)4 / 2 i-PrMgBr reagent". Tetraedro Lett. 36 (34): 6079–82. doi:10.1016/0040-4039(95)01208-Y.
- ^ Chaplinski, V.; De Meijere, A. (1996). "Una nueva preparación versátil de ciclopropilaminas de dialquilamidas ácidas". Angew. Chem. Int.. 35 4): 413 –14. doi:10.1002/anie.199604131.
- ^ De Meijere, A.; Winsel, H. and Stecker, B. Organic Syntheses, Vol. 81, p. 14 Archivado el 18 de septiembre de 2012 en la Wayback Machine
- ^ Lee, J.; Cha, J. K. (1997). "Preparación rápida de Cyclopropylamines de Carboxamides". The Journal of Organic Chemistry. 62 (6): 1584. doi:10.1021/jo962368d.
- ^ Chaplinski, V.; Winsel, H.; Kordes, M.; De Meijere, A. (1997). "Un nuevo reactivo versatil para la síntesis de ciclopropylaminas que incluye 4-Azaspiro[2.n]alkanes y Biciclo[n.1.0]alquilaminas". Synlett. 1997: 111 –114. doi:10.1055/s-1997-17828.
- ^ Cao, B.; Xiao, D.; Joullié, M. M. (1999). "Synthesis of Bicyclic Cyclopropylamines by Intramolecular Cyclopropanation of N-Allylamino Acid Dimethylamides". Cartas orgánicas. 1 (11): 1799. doi:10.1021/ol9910520. PMID 10814442.
- ^ Lee, H. B.; Sung, M. J.; Blackstock, S. C.; Cha, J. K. (2001). "Anulación radial mediada por la cación. Construcción estereoselectiva de biciclo[5.3.0]decan-3-ones por oxidación aeróbica de ciclopropylaminas". Journal of the American Chemical Society. 123 (45): 11322–11324. doi:10.1021/ja017043f. PMID 11697988.
- ^ Gensini, M.; Kozhushkov, S. I.; Yufit, D. S.; Howard, J. A. K.; Es-Sayed, M.; Meijere, A. D. (2002). "3-Azabicyclo[3.1.0]hex-1-ylamines por Ti-Mediated Intramolecular Reductive Cyclopropanation of α-(N-Allylamino)-Substituted N,N-Dialkylcarboxamidas y Carbonitriles". European Journal of Organic Chemistry. 2002 (15): 2499. doi:10.1002/1099-0690(200208)2002:15 Secuencia2499::AID-EJOC2499 confianza3.0.CO;2-V.
- ^ Tebben, G. D.; Rauch, K.; Stratmann, C.; Williams, C. M.; De Meijere, A. (2003). "Aminociclopropanación de titanio intramolecular de Alkenes Terminales: Fácil acceso a diversos Azabiciclo Sustituido[n.1.0]alkanes1". Cartas orgánicas. 5 4): 483 –485. doi:10.1021/ol027352q. PMID 12583749.
- ^ Ouhamou, N.; Six, Y. (2003). ¿Estudios en el Kulinkovich intramolecular? Reacción de Meijere de las siglas discutidas que llevan grupos de amida carboxílica". Orgánico & Biomolecular Química. 1 (17): 3007–9. doi:10.1039/b306719j. PMID 14518121.
- ^ Gensini, M.; De Meijere, A. (2004). "Cyclopropane-Annelated Azaoligoheterocycles by Ti-Mediated Intramolecular Reductive Cyclopropanation of Cyclic Amino Acid Amides". Química: Un Diario Europeo. 10 3): 785 –790. doi:10.1002/chem.200305068. PMID 14767944.
- ^ Larquetoux, L.; Kowalska, J. A.; Six, Y. (2004). "The Formal [3+2+1] Cyclisation of Cyclopropylamines with Carboxylic Anhydrides: A Quick Access to Polysubstituted 2,3,3a,4-Tetrahydro6(5H)-indolone Ring Systems". European Journal of Organic Chemistry. 2004 (16): 3517. doi:10.1002/ejoc.200400291.
- ^ Larquetoux, L.; Ouhamou, N.; Chiaroni, A. L.; Six, Y. (2005). "La sustitución electrofílica aromática intramolecular de los aminociclopropanos Preparado por la reacción Kulinkovich-De Meijere". European Journal of Organic Chemistry. 2005 (21): 4654. doi:10.1002/ejoc.200500428.
- ^ Bertus, P.; Szymoniak, J. (2001). "Nueva y fácil ruta a las ciclopropylaminas primarias de nitriles". Comunicaciones químicas (18): 1792 –1793. doi:10.1039/b105293b. PMID 12240317.
- ^ Chaplinski, V.; De Meijere, A. (1996). "Una nueva preparación versátil de ciclopropilaminas de dialquilamidas ácidas". Angewandte Chemie Edición Internacional en Inglés. 35 (4): 413. doi:10.1002/anie.199604131.