Reacción de hidroboración-oxidación
reacción de hidroboración-oxidación es una reacción de hidratación de dos pasos que convierte un alqueno en un alcohol. El proceso da como resultado la adición sin de un hidrógeno y un grupo hidroxilo donde había estado el doble enlace. La hidroboración-oxidación es una reacción anti-Markovnikov, en la que el grupo hidroxilo se une al carbono menos sustituido. Por lo tanto, la reacción proporciona una alternativa regioquímica más estereoespecífica y complementaria a otras reacciones de hidratación, como la adición catalizada por ácido y el proceso de oximercuración-reducción. La reacción fue reportada por primera vez por Herbert C. Brown a fines de la década de 1950 y fue reconocida al recibir el Premio Nobel de Química en 1979.
La forma general de la reacción es la siguiente:
El tetrahidrofurano (THF) es el disolvente arquetípico utilizado para la hidroboración.
Mecanismo y alcance
Paso de hidroboración
En el primer paso, el borano (BH3) se suma al doble enlace, transfiriendo uno de los átomos de hidrógeno al carbono adyacente al que se une al boro. Esta hidroboración se repite dos veces más, haciendo reaccionar sucesivamente cada enlace B-H de modo que se suman tres alquenos a cada BH3. El trialquilborano resultante se trata con peróxido de hidrógeno en el segundo paso. Este proceso reemplaza los enlaces B-C con enlaces HO-C. El reactivo de boro se convierte en ácido bórico. La reacción fue descrita originalmente por H.C. Brown en 1957 para la conversión de 1-hexeno en 1-hexanol.
Sabiendo que el grupo que contiene el boro será reemplazado por un grupo hidroxilo, se puede ver que el paso de hidroboración inicial determina la regioselectividad. La hidroboración procede de manera anti-Markovnikov. La secuencia de reacción también es estereoespecífica, dando una adición sin (en la misma cara del alqueno): la hidroboración es sin selectiva y la oxidación reemplaza el boro con hidroxilo que tiene la misma posición geométrica. Por lo tanto, el 1-metilciclopenteno reacciona predominantemente con el diborano para dar trans-1-hidroxi-2-metilciclopentano: el H y el OH recién agregados son cis entre sí.
Hasta que todos los hidrógenos unidos al boro hayan sido transferidos, el grupo de boro BH2 continuará añadiéndose a más alquenos. Esto significa que un mol de hidroborano reaccionará con tres moles de alqueno. Además, no es necesario que el hidroborano tenga más de un hidrógeno. Por ejemplo, comúnmente se utilizan reactivos del tipo R2BH, donde R can representa el resto de la molécula. Dichos reactivos de hidroboración modificados incluyen 9-BBN, catecolborano y disiamilborano.
Paso de oxidación
En el segundo paso de la secuencia de reacción, el anión hidroperóxido nucleofílico ataca al átomo de boro. La migración del alquilo al oxígeno da el alquilborano con retención de la estereoquímica (en realidad, la reacción se produce a través del borato de trialquilo B(OR)3, en lugar del éster monoalquilborínico BH2O).
La 'H' átomo en la reacción proviene de B2H6, el 'O' El átomo proviene del peróxido de hidrógeno (H2O2) mientras que el O unido a 'H' El átomo proviene del solvente (consulte el mecanismo).
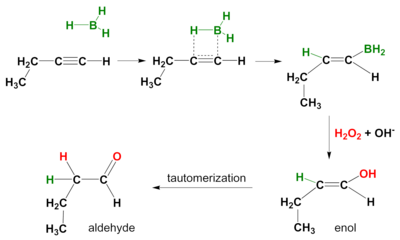
Hidroboración de alquinos
También tiene lugar una reacción de hidroboración en los alquinos. De nuevo, el modo de acción es syn y los productos de reacción secundarios son aldehídos de alquinos terminales y cetonas de alquinos internos. Para evitar la hidroboración en ambos enlaces pi, se utiliza un borano voluminoso como el borano de disiamil (di-sec-iso-amilo).
Oxidaciones alternativas
El uso de otros oxidantes en lugar de peróxido de hidrógeno puede dar lugar a productos carbonílicos en lugar de alcoholes a partir de alquenos. El N-óxido de N-metilmorfolina con perrutenato de tetrapropilamonio catalítico convierte el alquilborano en un carbonilo, por lo tanto, en un producto de cetona o aldehído, dependiendo de qué otros grupos estaban unidos a ese carbono en el alqueno original. Varios dicromatos o reactivos de cromo (VI) relacionados también dan cetonas, pero dan ácidos carboxílicos en lugar de aldehídos para los alquenos terminales.
Contenido relacionado
Inosinato de disodio
Modificación post-traduccional
Alejandro Shlyakhter