Reacción de Belousov-Zhabotinsky
Una reacción de Belousov-Zhabotinsky, o reacción BZ, es una de una clase de reacciones que sirven como un ejemplo clásico de termodinámica de no equilibrio, lo que resulta en el establecimiento de un oscilador químico no lineal. El único elemento común en estos osciladores es la inclusión de bromo y un ácido. Las reacciones son importantes para la química teórica porque muestran que las reacciones químicas no tienen que estar dominadas por el comportamiento termodinámico de equilibrio. Estas reacciones están lejos del equilibrio y permanecen así durante un período de tiempo significativo y evolucionan caóticamente. En este sentido, proporcionan un interesante modelo químico de fenómenos biológicos fuera del equilibrio; como tal, los modelos matemáticos y las simulaciones de las propias reacciones BZ son de interés teórico, mostrando el fenómeno como un orden inducido por ruido.
Un aspecto esencial de la reacción BZ es su llamada "excitabilidad"; bajo la influencia de los estímulos, los patrones se desarrollan en lo que de otro modo sería un medio perfectamente inactivo. Algunas reacciones de reloj, como Briggs-Rauscher y BZ, que utilizan cloruro de tris (bipiridina) rutenio (II) como catalizador, pueden excitarse en una actividad de autoorganización a través de la influencia de la luz.
Historia
El descubrimiento del fenómeno se atribuye a Boris Belousov. En 1951, mientras trataba de encontrar el análogo no orgánico del ciclo de Krebs, notó que en una mezcla de bromato de potasio, sulfato de cerio (IV), ácido malónico y ácido cítrico en ácido sulfúrico diluido, la relación de concentración del Los iones de cerio (IV) y cerio (III) oscilaron, provocando que el color de la solución oscilara entre una solución amarilla y una solución incolora. Esto se debe a que el ácido malónico reduce los iones de cerio (IV) a iones de cerio (III), que luego se oxidan nuevamente a iones de cerio (IV) por iones de bromato (V).
Belousov hizo dos intentos de publicar su hallazgo, pero fue rechazado porque no podía explicar sus resultados a satisfacción de los editores de las revistas a las que envió sus resultados. El bioquímico soviético Simon Elevich Shnoll alentó a Belousov a continuar con sus esfuerzos para publicar sus resultados. En 1959, su trabajo finalmente se publicó en una revista menos respetable y sin reseñas.
Después de la publicación de Belousov, Shnoll entregó el proyecto en 1961 a un estudiante graduado, Anatol Zhabotinsky, quien investigó la secuencia de reacción en detalle; sin embargo, los resultados del trabajo de estos hombres aún no se difundieron ampliamente y no se conocieron en Occidente hasta una conferencia en Praga en 1968.
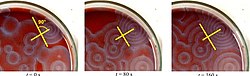
Varios cócteles BZ están disponibles en la literatura química y en la web. La ferroína, un complejo de fenantrolina y hierro, es un indicador común. Estas reacciones, si se llevan a cabo en placas de Petri, dan como resultado primero la formación de manchas coloreadas. Estos puntos crecen en una serie de anillos concéntricos en expansión o tal vez en espirales en expansión similares a los patrones generados por un autómata celular cíclico. Los colores desaparecen si se agitan los platos y luego reaparecen. Las ondas continúan hasta que se consumen los reactivos. La reacción también se puede realizar en un vaso de precipitados usando un agitador magnético.
Andrew Adamatzky, científico informático de la Universidad del Oeste de Inglaterra, informó sobre puertas lógicas líquidas que utilizan la reacción BZ. La reacción BZ también ha sido utilizada por Juan Pérez-Mercader y su grupo de la Universidad de Harvard para crear una máquina de Turing totalmente química, capaz de reconocer un lenguaje tipo 1 de Chomsky.
Patrones en espiral oscilatorios sorprendentemente similares aparecen en otras partes de la naturaleza, a escalas espaciales y temporales muy diferentes, por ejemplo, el patrón de crecimiento de Dictyostelium discoideum, una colonia de amebas que habita en el suelo. En la reacción BZ, el tamaño de los elementos que interactúan es molecular y la escala de tiempo de la reacción es de minutos. En el caso de la ameba del suelo, el tamaño de los elementos es el típico de los organismos unicelulares y los tiempos involucrados son del orden de días a años.
Los investigadores también están explorando la creación de una "computadora húmeda", usando "células" y otras técnicas para imitar ciertas propiedades de las neuronas.
Mecanismo químico
El mecanismo de esta reacción es muy complejo y se cree que implica alrededor de 18 pasos diferentes que han sido objeto de una serie de trabajos de investigación.
De manera similar a la reacción de Briggs-Rauscher, ocurren dos procesos clave (ambos autocatalíticos); el proceso A genera bromo molecular, dando el color rojo, y el proceso B consume el bromo para dar iones de bromuro. Teóricamente, la reacción se parece al patrón de Turing ideal, un sistema que surge cualitativamente de resolver las ecuaciones de difusión de reacción para una reacción que genera tanto un inhibidor de reacción como un promotor de reacción, de los cuales los dos se difunden a través del medio a diferentes velocidades.
Una de las variaciones más comunes de esta reacción utiliza ácido malónico (CH2(CO2H)2) como ácido y bromato de potasio (KBrO3) como fuente de bromo. La ecuación general es:
- 3 CH2(CO2H)2 + 4 BrO−
3 → 4 Br− + 9 CO2 + 6 H2O
Variantes
Existen muchas variantes de la reacción. El único químico clave es el oxidante de bromato. El ion catalizador suele ser cerio, pero también puede ser manganeso o complejos de hierro, rutenio, cobalto, cobre, cromo, plata, níquel y osmio. Se pueden usar muchos reductores diferentes. (Zhabotinsky, 1964b; Field y Burger, 1985)
Se pueden observar muchos patrones diferentes cuando la reacción se lleva a cabo en una microemulsión.
Contenido relacionado
Clorofluorocarbonados
Participación de grupos vecinos
Josías Willard Gibbs