Reacción de adición de Michael
En la química orgánica, la Reacción de Michael o Michael 1,4 adicional es una reacción entre Donante de Michael (enolado u otro núcleo) y un Michael acceptor (normalmente un carbonilo insaturado de α,β) para producir un Michael Adduct creando un vínculo carbono-carbono en el β-carbon del aceptante. Pertenece a la clase más grande de adiciones conjugadas y es ampliamente utilizado para la formación leve de bonos carbono-carbono.
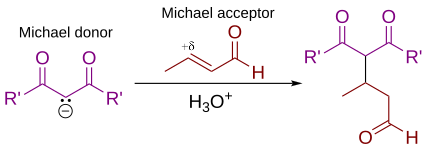
La adición de Michael es un método importante y económico para la formación de enlaces C-C diastereoselectivos y enantioselectivos, y existen muchas variantes asimétricas.
En este esquema general de adición de Michael, ya sea de R y R' en el nucleófilo (el donante de Michael) representan substitutos que se retiran de electrones como los grupos acyl, cyano, nitro o sulfone, que hacen que el hidrógeno metileno adyacente sea lo suficientemente ácido como para formar un carbanión cuando se reacciona con la base, B:. Para el alkene (el aceptador de Michael), el sustituto R es generalmente un carbonilo, lo que hace que el compuesto sea un compuesto de carbono insaturado α,β (ya sea un enone o un enal), o R" puede ser cualquier grupo de retiro de electrones.
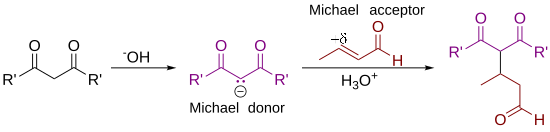
Definición
Como la definió originalmente Arthur Michael, la reacción es la adición de un enolato de una cetona o aldehído a un compuesto carbonílico α,β-insaturado en el carbono β. La definición actual de reacción de Michael se ha ampliado para incluir nucleófilos distintos de los enolatos. Algunos ejemplos de nucleófilos incluyen nucleófilos de carbono doblemente estabilizados, como beta-cetoésteres, malonatos y beta-cianoésteres. El producto resultante contiene un patrón 1,5-dioxigenado muy útil. Los nucleófilos sin carbono, como agua, alcoholes, aminas y enaminas, también pueden reaccionar con un carbonilo α,β-insaturado en una adición 1,4.
Algunos autores han ampliado la definición de adición de Michael para referirse esencialmente a cualquier reacción de adición 1,4 de compuestos carbonílicos α,β-insaturados. Otros, sin embargo, insisten en que tal uso es un abuso de terminología y limitan la adición de Michael a la formación de enlaces carbono-carbono mediante la adición de nucleófilos de carbono. Los términos reacción de oxa-Michael y reacción de aza-Michael se han utilizado para referirse a la adición 1,4 de nucleófilos de oxígeno y nitrógeno, respectivamente. La reacción de Michael también se ha asociado con reacciones de adición 1,6.
Mecanismo
En el mecanismo de reacción, existe 1 como nucleófilo:
La desprotonación de 1 por una base conduce al carbanión 2, estabilizado por sus grupos aceptores de electrones. Las estructuras 2a a 2c son tres estructuras de resonancia que se pueden dibujar para esta especie, dos de las cuales tienen iones enolato. Este nucleófilo reacciona con el alqueno electrófilo 3 para formar 4 en una reacción de adición conjugada. Finalmente, el enolato 4 extrae un protón de la base protonada (o disolvente) para producir 5.
La reacción está dominada por consideraciones orbitales, más que electrostáticas. El HOMO de los enolatos estabilizados tiene un coeficiente grande en el átomo de carbono central, mientras que el LUMO de muchos compuestos carbonílicos alfa y beta insaturados tiene un coeficiente grande en el carbono beta. Por tanto, ambos reactivos pueden considerarse blandos. Estos orbitales de frontera polarizados tienen una energía similar y reaccionan eficientemente para formar un nuevo enlace carbono-carbono.
Al igual que la adición de aldol, la reacción de Michael puede proceder a través de un enol, silil enol éter en la adición de Mukaiyama-Michael o, más habitualmente, un nucleófilo enolato. En el último caso, el compuesto carbonílico estabilizado se desprotona con una base fuerte (enolización dura) o con un ácido de Lewis y una base débil (enolización blanda). El enolato resultante ataca la olefina activada con 1,4-regioselectividad, formando un enlace carbono-carbono. Esto también transfiere el enolato al electrófilo. Dado que el electrófilo es mucho menos ácido que el nucleófilo, la transferencia rápida de protones generalmente transfiere el enolato de regreso al nucleófilo si el producto es enolizable; sin embargo, se puede aprovechar el nuevo locus de nucleofilicidad si hay un electrófilo adecuado pendiente. Dependiendo de la acidez relativa del nucleófilo y del producto, la reacción puede ser catalítica en base. En la mayoría de los casos, la reacción es irreversible a baja temperatura.
Historia
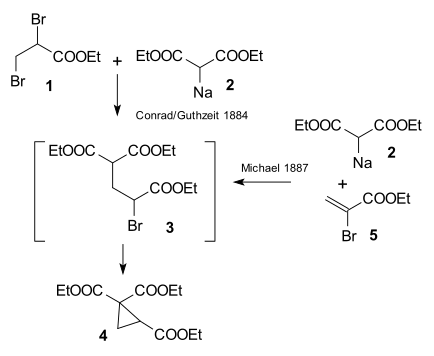
La investigación realizada por Arthur Michael en 1887 en la Universidad de Tufts fue impulsada por una publicación de 1884 de Conrad & Kuthzeit sobre la reacción del 2,3-dibromopropionato de etilo con el malonato de sodio y dietilo formando un derivado de ciclopropano (ahora reconocido que implica dos reacciones de sustitución sucesivas).
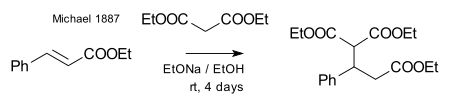
Michael pudo obtener el mismo producto reemplazando el propionato por éster etílico del ácido 2-bromacrílico y se dio cuenta de que esta reacción solo podía funcionar asumiendo una reacción de adición al doble enlace del ácido acrílico. Luego confirmó esta suposición haciendo reaccionar el malonato de dietilo y el éster etílico del ácido cinámico formando el primer aducto de Michael:
Ese mismo año, Rainer Ludwig Claisen reivindicó la prioridad para la invención. Él y T. Komnenos habían observado productos de adición a dobles enlaces como productos secundarios a principios de 1883 mientras investigaban reacciones de condensación del ácido malónico con aldehídos. Sin embargo, según el biógrafo Takashi Tokoroyama, esta afirmación carece de fundamento.
Reacción asimétrica de Michael
Los investigadores han ampliado el alcance de las adiciones de Michael para incluir elementos de quiralidad a través de versiones asimétricas de la reacción. Los métodos más comunes implican catálisis de transferencia de fase quiral, como sales de amonio cuaternario derivadas de los alcaloides de Cinchona; u organocatálisis, que se activa mediante enamina o iminio con aminas secundarias quirales, generalmente derivadas de prolina.
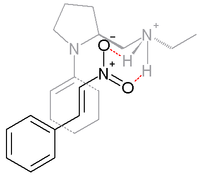
En la reacción entre ciclohexanona y β-nitroestireno que se describe a continuación, la base prolina se deriva y trabaja en conjunto con un ácido prótico como el ácido p-toluenosulfónico:
La adición de sincronización se ve favorecida con un 99 % de ee. En el estado de transición que se cree que es responsable de esta selectividad, la enamina (formada entre el nitrógeno de la prolina y la ciclocetona) y el β-nitroestireno son cofaciales con el grupo nitro unido por enlaces de hidrógeno a la amina protonada en el grupo lateral de la prolina.
Una reacción de Michael muy conocida es la síntesis de warfarina a partir de 4-hidroxicumarina y bencilidenoacetona, de la que Link informó por primera vez en 1944:
Existen varias versiones asimétricas de esta reacción utilizando catalizadores quirales.
Ejemplos
Ejemplos clásicos de la reacción de Michael son la reacción entre malonato de dietilo (donante de Michael) y fumarato de dietilo (aceptor de Michael), la del malonato de dietilo y el óxido de mesitilo (formando Dimedone), la del malonato de dietilo y el crotonato de metilo, la de 2 -nitropropano y acrilato de metilo, el de fenilcianoacetato de etilo y acrilonitrilo y el de nitropropano y metil vinil cetona.
Una secuencia clásica en tándem de adiciones de Michael y aldólico es la anulación de Robinson.
Adición de Mukaiyama-Michael
En el Mukaiyama–Michael añadido, el nucleófilo es un éter de enol silicol y el catalizador es generalmente tetracloruro de titanio:

1,6-Reacción de Michael
La reacción 1,6-Michael procede a través del ataque nucleófico contra el δ carbono de un α,β-,δ- insaturado Michael acceptor. El mecanismo de 1,6-addición es similar a la 1,4-addición, con una excepción siendo el ataque nucleófilo ocurrido en el δ carbono del aceptador de Michael. Sin embargo, la investigación muestra que la organocatalisis a menudo favorece la 1,4-addición. En muchas síntesis, donde se favoreció la 1,6-addición, el sustrato contenía ciertas características estructurales. La investigación ha demostrado que los catalizadores también pueden influir en la reioselectividad y enantioselectividad de una reacción de 1,6-addición.
Por ejemplo, la siguiente imagen muestra la adición de bromuro de etilmagnesio a sorbato de etilo 1 utilizando un catalizador de cobre con josifos (R,S)-(–) invertido. -3 ligando. Esta reacción produjo el producto de adición 1,6 2 con un rendimiento del 0%, el producto de adición 1,6 3 con un rendimiento aproximado del 99% y el producto de adición 1,4. producto de adición 4 con un rendimiento inferior al 2 %. Este catalizador particular y el conjunto de condiciones de reacción condujeron a la adición principalmente regioselectiva y enantioselectiva de sorbato de etilo 1 por 1,6-Michael al producto 3.

Aplicaciones
Productos farmacéuticos
Muchos fármacos inhibidores covalentes utilizan la reacción de Michael como paso mecánico. Los medicamentos contra el cáncer como ibrutinib, osimertinib y rociletinib tienen un grupo funcional de acrilamida como aceptor de Michael. El aceptor de Michael del fármaco reacciona con un aceptor de Michael en el sitio activo de una enzima. Este es un tratamiento viable contra el cáncer porque la enzima objetivo se inhibe después de la reacción de Michael.
Reacciones de polimerización
Mecanismo
Todas las reacciones de polimerización tienen tres pasos básicos: inicio, propagación y terminación. El paso de iniciación es la adición de Michael del nucleófilo a un monómero. La especie resultante sufre una adición de Michael con otro monómero, actuando este último como aceptor. Esto extiende la cadena formando otra especie nucleófila que actúa como donante para la siguiente adición. Este proceso se repite hasta que la reacción se detiene mediante la terminación de la cadena. El donante de Michael original puede ser un donante neutro, como aminas, tioles y alcóxidos, o ligandos de alquilo unidos a un metal.
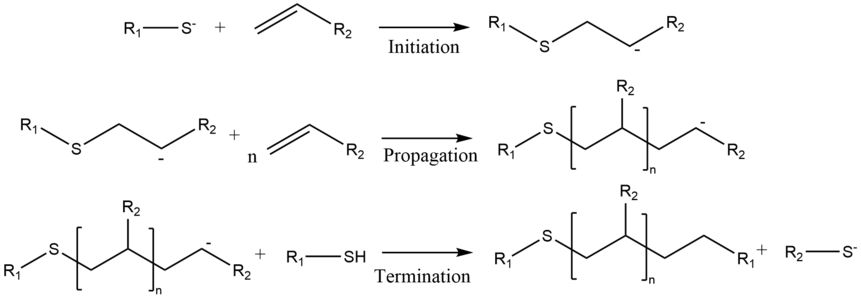
Ejemplos
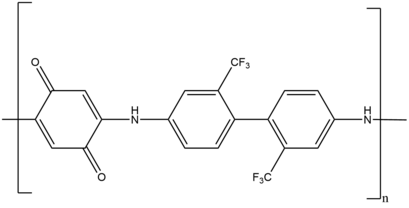
Las polimerizaciones de crecimiento en pasos lineales son algunas de las primeras aplicaciones de la reacción de Michael en polimerizaciones. Se ha utilizado una amplia variedad de donantes y aceptores de Michael para sintetizar una amplia gama de polímeros. Ejemplos de dichos polímeros incluyen poli(amidoamina), poli(aminoéster), poli(imidosulfuro), poli(éster sulfuro), poli(aspartamida), poli(imidoéter), poli(aminoquinona), poli(enona sulfuro). ) y poli(enaminacetona).
Por ejemplo, la polimerización por crecimiento lineal en pasos produce la poli(aminoquinona) activa redox, que sirve como recubrimiento anticorrosión en varias superficies metálicas. Otro ejemplo incluye polímeros de red, que se utilizan para la administración de fármacos, compuestos de alto rendimiento y recubrimientos. Estos polímeros de red se sintetizan utilizando un sistema de adición de Michael de crecimiento de doble cadena, radicales fotoinducidos y crecimiento escalonado.