Reacción de adición de halógeno
Una reacción de adición de halógeno es una reacción orgánica simple en la que se añade una molécula de halógeno al doble enlace carbono-carbono de un grupo funcional alqueno.
La fórmula química general de la reacción de adición de halógeno es:
- C=C + X2 → X−C−C−X
(X representa los halógenos bromo o cloro, y en este caso, un solvente podría ser CH2Cl2 o CCl4). El producto es un dihaluro vecinal.
Este tipo de reacción es una halogenación y una adición electrófila.
Mecanismo de reacción
El mecanismo de reacción para la bromación de un alqueno se puede describir de la siguiente manera. En el primer paso de la reacción, una molécula de bromo se acerca al doble enlace carbono-carbono del alqueno rico en electrones. El átomo de bromo más cercano al enlace adquiere una carga positiva parcial a medida que sus electrones son repelidos por los electrones del doble enlace.
 | |
| Bromine addition to alkene reaction mechanism | Un ion bromuro ataca la órbita molecular de un ión bromonio C–Br σ* |
El átomo es electrofílico en este momento y es atacado por los electrones pi del alqueno [doble enlace carbono-carbono]. Forma por un instante un enlace sigma simple con ambos átomos de carbono involucrados. El enlace del bromo es especial en este intermedio, debido a su tamaño relativamente grande en comparación con el carbono, el ion bromuro es capaz de interactuar con ambos carbonos que alguna vez compartieron el enlace π, formando un anillo de tres miembros. El ion bromuro adquiere una carga formal positiva. En este momento, el ion halógeno se denomina "ion bromonio" o "ion cloronio", respectivamente.
Cuando el primer átomo de bromo ataca el enlace π carbono-carbono, deja atrás uno de sus electrones con el otro bromo al que estaba unido en Br2. Ese otro átomo es ahora un anión bromuro negativo y es atraído por la ligera carga positiva de los átomos de carbono. Está bloqueado del ataque nucleofílico en un lado de la cadena de carbono por el primer átomo de bromo y solo puede atacar desde el otro lado. A medida que ataca y forma un enlace con uno de los carbonos, el enlace entre el primer átomo de bromo y los otros átomos de carbono se rompe, dejando cada átomo de carbono con un sustituyente halógeno.
De esta forma los dos halógenos se suman en forma antiadición, y cuando el alqueno forma parte de un ciclo el dibromuro adopta la configuración trans. Para una superposición máxima del orbital molecular antienlazante C–Br σ* (el LUMO, que se muestra a la derecha en rojo) y el par solitario del nucleófilo (X−) (el HOMO, que se muestra a la derecha debajo en verde), X− debe atacar al ion bromonio por detrás, en el carbono.
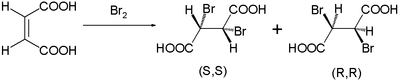
Este mecanismo de reacción fue propuesto por Roberts y Kimball en 1937. Con él explicaron las adiciones trans estereoespecíficas observadas en bromaciones de ácido maleico y ácido fumárico. El ácido maleico con un enlace doble cis forma el dibromuro como una mezcla de enantiómeros:
mientras que el isómero trans del ácido fumárico forma un solo compuesto meso:
La reacción es incluso estereoespecífica en alquenos con dos grupos terc-butilo voluminosos en una posición cis como en el compuesto cis-di-tert-butiletileno. A pesar de la repulsión estérica presente en el ion cloronio, el único producto que se forma es el anti-aducto.
Β-Halocarbocationes
En un esquema de reacción alternativo que se muestra a continuación, el intermedio reactivo es un β-bromocarbocatión o ion β-bromocarbonio con uno de los átomos de carbono un carbocatión genuino.
Para las reacciones que tienen lugar a través de este mecanismo, no se espera estereoespecificidad y, de hecho, no se encuentra.
Roberts y Kimball en 1937 ya explicaron el hecho de que las bromaciones con el ion maleato dieron como resultado una adición cis impulsada por la repulsión entre los aniones de ácido carboxílico con carga negativa que son más fuertes que la formación del ion halonio. En los alquenos, como los anetoles y los estilbenos, los sustituyentes pueden estabilizar el carbocatión donando electrones a expensas del ion halonio.
Los iones de halonio se pueden identificar mediante espectroscopia de RMN. En 1967, el grupo de George A. Olah obtuvo espectros de RMN de iones de tetrametiletilenbromonio disolviendo 2,3-dibromo-2,3-dimetilbutano en ácido mágico a -60 °C. El espectro para el compuesto de flúor correspondiente, por otro lado, era consistente con un par de fluorocarbocationes β que se equilibraban rápidamente.
Contenido relacionado
Laurent
Napier nómada
Cuanto