Quinona
Las quinonas son una clase de compuestos orgánicos que se "derivan formalmente de compuestos aromáticos [como el benceno o el naftaleno] mediante la conversión de un número par de grupos –CH= en –C (=O)– grupos con cualquier reordenamiento necesario de los dobles enlaces, lo que da como resultado "una estructura de diona cíclica completamente conjugada". El miembro arquetípico de la clase es la 1,4-benzoquinona o ciclohexadienodiona, a menudo llamada simplemente "quinona" (de ahí el nombre de la clase). Otros ejemplos importantes son la 1,2-benzoquinona (orto-quinona), la 1,4-naftoquinona y la 9,10-antraquinona.
El nombre se deriva del ácido quínico (con el sufijo "-uno" que indica una cetona), ya que es uno de los compuestos obtenidos por oxidación del ácido quínico. El ácido quínico, al igual que la quinina, se obtiene de la corteza de la quina, llamada quinaquina en las lenguas indígenas de las tribus peruanas.
Propiedades
Las quinonas son derivados oxidados de compuestos aromáticos y, a menudo, se fabrican fácilmente a partir de compuestos aromáticos reactivos con sustituyentes donantes de electrones, como fenoles y catecoles, que aumentan la nucleofilia del anillo y contribuyen al gran potencial redox necesario para romper la aromaticidad. (Las quinonas son conjugadas pero no aromáticas). Las quinonas son aceptores de Michael electrofílicos estabilizados por conjugación. Según la quinona y el sitio de reducción, la reducción puede volver a aromatizar el compuesto o romper la conjugación. La adición conjugada casi siempre rompe la conjugación.
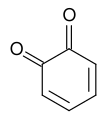
1,2-Benzoquinone
1,4-Benzoquinone
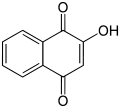
1,4-Naphthoquinone
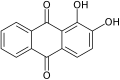
9,10-Antraquinona
El término quinona también se utiliza de forma más general para una gran clase de compuestos derivados formalmente de quinonas aromáticas mediante la sustitución de algunos átomos de hidrógeno por otros átomos o radicales.
Chloranil, un reactivo en química orgánica
Lawsone, un tinte presente en las hojas de la planta de henna
Alizarin, un tinte rojo común
DDQ, un reactivo en química orgánica
Daunorubicina, un medicamento anticáncer
Reacciones
Reducción

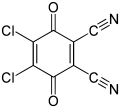
Las quinonas son agentes oxidantes, a veces de forma reversible. En relación con la benzoquinona, las quinonas de oxidación más fuerte incluyen cloranil y 2,3-dicloro-5,6-diciano-1,4-benzoquinona (también conocida como DDQ).
El poder oxidante de las quinonas se potencia con la presencia de ácidos. En condiciones ácidas, la quinona sufre una reducción de dos electrones y dos protones a hidroquinona.

En condiciones alcalinas, las quinonas se someten a una reducción reversible de dos electrones en un solo paso. En condiciones neutras, las quinonas pueden sufrir una reducción de un protón, dos electrones o una reducción de dos electrones. En medios apróticos, las quinonas se reducen en dos pasos sin protones. En el primer paso, se forma un intermedio de semiquinona de vida corta. En el segundo paso, la semiquinona se reduce a un dianión de quinona.
El ácido 9,10-antraquinona-2,7-disulfónico (AQDS), una quinona similar a la que se encuentra naturalmente en el ruibarbo, se ha utilizado como portador de carga en baterías de flujo libre de metales.
Adición
Las quinonas experimentan una reacción de adición para formar productos de adición 1,4. Un ejemplo de reacción de adición de 1,4 es la adición de cloruro de hidrógeno para formar clorohidroquinona:

Las quinonas pueden sufrir reacciones de Diels-Alder. La quinona actúa como dienófilo y reacciona con un dieno en un doble enlace carbono-carbono.
En las reacciones de Diels-Alder, las quinonas se utilizan como dienófilos. Las síntesis históricamente importantes incluyen colesterol, cortisona, morfina y reserpina.
Ocurrencia y usos
Producción de peróxido de hidrógeno
Una aplicación industrial a gran escala de las quinonas es la producción de peróxido de hidrógeno. Las 2-alquilantraquinonas se hidrogenan a las correspondientes hidroquinonas (quinizarinas), que luego transfieren H
2 a oxígeno:
- dihidroanthraquinone + O
2 → antraquinona + H
2O
2
de esta manera, varios millones de toneladas métricas de H
2O
2 se producen anualmente.
1,4-naftoquinona, derivada de la oxidación de naftaleno con trióxido de cromo. Es el precursor de la antraquinona.
Bioquímica
Numerosas quinonas tienen funciones importantes en biología. La vitamina K, que participa en la coagulación de la sangre, es una quinona. La ubiquinona-10 es una 1,4-benzoquinona natural involucrada en el aparato respiratorio. La plastoquinona es un relé redox involucrado en la fotosíntesis. La pirroloquinolina quinona es otro cofactor redox biológico.

Se conjetura que las quinonas ocurren en todos los organismos que respiran. Algunos sirven como aceptores de electrones en las cadenas de transporte de electrones, como las de la fotosíntesis (plastoquinona, filoquinona) y la respiración aeróbica (ubiquinona). La filoquinona también se conoce como vitamina K1, ya que los animales la utilizan para carboxilar ciertas proteínas, que están involucradas en la coagulación de la sangre, la formación de huesos y otros procesos. Por el contrario, la toxicidad del paracetamol se debe a su metabolismo a una imina de quinona, que luego reacciona con las proteínas hepáticas para causar insuficiencia hepática.
La autooxidación del neurotransmisor dopamina y su precursor L-Dopa genera la dopamina quinona comparativamente estable que inhibe el funcionamiento del transportador de dopamina (DAT) y la enzima TH y conduce a una baja producción de ATP mitocondrial.
La benzoquinona blattellaquinone es una feromona sexual en las cucarachas. En el rocío de los escarabajos bombarderos, la hidroquinona reacciona con el peróxido de hidrógeno para producir una ráfaga de vapor ardiente, un elemento disuasorio en el mundo animal.
Médica
(feminine)Varias quinonas son de interés farmacológico. Forman una clase importante de citotoxinas anticancerígenas. Un ejemplo es la daunorrubicina, que es antileucémica. Algunos de ellos muestran actividad antitumoral. Incorporan algunas afirmaciones en la medicina herbal. Estas aplicaciones incluyen purgantes (senósidos), antimicrobianos y antiparasitarios (rhein y saprorthoquinone, atovaquone), antitumorales (emodin y juglone), inhibidores de la biosíntesis de PGE2 (arnebinone y arnebifuranone) y anti-enfermedades cardiovasculares (tanshinone). Malbranchea cinnamomea es un hongo termofílico, que produce un antibiótico de quinona.
Otro fármaco que contiene quinona es el mecarbinato (dimecarbine), elaborado por la reacción de N-metil-β-aminocrotonato de etilo con parabenzoquinona. Otros incluyen Amendol, Oxyphemedol, Phemedol, todos en FR5142 (M) ― 1967-06-05. Nota: Estos son todos los indoles hechos a través de la síntesis de indol de Nenitzescu. El antineoplásico Apaziquone.
Los compuestos de benzoquinona son un metabolito del paracetamol.
Tintes
Muchas sustancias colorantes naturales y artificiales (tintes y pigmentos) son derivados de la quinona, por ejemplo, la lawsona es el compuesto colorante activo de la henna. Solo son superados por los colorantes azoicos en importancia como colorantes, con especial énfasis en los colores azules. La alizarina (1,2-dihidroxi-9,10-antraquinona), extraída de la rubia, fue el primer colorante natural que se sintetizó a partir del alquitrán de hulla.
Fotografía
Una aplicación comercial de las quinonas es la fotografía en blanco y negro. La película en blanco y negro se cubre con una emulsión que contiene bromuro de plata o cristales de yoduro de plata, que se activan con la exposición a la luz. La hidroquinona se usa para reducir los iones de plata activados a plata metálica. Durante este proceso, la hidroquinona se oxida a quinona. Se elimina todo el haluro de plata no activado por la luz o reducido por hidroquinona, dejando un negativo por plata depositada donde la película había sido golpeada por la luz.
Nomenclatura
Las quinonas se nombran comúnmente con un prefijo que indica el hidrocarburo aromático original ("benzo-" para benceno, "nafto-" para naftaleno, "antra-& #34; para antraceno, etc.) y la "-quinona" sufijo. Multiplicadores infijos "-di-", "-tri-", "-tetra-" (etc.) se utilizan cuando hay 4, 6, 8 (etc.) carbonilos. La posición de los grupos carbonilo se puede indicar antes del prefijo (como en "1,4,5,8-naftodiquinona") o después ("antra-1,4-quinona").
Análogos estructurales de las quinonas
- Quinone methide - donde una O es reemplazada por C
- Xylylene - donde ambos O son reemplazados por C's
- Quinone imine - donde un O es reemplazado por N, ilustrado por NAPQI
- Quinone diimine – donde ambos O son reemplazados por N's, ilustrado por el antiséptico Ambazone
- Azaxylylene - donde ambos O son reemplazados por una N y una C, ilustrado por varios tintes de fuchsina como pararosanilina
Contenido relacionado
Percarbonato de sodio
Archibald Scott Couper
Cloruro de hidrogeno