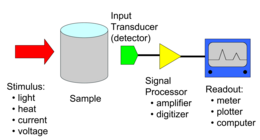
Química analítica
La química analítica estudia y utiliza instrumentos y métodos para separar, identificar y cuantificar la materia. En la práctica, la separación, identificación o cuantificación pueden constituir el análisis completo o combinarse con otro método. La separación aísla los analitos. El análisis cualitativo identifica los analitos, mientras que el análisis cuantitativo determina la cantidad o concentración numérica.
La química analítica consta de métodos químicos húmedos clásicos y métodos instrumentales modernos. Los métodos cualitativos clásicos utilizan separaciones como la precipitación, la extracción y la destilación. La identificación puede basarse en diferencias de color, olor, punto de fusión, punto de ebullición, solubilidad, radiactividad o reactividad. El análisis cuantitativo clásico utiliza cambios de masa o volumen para cuantificar la cantidad. Se pueden utilizar métodos instrumentales para separar muestras mediante cromatografía, electroforesis o fraccionamiento de flujo de campo. Luego se pueden realizar análisis cualitativos y cuantitativos, a menudo con el mismo instrumento y pueden usar interacción de luz, interacción de calor, campos eléctricos o campos magnéticos. A menudo, el mismo instrumento puede separar, identificar y cuantificar un analito.
La química analítica también se centra en las mejoras en el diseño experimental, la quimiometría y la creación de nuevas herramientas de medición. La química analítica tiene amplias aplicaciones en la medicina, la ciencia y la ingeniería.
Historia
La química analítica ha sido importante desde los primeros días de la química, proporcionando métodos para determinar qué elementos y sustancias químicas están presentes en el objeto en cuestión. Durante este período, las contribuciones significativas a la química analítica incluyeron el desarrollo del análisis elemental sistemático por parte de Justus von Liebig y el análisis orgánico sistematizado basado en las reacciones específicas de los grupos funcionales.
El primer análisis instrumental fue la espectrometría de emisión de llama desarrollada por Robert Bunsen y Gustav Kirchhoff, quienes descubrieron el rubidio (Rb) y el cesio (Cs) en 1860.
La mayoría de los principales desarrollos en química analítica tuvieron lugar después de 1900. Durante este período, el análisis instrumental se volvió progresivamente dominante en el campo. En particular, muchas de las técnicas espectroscópicas y espectrométricas básicas se descubrieron a principios del siglo XX y se refinaron a fines del siglo XX.
Las ciencias de la separación siguen una línea de tiempo de desarrollo similar y también se transformaron cada vez más en instrumentos de alto rendimiento. En la década de 1970, muchas de estas técnicas comenzaron a usarse juntas como técnicas híbridas para lograr una caracterización completa de las muestras.
A partir de la década de 1970, la química analítica se volvió progresivamente más inclusiva de cuestiones biológicas (química bioanalítica), mientras que anteriormente se había centrado en gran medida en moléculas inorgánicas u orgánicas pequeñas. Los láseres se han utilizado cada vez más como sondas e incluso para iniciar e influir en una amplia variedad de reacciones. El final del siglo XX también vio una expansión de la aplicación de la química analítica de preguntas químicas algo académicas a preguntas forenses, ambientales, industriales y médicas, como en histología.
La química analítica moderna está dominada por el análisis instrumental. Muchos químicos analíticos se enfocan en un solo tipo de instrumento. Los académicos tienden a centrarse en nuevas aplicaciones y descubrimientos o en nuevos métodos de análisis. El descubrimiento de una sustancia química presente en la sangre que aumenta el riesgo de cáncer sería un descubrimiento en el que podría participar un químico analítico. Un esfuerzo por desarrollar un nuevo método podría implicar el uso de un láser sintonizable para aumentar la especificidad y la sensibilidad de un método espectrométrico. Muchos métodos, una vez desarrollados, se mantienen deliberadamente estáticos para que los datos puedan compararse durante largos períodos de tiempo. Esto es particularmente cierto en aplicaciones de garantía de calidad industrial (QA), forense y ambiental. La química analítica juega un papel cada vez más importante en la industria farmacéutica donde, además del control de calidad, se utiliza en el descubrimiento de nuevos fármacos candidatos y en aplicaciones clínicas donde la comprensión de las interacciones entre el fármaco y el paciente es fundamental.
Métodos clásicos
Aunque la química analítica moderna está dominada por instrumentación sofisticada, las raíces de la química analítica y algunos de los principios utilizados en los instrumentos modernos provienen de técnicas tradicionales, muchas de las cuales todavía se utilizan en la actualidad. Estas técnicas también tienden a formar la columna vertebral de la mayoría de los laboratorios educativos de química analítica de pregrado.
Análisis cualitativo
El análisis cualitativo determina la presencia o ausencia de un compuesto en particular, pero no la masa o concentración. Por definición, los análisis cualitativos no miden la cantidad.
Pruebas químicas
Existen numerosas pruebas químicas cualitativas, por ejemplo, la prueba de ácido para el oro y la prueba de Kastle-Meyer para la presencia de sangre.
Prueba de llama
El análisis cualitativo inorgánico generalmente se refiere a un esquema sistemático para confirmar la presencia de ciertos iones o elementos acuosos mediante la realización de una serie de reacciones que eliminan un rango de posibilidades y luego confirman los iones sospechosos con una prueba de confirmación. A veces, estos esquemas incluyen pequeños iones que contienen carbono. Con la instrumentación moderna, estas pruebas rara vez se utilizan, pero pueden ser útiles con fines educativos y en el trabajo de campo u otras situaciones en las que el acceso a instrumentos de última generación no está disponible o no es conveniente.
Análisis cuantitativo
El análisis cuantitativo es la medición de las cantidades de componentes químicos particulares presentes en una sustancia. Las cantidades se pueden medir por masa (análisis gravimétrico) o volumen (análisis volumétrico).
Análisis gravimétrico
El análisis gravimétrico consiste en determinar la cantidad de material presente pesando la muestra antes y/o después de alguna transformación. Un ejemplo común utilizado en la educación universitaria es la determinación de la cantidad de agua en un hidrato calentando la muestra para eliminar el agua de manera que la diferencia de peso se deba a la pérdida de agua.
Análisis volumétrico
La titulación implica la adición de un reactivo a una solución que se analiza hasta que se alcanza un punto de equivalencia. A menudo se puede determinar la cantidad de material en la solución que se analiza. Lo más familiar para aquellos que han tomado química durante la educación secundaria es la titulación ácido-base que involucra un indicador que cambia de color. Hay muchos otros tipos de valoraciones, por ejemplo, valoraciones potenciométricas. Estas titulaciones pueden usar diferentes tipos de indicadores para alcanzar algún punto de equivalencia.
Métodos instrumentales
Espectroscopía
La espectroscopia mide la interacción de las moléculas con la radiación electromagnética. La espectroscopia consta de muchas aplicaciones diferentes, como la espectroscopia de absorción atómica, la espectroscopia de emisión atómica, la espectroscopia ultravioleta-visible, la espectroscopia de rayos X, la espectroscopia de fluorescencia, la espectroscopia infrarroja, la espectroscopia Raman, la interferometría de polarización dual, la espectroscopia de resonancia magnética nuclear, la espectroscopia de fotoemisión, la espectroscopia Mössbauer y pronto.
Espectrometría de masas
La espectrometría de masas mide la relación masa-carga de las moléculas mediante campos eléctricos y magnéticos. Existen varios métodos de ionización: ionización electrónica, ionización química, ionización por electrospray, bombardeo de átomos rápidos, desorción/ionización láser asistida por matriz y otros. Además, la espectrometría de masas se clasifica según los enfoques de los analizadores de masas: sector magnético, analizador de masas de cuadrupolo, trampa de iones de cuadrupolo, tiempo de vuelo, resonancia de ciclotrón de iones por transformada de Fourier, etc.
Análisis electroquímico
Los métodos electroanalíticos miden el potencial (voltios) y/o la corriente (amperios) en una celda electroquímica que contiene el analito. Estos métodos se pueden categorizar según qué aspectos de la célula se controlan y cuáles se miden. Las cuatro categorías principales son potenciometría (se mide la diferencia en los potenciales de los electrodos), coulometría (la carga transferida se mide a lo largo del tiempo), amperometría (la corriente de la celda se mide a lo largo del tiempo) y voltamperometría (la carga de la celda se mide a lo largo del tiempo). La corriente se mide mientras se altera activamente el potencial de la celda).
Análisis térmico
La calorimetría y el análisis termogravimétrico miden la interacción de un material y el calor.
Separación
Los procesos de separación se utilizan para disminuir la complejidad de las mezclas de materiales. La cromatografía, la electroforesis y el fraccionamiento de flujo de campo son representativos de este campo.
Técnicas híbridas
Las combinaciones de las técnicas anteriores producen un "híbrido" o "con guión" técnica. Varios ejemplos son de uso popular hoy en día y se están desarrollando nuevas técnicas híbridas. Por ejemplo, cromatografía de gases-espectrometría de masas, cromatografía de gases-espectroscopia infrarroja, cromatografía líquida-espectrometría de masas, cromatografía líquida-espectroscopia NMR, cromatografía líquida-espectroscopia infrarroja y electroforesis capilar-espectrometría de masas.
Las técnicas de separación con guión se refieren a una combinación de dos (o más) técnicas para detectar y separar sustancias químicas de las soluciones. Muy a menudo, la otra técnica es alguna forma de cromatografía. Las técnicas con guión son ampliamente utilizadas en química y bioquímica. A veces se usa una barra inclinada en lugar de un guión, especialmente si el nombre de uno de los métodos contiene un guión.
Microscopía
La visualización de moléculas individuales, células individuales, tejidos biológicos y nanomateriales es un enfoque importante y atractivo en la ciencia analítica. Además, la hibridación con otras herramientas analíticas tradicionales está revolucionando la ciencia analítica. La microscopía se puede clasificar en tres campos diferentes: microscopía óptica, microscopía electrónica y microscopía de sonda de barrido. Recientemente, este campo está progresando rápidamente debido al rápido desarrollo de las industrias de computadoras y cámaras.
Laboratorio en un chip
Dispositivos que integran (múltiples) funciones de laboratorio en un solo chip de solo milímetros a unos pocos centímetros cuadrados de tamaño y que son capaces de manejar volúmenes de fluidos extremadamente pequeños hasta menos de picolitros.
Errores
El error se puede definir como la diferencia numérica entre el valor observado y el valor real. El error experimental se puede dividir en dos tipos, error sistemático y error aleatorio. El error sistemático resulta de una falla en el equipo o en el diseño de un experimento, mientras que el error aleatorio resulta de variables no controladas o incontrolables en el experimento.
Por error, el valor real y el valor observado en el análisis químico se pueden relacionar entre sí mediante la ecuación
- ε ε a=Silenciox− − x̄ ̄ Silencio{displaystyle varepsilon _{rm {a}= arrestx-{bar {x}tuvos}
dónde
- ε ε a{displaystyle varepsilon _{rm {a}} es el error absoluto.
- x{displaystyle x} es el verdadero valor.
- x̄ ̄ {displaystyle {bar {x}} es el valor observado.
Un error de medición es una medida inversa de una medición precisa, es decir, cuanto menor sea el error, mayor será la precisión de la medición.
Los errores se pueden expresar relativamente. Dado el error relativo(ε ε r{displaystyle varepsilon _{rm {r}}):
- ε ε r=ε ε aSilencioxSilencio=Silenciox− − x̄ ̄ xSilencio{displaystyle varepsilon _{rm {}={frac} {varepsilon _{rm {} {fnK} {fnK}} {fnK}} {fnK}} {fn}} {fn}} {fn}}} {fn}}} {fn}}} {fnK}}}}} {fnf}}}}}}}fnfnfnfnfnfnfnfnfnfnfnfnfnfnfnfnfnfnfnfnfnKfnfnfnfnfnfnfnh}}}}}}}fnfnfnfnfnh}}}}}fnfnhnfnfnh}}fnfnfnfnfnfnfnfnfnfnh}}}}}}fn {x-{bar {x}} {x}}justo de la vida}
El porcentaje de error también se puede calcular:
- ε ε r× × 100% % {displaystyle varepsilon _{rm {r}times 100%}
Si queremos utilizar estos valores en una función, también podemos querer calcular el error de la función. Vamos f{displaystyle f} ser una función con N{displaystyle N} variables. Por lo tanto, la propagación de la incertidumbre debe calcularse para conocer el error en f{displaystyle f}:
- ε ε a()f).. .. i=1NSilencio∂ ∂ f∂ ∂ xiSilencioε ε a()xi)=Silencio∂ ∂ f∂ ∂ x1Silencioε ε a()x1)+Silencio∂ ∂ f∂ ∂ x2Silencioε ε a()x2)+...... +Silencio∂ ∂ f∂ ∂ xNSilencioε ε a()xN){displaystyle varepsilon _{rm {a}(f)approx sum ¿Por qué? ¿Por qué? x_{1}}}derecha vidavarepsilon _{rm {a}(x_{1})+left durable{frac {partial f}{partial f}{partial x_{2}}derecha sobre la vidavarepsilon _{rm {a}(x_{2})+ldots +left sometida{frac} {partial f}{partial ¿Por qué?
Estándares
Curva estándar
Un método general para el análisis de la concentración implica la creación de una curva de calibración. Esto permite determinar la cantidad de una sustancia química en un material comparando los resultados de una muestra desconocida con los de una serie de estándares conocidos. Si la concentración de un elemento o compuesto en una muestra es demasiado alta para el rango de detección de la técnica, simplemente se puede diluir en un solvente puro. Si la cantidad en la muestra está por debajo del rango de medición de un instrumento, se puede usar el método de adición. En este método, se agrega una cantidad conocida del elemento o compuesto en estudio, y la diferencia entre la concentración agregada y la concentración observada es la cantidad real en la muestra.
Estándares internos
A veces, se agrega un estándar interno a una concentración conocida directamente a una muestra analítica para ayudar en la cuantificación. A continuación, se determina la cantidad de analito presente en relación con el patrón interno como calibrador. Un estándar interno ideal es un analito enriquecido isotópicamente que da lugar al método de dilución de isótopos.
Adición estándar
El método de adición estándar se utiliza en el análisis instrumental para determinar la concentración de una sustancia (analito) en una muestra desconocida en comparación con un conjunto de muestras de concentración conocida, similar al uso de una curva de calibración. La adición estándar se puede aplicar a la mayoría de las técnicas analíticas y se usa en lugar de una curva de calibración para resolver el problema del efecto de matriz.
Señales y ruido
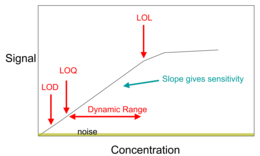
Uno de los componentes más importantes de la química analítica es maximizar la señal deseada y minimizar el ruido asociado. La cifra analítica de mérito se conoce como relación señal-ruido (S/N o SNR).
El ruido puede surgir tanto de factores ambientales como de procesos físicos fundamentales.
Ruido térmico
El ruido térmico resulta del movimiento de portadores de carga (normalmente electrones) en un circuito eléctrico generado por su movimiento térmico. El ruido térmico es ruido blanco, lo que significa que la densidad espectral de potencia es constante en todo el espectro de frecuencia.
El valor cuadrático medio del ruido térmico en una resistencia viene dado por
- vRMS=4kBTRΔ Δ f,{displaystyle v_{rm}={sqrt {4k_{rm} {B}TRDelta f},}
Donde kB es la constante de Boltzmann, T es la temperatura, R es la resistencia, y Δ Δ f{displaystyle Delta f} es el ancho de banda de la frecuencia f{displaystyle f}.
Ruido de disparo
El ruido de disparo es un tipo de ruido electrónico que ocurre cuando el número finito de partículas (como electrones en un circuito electrónico o fotones en un dispositivo óptico) es lo suficientemente pequeño como para generar fluctuaciones estadísticas en una señal.
El ruido de disparo es un proceso de Poisson y los portadores de carga que forman la corriente siguen una distribución de Poisson. La fluctuación de corriente cuadrática media raíz está dada por
- iRMS=2eIΔ Δ f{displaystyle i_{rm}={sqrt {2eIDelta f}}
donde e es la carga elemental e I es la corriente media. El ruido de disparo es ruido blanco.
Ruido de parpadeo
El ruido de parpadeo es ruido electrónico con un espectro de frecuencia de 1/ƒ; a medida que aumenta f, el ruido disminuye. El ruido de parpadeo surge de una variedad de fuentes, como las impurezas en un canal conductor, la generación y el ruido de recombinación en un transistor debido a la corriente de base, etc. Este ruido se puede evitar mediante la modulación de la señal a una frecuencia más alta, por ejemplo, mediante el uso de un amplificador lock-in.
Ruido ambiental
El ruido ambiental surge del entorno del instrumento analítico. Las fuentes de ruido electromagnético son las líneas eléctricas, las estaciones de radio y televisión, los dispositivos inalámbricos, las lámparas fluorescentes compactas y los motores eléctricos. Muchas de estas fuentes de ruido tienen un ancho de banda estrecho y, por lo tanto, pueden evitarse. Es posible que se requiera aislamiento de temperatura y vibración para algunos instrumentos.
Reducción de ruido
La reducción de ruido se puede lograr en el hardware o software de la computadora. Ejemplos de reducción de ruido de hardware son el uso de cable blindado, filtrado analógico y modulación de señal. Ejemplos de software de reducción de ruido son el filtrado digital, el promedio de conjuntos, el promedio de furgones y los métodos de correlación.
Aplicaciones
La química analítica tiene aplicaciones que incluyen la ciencia forense, el bioanálisis, el análisis clínico, el análisis ambiental y el análisis de materiales. La investigación en química analítica está impulsada en gran medida por el rendimiento (sensibilidad, límite de detección, selectividad, robustez, rango dinámico, rango lineal, exactitud, precisión y velocidad) y el costo (compra, operación, capacitación, tiempo y espacio). Entre las principales ramas de la espectrometría atómica analítica contemporánea, las más extendidas y universales son la espectrometría óptica y de masas. En el análisis elemental directo de muestras sólidas, los nuevos líderes son la espectrometría de masas de ablación láser y ruptura inducida por láser, y las técnicas relacionadas con la transferencia de los productos de ablación láser a plasma acoplado inductivamente. Los avances en el diseño de láseres de diodo y osciladores paramétricos ópticos promueven desarrollos en espectrometría de ionización y fluorescencia y también en técnicas de absorción donde se espera que se expandan los usos de cavidades ópticas para aumentar la longitud de la trayectoria de absorción efectiva. El uso de métodos basados en plasma y láser está aumentando. Ha revivido el interés por el análisis absoluto (sin estándares), en particular en la espectrometría de emisión.
Se está haciendo un gran esfuerzo para reducir las técnicas de análisis al tamaño de un chip. Aunque hay pocos ejemplos de tales sistemas que compitan con las técnicas de análisis tradicionales, las ventajas potenciales incluyen tamaño/portabilidad, velocidad y costo. (micro sistema de análisis total (µTAS) o lab-on-a-chip). La química a microescala reduce las cantidades de productos químicos utilizados.
Muchos desarrollos mejoran el análisis de los sistemas biológicos. Ejemplos de campos en rápida expansión en esta área son la genómica, la secuenciación del ADN y la investigación relacionada con la huella genética y la micromatriz de ADN; proteómica, el análisis de las concentraciones y modificaciones de proteínas, especialmente en respuesta a varios factores estresantes, en varias etapas de desarrollo, o en varias partes del cuerpo, metabolómica, que se ocupa de los metabolitos; transcriptómica, incluyendo ARNm y campos asociados; lipidómica - lípidos y sus campos asociados; peptidómica - péptidos y sus campos asociados; y metalómica, que se ocupa de las concentraciones de metales y especialmente de su unión a proteínas y otras moléculas.
La química analítica ha jugado un papel fundamental en la comprensión de la ciencia básica para una variedad de aplicaciones prácticas, como aplicaciones biomédicas, monitoreo ambiental, control de calidad de la fabricación industrial, ciencia forense, etc.
Los desarrollos recientes en la automatización informática y las tecnologías de la información han extendido la química analítica a una serie de nuevos campos biológicos. Por ejemplo, las máquinas automáticas de secuenciación de ADN fueron la base para completar los proyectos del genoma humano que condujeron al nacimiento de la genómica. La identificación de proteínas y la secuenciación de péptidos por espectrometría de masas abrió un nuevo campo en la proteómica. Además de automatizar procesos específicos, existe un esfuerzo por automatizar secciones más grandes de pruebas de laboratorio, como en empresas como Emerald Cloud Lab y Trancriptic.
La química analítica ha sido un área indispensable en el desarrollo de la nanotecnología. Los instrumentos de caracterización de superficies, los microscopios electrónicos y los microscopios de sonda de barrido permiten a los científicos visualizar estructuras atómicas con caracterizaciones químicas.
Contenido relacionado
Quitinasa
Gas noble
Nitroglicerina