Prueba de gris
La prueba de Griess es una prueba de química analítica que detecta la presencia de iones nitrito en solución. Uno de sus usos más importantes es la determinación de nitritos en agua potable. La reacción de diazotización de Griess, en la que se basa el reactivo de Griess, fue descrita por primera vez en 1858 por Peter Griess. La prueba también se ha utilizado ampliamente para la detección de nitratos (estado de oxidación N = 5+), que son un componente común de los explosivos, ya que pueden reducirse a nitritos (estado de oxidación N = 3+) y detectarse con el Prueba de Griess.
Método
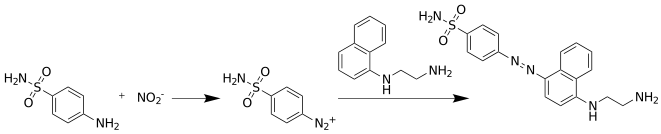
El nitrito se detecta y analiza mediante la formación de un color rosa rojo al tratar una muestra que contiene nitrito con el reactivo de Griess, que consta de dos componentes en una solución ácida: un derivado de anilina y un agente de acoplamiento. Las disposiciones más comunes utilizan sulfanilamida y N-(1-naftil)etilendiamina: un reactivo comercial típico de Griess contiene 0,2% de diclorhidrato de N-(1-naftil)etilendiamina y 2% de sulfanilamida en ácido fosfórico al 5%. Esta diamina se utiliza en lugar de la 1-naftilamina, más simple y barata, porque esta última es un potente carcinógeno y, además, la diamina forma un tinte más polar y, por tanto, mucho más soluble en medio acuoso ácido. Otros derivados de anilina que se han utilizado incluyen ácido sulfanílico, nitroanilina y p-aminoacetofenona.
La prueba de Griess implica dos reacciones posteriores. Cuando se agrega sulfanilamida, el ion nitrito reacciona con él en la reacción de diazotización de Griess para formar una sal de diazonio, que luego reacciona con N-(1-naftil)etilendiamina en una reacción de acoplamiento azo, formando un colorante azo rojo rosado.
Utilizando un espectrofotómetro, es posible determinar cuantitativamente la concentración de nitrito. El límite de detección de la prueba de Griess generalmente oscila entre 0,02 y 2 μM, dependiendo de los detalles exactos de los componentes específicos utilizados en el reactivo de Griess.
Forense
La prueba se utilizó en medicina forense durante muchos años para detectar rastros de nitroglicerina. La soda cáustica se utiliza para descomponer la muestra que contiene nitroglicerina y producir iones nitrito.
La prueba consiste en la toma de una muestra con éter y su división en dos cuencos. Se añade sosa cáustica al primer recipiente seguida del reactivo de Griess; si la solución se vuelve rosa en diez segundos, esto indica la presencia de nitritos. La prueba en sí es positiva si, después de añadir sólo el reactivo de Griess al segundo recipiente, la solución permanece clara.
Las condenas de Judith Ward y los Seis de Birmingham se vieron favorecidas por la interpretación errónea de Frank Skuse de los resultados de las pruebas de Griess.