Proteómica
La proteómica es el estudio a gran escala de las proteínas. Las proteínas son partes vitales de los organismos vivos, con muchas funciones, como la formación de fibras estructurales del tejido muscular, la digestión enzimática de los alimentos o la síntesis y replicación del ADN. Además, otros tipos de proteínas incluyen anticuerpos que protegen a un organismo de infecciones y hormonas que envían señales importantes por todo el cuerpo.
El proteoma es el conjunto completo de proteínas producidas o modificadas por un organismo o sistema. La proteómica permite la identificación de un número cada vez mayor de proteínas. Esto varía con el tiempo y los distintos requisitos, o tensiones, que sufre una célula u organismo.
La proteómica es un dominio interdisciplinario que se ha beneficiado enormemente de la información genética de varios proyectos del genoma, incluido el Proyecto del Genoma Humano. Cubre la exploración de proteomas desde el nivel general de composición, estructura y actividad de proteínas, y es un componente importante de la genómica funcional.
Proteómica generalmente denota el análisis experimental a gran escala de proteínas y proteomas, pero a menudo se refiere específicamente a la purificación de proteínas y la espectrometría de masas.
Historia y etimología
Los primeros estudios de proteínas que podrían considerarse proteómica comenzaron en 1975, tras la introducción del gel bidimensional y el mapeo de las proteínas de la bacteria Escherichia coli.
Proteoma es una mezcla de las palabras "proteína" y "genoma". Fue acuñado en 1994 por el entonces estudiante de doctorado Marc Wilkins en la Universidad de Macquarie, que fundó el primer laboratorio de proteómica dedicado en 1995.
Complejidad del problema
Después de la genómica y la transcriptómica, la proteómica es el siguiente paso en el estudio de los sistemas biológicos. Es más complicado que la genómica porque el genoma de un organismo es más o menos constante, mientras que los proteomas difieren de una célula a otra y de un momento a otro. Los distintos genes se expresan en diferentes tipos de células, lo que significa que debe identificarse incluso el conjunto básico de proteínas producidas en una célula.
En el pasado, este fenómeno se evaluó mediante análisis de ARN, que se encontró que no tenía correlación con el contenido de proteínas. Ahora se sabe que el ARNm no siempre se traduce en proteína, y que la cantidad de proteína producida para una cantidad determinada de ARNm depende del gen del que se transcribe y del estado fisiológico de la célula. La proteómica confirma la presencia de la proteína y proporciona una medida directa de su cantidad.
Modificaciones postraduccionales
La traducción del ARNm no solo causa diferencias, sino que muchas proteínas también están sujetas a una amplia variedad de modificaciones químicas después de la traducción. Las modificaciones postraduccionales más comunes y ampliamente estudiadas incluyen la fosforilación y la glicosilación. Muchas de estas modificaciones postraduccionales son críticas para la función de la proteína.
Fosforilación
Una de esas modificaciones es la fosforilación, que les ocurre a muchas enzimas y proteínas estructurales en el proceso de señalización celular. La adición de un fosfato a aminoácidos particulares, más comúnmente serina y treonina mediada por serina-treonina quinasas, o más raramente tirosina mediada por tirosina quinasas, hace que una proteína se convierta en un objetivo para unirse o interactuar con un conjunto distinto de otras proteínas que reconocer el dominio fosforilado.
Debido a que la fosforilación de proteínas es una de las modificaciones de proteínas más estudiadas, muchas modificaciones "proteómicas" los esfuerzos están orientados a determinar el conjunto de proteínas fosforiladas en una célula particular o tipo de tejido bajo circunstancias particulares. Esto alerta al científico sobre las vías de señalización que pueden estar activas en ese caso.
Ubiquitinación
La ubiquitina es una proteína pequeña que se puede unir a determinados sustratos proteicos mediante enzimas denominadas ubiquitina ligasa E3. Determinar qué proteínas están poliubiquitinadas ayuda a comprender cómo se regulan las vías de las proteínas. Esta es, por lo tanto, una "proteómica" legítima adicional; estudiar. De manera similar, una vez que un investigador determina qué sustratos son ubiquitinados por cada ligasa, es útil determinar el conjunto de ligasas expresadas en un tipo de célula particular.
Modificaciones adicionales
Además de la fosforilación y la ubiquitinación, las proteínas pueden sufrir (entre otras) metilación, acetilación, glicosilación, oxidación y nitrosilación. Algunas proteínas sufren todas estas modificaciones, a menudo en combinaciones dependientes del tiempo. Esto ilustra la complejidad potencial de estudiar la estructura y función de las proteínas.
Proteínas distintas se fabrican en entornos distintos
Una célula puede producir diferentes conjuntos de proteínas en diferentes momentos o en diferentes condiciones, por ejemplo, durante el desarrollo, la diferenciación celular, el ciclo celular o la carcinogénesis. Al aumentar aún más la complejidad del proteoma, como se mencionó, la mayoría de las proteínas pueden sufrir una amplia gama de modificaciones postraduccionales.
Por lo tanto, una "proteómica" el estudio puede volverse complejo muy rápidamente, incluso si el tema de estudio es restringido. En entornos más ambiciosos, como cuando se busca un biomarcador para un subtipo de cáncer específico, el científico proteómico podría optar por estudiar múltiples muestras de suero sanguíneo de múltiples pacientes con cáncer para minimizar los factores de confusión y tener en cuenta el ruido experimental. Por lo tanto, a veces son necesarios diseños experimentales complicados para dar cuenta de la complejidad dinámica del proteoma.
Limitaciones de los estudios de genómica y proteómica
La proteómica ofrece un nivel de comprensión diferente al de la genómica por muchas razones:
- el nivel de transcripción de un gen sólo da una estimación aproximada de su nivel de traducción en una proteína. Un MRNA producido en abundancia puede ser degradado rápidamente o traducido ineficientemente, dando lugar a una pequeña cantidad de proteína.
- como se mencionó anteriormente, muchas proteínas viven modificaciones posteriores a la traducción que afectan profundamente sus actividades; por ejemplo, algunas proteínas no están activas hasta que se vuelven fosforiladas. Métodos tales como fosfoproteomics y glucoproteomics se utilizan para estudiar modificaciones post-translacionales.
- muchas transcripciones dan lugar a más de una proteína, a través de las alteraciones posteriores a la traducción alternativas.
- muchas proteínas forman complejos con otras proteínas o moléculas de ARN, y sólo funcionan en presencia de estas otras moléculas.
- La tasa de degradación de proteínas desempeña un papel importante en el contenido de proteínas.
Reproducibilidad. Un factor importante que afecta a la reproducibilidad en los experimentos proteómicos es la elución simultánea de muchos más péptidos de los que pueden medir los espectrómetros de masas. Esto provoca diferencias estocásticas entre experimentos debido a la adquisición de péptidos trípticos dependiente de los datos. Aunque los primeros análisis de proteómica de escopeta a gran escala mostraron una variabilidad considerable entre laboratorios, presumiblemente debido en parte a diferencias técnicas y experimentales entre laboratorios, la reproducibilidad ha mejorado en análisis de espectrometría de masas más recientes, particularmente a nivel de proteína. En particular, la proteómica dirigida muestra una mayor reproducibilidad y repetibilidad en comparación con los métodos de escopeta, aunque a expensas de la densidad y la eficacia de los datos.
Calidad de los datos. El análisis proteómico es altamente susceptible de automatización y se crean grandes conjuntos de datos, que son procesados por algoritmos de software. Los parámetros de filtro se utilizan para reducir el número de resultados falsos, pero no se pueden eliminar por completo. Los científicos han expresado la necesidad de ser conscientes de que los experimentos de proteómica deben cumplir los criterios de la química analítica (calidad de datos suficiente, control de cordura, validación).
Métodos de estudio de proteínas
En proteómica, existen múltiples métodos para estudiar proteínas. Generalmente, las proteínas se pueden detectar usando anticuerpos (inmunoensayos), separación electroforética o espectrometría de masas. Si se analiza una muestra biológica compleja, se debe usar un anticuerpo muy específico en el análisis de transferencia de puntos cuantitativos (QDB) o se debe usar la separación bioquímica antes del paso de detección, ya que hay demasiados analitos en la muestra para realizar. detección y cuantificación precisas.
Detección de proteínas con anticuerpos (inmunoensayos)
Los anticuerpos contra proteínas particulares, o sus formas modificadas, se han utilizado en estudios de bioquímica y biología celular. Estas se encuentran entre las herramientas más comunes utilizadas por los biólogos moleculares en la actualidad. Existen varias técnicas y protocolos específicos que utilizan anticuerpos para la detección de proteínas. El ensayo inmunoabsorbente ligado a enzimas (ELISA) se ha utilizado durante décadas para detectar y medir cuantitativamente proteínas en muestras. El western blot se puede usar para la detección y cuantificación de proteínas individuales, donde en un paso inicial, una mezcla compleja de proteínas se separa usando SDS-PAGE y luego la proteína de interés se identifica usando un anticuerpo.
Las proteínas modificadas se pueden estudiar mediante el desarrollo de un anticuerpo específico para esa modificación. Por ejemplo, existen anticuerpos que solo reconocen ciertas proteínas cuando están fosforiladas en tirosina, se conocen como anticuerpos fosfoespecíficos. Además, existen anticuerpos específicos para otras modificaciones. Estos pueden usarse para determinar el conjunto de proteínas que han sufrido la modificación de interés.
Los inmunoensayos también se pueden llevar a cabo utilizando derivados de inmunoglobulina generados de forma recombinante o andamios de proteínas diseñados sintéticamente que se seleccionan para una alta especificidad antigénica. Dichos aglutinantes incluyen fragmentos de anticuerpos de un solo dominio (nanocuerpos), proteínas repetidas de anquirina diseñadas (DARPins) y aptámeros.
La detección de enfermedades a nivel molecular está impulsando la revolución emergente del diagnóstico y tratamiento tempranos. Un desafío que enfrenta el campo es que los biomarcadores de proteínas para el diagnóstico temprano pueden estar presentes en muy poca abundancia. El límite inferior de detección con la tecnología de inmunoensayo convencional es el rango femtomolar superior (10−13 M). La tecnología de inmunoensayo digital ha mejorado la sensibilidad de detección tres registros, al rango atomolar (10−16 M). Esta capacidad tiene el potencial de abrir nuevos avances en diagnóstico y terapia, pero tales tecnologías han sido relegadas a procedimientos manuales que no son adecuados para un uso rutinario eficiente.
Detección de proteínas sin anticuerpos
Si bien la detección de proteínas con anticuerpos sigue siendo muy común en biología molecular, también se han desarrollado otros métodos que no dependen de un anticuerpo. Estos métodos ofrecen varias ventajas, por ejemplo, a menudo pueden determinar la secuencia de una proteína o un péptido, pueden tener un mayor rendimiento que los basados en anticuerpos y, a veces, pueden identificar y cuantificar proteínas para las que no existen anticuerpos.
Métodos de detección
Uno de los primeros métodos para el análisis de proteínas ha sido la degradación de Edman (introducida en 1967), donde un solo péptido se somete a múltiples pasos de degradación química para resolver su secuencia. Estos primeros métodos han sido reemplazados en su mayoría por tecnologías que ofrecen un mayor rendimiento.
Los métodos implementados más recientemente utilizan técnicas basadas en espectrometría de masas, un desarrollo que fue posible gracias al descubrimiento de la "ionización suave" métodos desarrollados en la década de 1980, como la desorción/ionización láser asistida por matriz (MALDI) y la ionización por electropulverización (ESI). Estos métodos dieron lugar a los flujos de trabajo proteómicos de arriba hacia abajo y de abajo hacia arriba en los que a menudo se realiza una separación adicional antes del análisis (ver más abajo).
Métodos de separación
Para el análisis de muestras biológicas complejas, se requiere una reducción de la complejidad de la muestra. Esto puede realizarse fuera de línea mediante una separación unidimensional o bidimensional. Más recientemente, se han desarrollado métodos en línea en los que los péptidos individuales (en enfoques proteómicos ascendentes) se separan mediante cromatografía de fase inversa y luego se ionizan directamente mediante ESI; el acoplamiento directo de separación y análisis explica el término "en línea" análisis.
Tecnologías híbridas
Existen varias tecnologías híbridas que utilizan la purificación basada en anticuerpos de analitos individuales y luego realizan análisis espectrométricos de masas para su identificación y cuantificación. Ejemplos de estos métodos son los MSIA (inmunoensayo espectrométrico de masas), desarrollado por Randall Nelson en 1995, y el método SISCAPA (captura estándar de isótopos estables con anticuerpos antipéptidos), introducido por Leigh Anderson en 2004.
Metodologías de investigación actuales
La electroforesis en gel diferencial bidimensional de fluorescencia (2-D DIGE) puede usarse para cuantificar la variación en el proceso 2-D DIGE y establecer umbrales estadísticamente válidos para asignar cambios cuantitativos entre muestras.
El análisis proteómico comparativo puede revelar el papel de las proteínas en sistemas biológicos complejos, incluida la reproducción. Por ejemplo, el tratamiento con el insecticida triazofos provoca un aumento en el contenido de proteínas de las glándulas accesorias masculinas (Acps) del saltamontes pardo (Nilaparvata lugens (Stål)) que pueden transferirse a las hembras a través del apareamiento, provocando un aumento en la fecundidad (es decir, la tasa de natalidad) de las hembras. Para identificar los cambios en los tipos de proteínas de las glándulas accesorias (Acps) y las proteínas reproductivas que las chicharritas hembras apareadas recibieron de los chicharritas machos, los investigadores realizaron un análisis proteómico comparativo de N apareadas. lugens hembras. Los resultados indicaron que estas proteínas participan en el proceso reproductivo de N. lugens hembras y machos adultos.
El análisis de proteomas de peroxisomas de Arabidopsis se ha establecido como el principal enfoque imparcial para identificar nuevas proteínas peroxisomales a gran escala.
Existen muchos enfoques para caracterizar el proteoma humano, que se estima que contiene entre 20 000 y 25 000 proteínas no redundantes. Es probable que la cantidad de especies de proteínas únicas aumente entre 50 000 y 500 000 debido a los eventos de proteólisis y corte y empalme de ARN, y cuando también se consideran las modificaciones postraduccionales, se estima que la cantidad total de proteínas humanas únicas oscila en los pocos millones.
Además, recientemente se informaron los primeros intentos prometedores de descifrar el proteoma de los tumores animales. Este método se utilizó como método funcional en el perfilado de proteínas de Macrobrachium rosenbergii.
Tecnologías proteómicas de alto rendimiento
La proteómica ha cobrado impulso de manera constante durante la última década con la evolución de varios enfoques. Pocos de estos son nuevos y otros se basan en métodos tradicionales. Los métodos basados en espectrometría de masas, la proteómica de afinidad y los microarrays son las tecnologías más comunes para el estudio de proteínas a gran escala.
Espectrometría de masas y perfilado de proteínas
Hay dos métodos basados en espectrometría de masas que se utilizan actualmente para el perfilado de proteínas. El método más establecido y generalizado utiliza electroforesis bidimensional de alta resolución para separar proteínas de diferentes muestras en paralelo, seguido de la selección y tinción de proteínas expresadas diferencialmente para identificarlas mediante espectrometría de masas. A pesar de los avances en 2-DE y su madurez, también tiene sus límites. La preocupación central es la incapacidad de resolver todas las proteínas dentro de una muestra, dada su dramática variedad en el nivel de expresión y las diferentes propiedades. La combinación del tamaño de los poros y la carga, el tamaño y la forma de las proteínas puede determinar en gran medida la tasa de migración, lo que conduce a otras complicaciones.
El segundo enfoque cuantitativo utiliza etiquetas de isótopos estables para marcar diferencialmente proteínas de dos mezclas complejas diferentes. Aquí, las proteínas dentro de una mezcla compleja se marcan isotópicamente primero y luego se digieren para producir péptidos marcados. A continuación, las mezclas marcadas se combinan, los péptidos se separan mediante cromatografía líquida multidimensional y se analizan mediante espectrometría de masas en tándem. Los reactivos de etiquetas de afinidad codificadas por isótopos (ICAT) son las etiquetas de isótopos ampliamente utilizadas. En este método, los residuos de cisteína de las proteínas se unen de forma covalente al reactivo ICAT, lo que reduce la complejidad de las mezclas omitiendo los residuos que no son de cisteína.
La proteómica cuantitativa que utiliza el etiquetado de isótopos estables es una herramienta cada vez más útil en el desarrollo moderno. En primer lugar, se han utilizado reacciones químicas para introducir etiquetas en sitios o proteínas específicos con el fin de probar funcionalidades de proteínas específicas. El aislamiento de los péptidos fosforilados se ha logrado mediante marcado isotópico y química selectiva para capturar la fracción de proteína entre la mezcla compleja. En segundo lugar, la tecnología ICAT se utilizó para diferenciar entre complejos macromoleculares parcialmente purificados o purificados, como el complejo de preiniciación de la ARN polimerasa II grande, y las proteínas complejadas con el factor de transcripción de levadura. En tercer lugar, el etiquetado ICAT se combinó recientemente con el aislamiento de cromatina para identificar y cuantificar las proteínas asociadas a la cromatina. Finalmente, los reactivos ICAT son útiles para el perfil proteómico de orgánulos celulares y fracciones celulares específicas.
Otro enfoque cuantitativo es el enfoque de etiquetas precisas de masa y tiempo (AMT) desarrollado por Richard D. Smith y sus compañeros de trabajo en el Laboratorio Nacional del Noroeste del Pacífico. En este enfoque, se logra un mayor rendimiento y sensibilidad evitando la necesidad de espectrometría de masas en tándem y haciendo uso de información de tiempo de separación determinada con precisión y determinaciones de masa altamente precisas para identificaciones de péptidos y proteínas.
Proteómica de afinidad
La proteómica de afinidad utiliza anticuerpos u otros reactivos de afinidad (como aptámeros basados en oligonucleótidos) como sondas de detección específicas de proteínas. Actualmente, este método puede interrogar a varios miles de proteínas, normalmente de biofluidos como plasma, suero o líquido cefalorraquídeo (LCR). Un diferenciador clave de esta tecnología es la capacidad de analizar cientos o miles de muestras en un período de tiempo razonable (cuestión de días o semanas); Los métodos basados en espectrometría de masas no son escalables a este nivel de rendimiento de muestras para análisis proteómicos.
Chips de proteína
Equilibrar el uso de espectrómetros de masas en proteómica y en medicina es el uso de micromatrices de proteínas. El objetivo detrás de los microarrays de proteínas es imprimir miles de características de detección de proteínas para el interrogatorio de muestras biológicas. Las matrices de anticuerpos son un ejemplo en el que se dispone una gran cantidad de anticuerpos diferentes para detectar sus respectivos antígenos a partir de una muestra de sangre humana. Otro enfoque es la disposición de múltiples tipos de proteínas para el estudio de propiedades como las interacciones proteína-ADN, proteína-proteína y proteína-ligando. Idealmente, las matrices proteómicas funcionales contendrían todo el complemento de las proteínas de un organismo dado. La primera versión de dichas matrices constaba de 5000 proteínas purificadas de levadura depositadas en portaobjetos de microscopio de vidrio. A pesar del éxito del primer chip, la implementación de matrices de proteínas supuso un desafío mayor. Las proteínas son inherentemente mucho más difíciles de trabajar que el ADN. Tienen un amplio rango dinámico, son menos estables que el ADN y su estructura es difícil de conservar en portaobjetos de vidrio, aunque son esenciales para la mayoría de los ensayos. La tecnología ICAT global tiene ventajas sorprendentes sobre las tecnologías de chips de proteínas.
Microarrays de proteínas de fase inversa
Esta es una aplicación de microarrays nueva y prometedora para el diagnóstico, estudio y tratamiento de enfermedades complejas como el cáncer. La tecnología combina la microdisección de captura láser (LCM) con la tecnología de micromatrices para producir micromatrices de proteínas de fase inversa. En este tipo de micromatrices, la colección completa de proteínas se inmoviliza con la intención de capturar varias etapas de la enfermedad dentro de un paciente individual. Cuando se usa con LCM, las matrices de fase inversa pueden monitorear el estado fluctuante del proteoma entre diferentes poblaciones de células dentro de una pequeña área de tejido humano. Esto es útil para perfilar el estado de las moléculas de señalización celular, entre una sección transversal de tejido que incluye tanto células normales como cancerosas. Este enfoque es útil para controlar el estado de los factores clave en el epitelio de próstata normal y los tejidos de cáncer de próstata invasivo. Luego, LCM disecciona estos tejidos y los lisados de proteínas se colocaron en portaobjetos de nitrocelulosa, que se probaron con anticuerpos específicos. Este método puede rastrear todo tipo de eventos moleculares y puede comparar tejidos enfermos y sanos dentro del mismo paciente, lo que permite el desarrollo de estrategias de tratamiento y diagnóstico. La capacidad de adquirir instantáneas proteómicas de poblaciones de células vecinas, utilizando micromatrices de fase inversa junto con LCM, tiene una serie de aplicaciones más allá del estudio de tumores. El enfoque puede proporcionar información sobre la fisiología y la patología normales de todos los tejidos y es invaluable para caracterizar los procesos y anomalías del desarrollo.
Detección de proteínas mediante química bioortogonal
Los avances recientes en la química bioortogonal han revelado aplicaciones en el análisis de proteínas. La extensión del uso de moléculas orgánicas para observar su reacción con las proteínas revela métodos extensos para etiquetarlas. Los aminoácidos no naturales y varios grupos funcionales representan nuevas tecnologías de cultivo en proteómica.
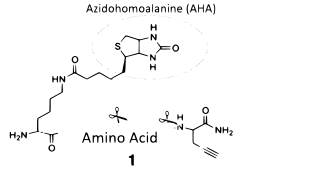
Las biomoléculas específicas que pueden metabolizarse en células o tejidos se insertan en proteínas o glicanos. La molécula tendrá una etiqueta de afinidad, modificando la proteína permitiendo su detección. La azidohomoalanina (AHA) utiliza esta etiqueta de afinidad mediante la incorporación con Met-t-RNA sintetasa para incorporarse a las proteínas. Esto ha permitido que la AHA ayude a determinar la identidad de las proteínas recién sintetizadas creadas en respuesta a perturbaciones e identificar las proteínas secretadas por las células.
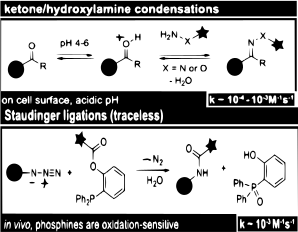
Estudios recientes que utilizan condensaciones de cetonas y aldehídos muestran que son los más adecuados para el etiquetado in vitro o de la superficie celular. Sin embargo, el uso de cetonas y aldehídos como indicadores bioortogonales reveló una cinética lenta que indica que, si bien es eficaz para el etiquetado, la concentración debe ser alta.
Ciertas proteínas se pueden detectar a través de su reactividad a los grupos azida. Los aminoácidos no proteinogénicos pueden tener grupos azida que reaccionan con las fosfinas en las ligaduras de Staudinger. Esta reacción ya se ha utilizado para marcar otras biomoléculas en células vivas y animales.
El campo bioortoganal se está expandiendo y está impulsando más aplicaciones dentro de la proteómica. Vale la pena señalar las limitaciones y los beneficios. Las reacciones rápidas pueden crear bioconjunciones y crear altas concentraciones con bajas cantidades de reactivos. Por el contrario, las reacciones cinéticas lentas como la condensación de aldehídos y cetonas, si bien son efectivas, requieren una alta concentración, lo que las hace ineficientes desde el punto de vista económico.
Aplicaciones prácticas
Descubrimiento de nuevos fármacos
Un avance importante derivado del estudio de los genes y proteínas humanos ha sido la identificación de nuevos fármacos potenciales para el tratamiento de enfermedades. Esto se basa en la información del genoma y el proteoma para identificar proteínas asociadas con una enfermedad, que el software de computadora puede usar como objetivos para nuevos medicamentos. Por ejemplo, si una determinada proteína está implicada en una enfermedad, su estructura 3D proporciona la información para diseñar fármacos que interfieran con la acción de la proteína. Una molécula que se ajusta al sitio activo de una enzima, pero que la enzima no puede liberarla, inactiva la enzima. Esta es la base de las nuevas herramientas de descubrimiento de fármacos, cuyo objetivo es encontrar nuevos fármacos para inactivar las proteínas involucradas en la enfermedad. A medida que se encuentren diferencias genéticas entre los individuos, los investigadores esperan utilizar estas técnicas para desarrollar medicamentos personalizados que sean más efectivos para el individuo.
La proteómica también se usa para revelar interacciones complejas entre plantas e insectos que ayudan a identificar genes candidatos involucrados en la respuesta defensiva de las plantas a la herbivoría.
Una rama de la proteómica denominada quimioproteómica proporciona numerosas herramientas y técnicas para detectar objetivos proteicos de fármacos.
Proteómica de interacción y redes de proteínas
La proteómica de interacción es el análisis de las interacciones de proteínas desde escalas de interacciones binarias hasta el proteoma o toda la red. La mayoría de las proteínas funcionan a través de interacciones proteína-proteína, y uno de los objetivos de la proteómica de interacción es identificar interacciones de proteínas binarias, complejos de proteínas e interactomas.
Hay varios métodos disponibles para sondear las interacciones proteína-proteína. Si bien el método más tradicional es el análisis de dos híbridos de levadura, un poderoso método emergente es la purificación por afinidad seguida de espectrometría de masas de proteínas utilizando cebos de proteínas marcadas. Otros métodos incluyen resonancia de plasmones superficiales (SPR), micromatrices de proteínas, interferometría de polarización dual, termoforesis a microescala, ensayo de exclusión cinética y métodos experimentales como visualización de fagos y métodos computacionales in silico.
El conocimiento de las interacciones proteína-proteína es especialmente útil con respecto a las redes biológicas y la biología de sistemas, por ejemplo, en cascadas de señalización celular y redes reguladoras de genes (GRN, donde el conocimiento de las interacciones proteína-ADN también es informativo). El análisis de las interacciones proteicas en todo el proteoma y la integración de estos patrones de interacción en redes biológicas más grandes son cruciales para comprender la biología a nivel de sistemas.
Proteómica de expresión
La proteómica de la expresión incluye el análisis de la expresión de proteínas a mayor escala. Ayuda a identificar las proteínas principales en una muestra en particular y aquellas proteínas expresadas diferencialmente en muestras relacionadas, como tejido enfermo versus tejido sano. Si una proteína se encuentra solo en una muestra enferma, entonces puede ser un objetivo de fármaco útil o un marcador de diagnóstico. Las proteínas con perfiles de expresión iguales o similares también pueden estar relacionadas funcionalmente. Existen tecnologías como 2D-PAGE y espectrometría de masas que se utilizan en la proteómica de expresión.
Biomarcadores
Los Institutos Nacionales de Salud han definido un biomarcador como "una característica que se mide y evalúa objetivamente como un indicador de procesos biológicos normales, procesos patogénicos o respuestas farmacológicas a una intervención terapéutica".
Comprender el proteoma, la estructura y la función de cada proteína y las complejidades de las interacciones proteína-proteína son fundamentales para desarrollar las técnicas de diagnóstico y los tratamientos de enfermedades más efectivos en el futuro. Por ejemplo, la proteómica es muy útil en la identificación de biomarcadores candidatos (proteínas en los fluidos corporales que son valiosas para el diagnóstico), la identificación de los antígenos bacterianos a los que se dirige la respuesta inmunitaria y la identificación de posibles marcadores inmunohistoquímicos de enfermedades infecciosas o neoplásicas..
Un uso interesante de la proteómica es el uso de biomarcadores de proteínas específicas para diagnosticar enfermedades. Varias técnicas permiten analizar las proteínas producidas durante una enfermedad en particular, lo que ayuda a diagnosticar la enfermedad rápidamente. Las técnicas incluyen western blot, tinción inmunohistoquímica, ensayo inmunoabsorbente ligado a enzimas (ELISA) o espectrometría de masas. La secretómica, un subcampo de la proteómica que estudia las proteínas secretadas y las vías de secreción utilizando enfoques proteómicos, ha surgido recientemente como una herramienta importante para el descubrimiento de biomarcadores de enfermedades.
Proteogenómica
En proteogenómica, las tecnologías proteómicas, como la espectrometría de masas, se utilizan para mejorar las anotaciones de genes. El análisis paralelo del genoma y el proteoma facilita el descubrimiento de modificaciones postraduccionales y eventos proteolíticos, especialmente cuando se comparan múltiples especies (proteogenómica comparativa).
Proteómica estructural
La proteómica estructural incluye el análisis de estructuras de proteínas a gran escala. Compara estructuras de proteínas y ayuda a identificar funciones de genes recién descubiertos. El análisis estructural también ayuda a comprender dónde se unen los fármacos a las proteínas y también muestra dónde interactúan las proteínas entre sí. Esta comprensión se logra utilizando diferentes tecnologías, como la cristalografía de rayos X y la espectroscopia de RMN.
Bioinformática para proteómica (informática proteómica)
Muchos datos proteómicos se recopilan con la ayuda de tecnologías de alto rendimiento, como la espectrometría de masas y los microarrays. A menudo tomaba semanas o meses analizar los datos y realizar comparaciones a mano. Por esta razón, los biólogos y químicos están colaborando con informáticos y matemáticos para crear programas y canalizaciones para analizar computacionalmente los datos de proteínas. Utilizando técnicas bioinformáticas, los investigadores son capaces de realizar análisis y almacenamiento de datos más rápidos. Un buen lugar para encontrar listas de programas y bases de datos actuales es el portal de recursos de bioinformática ExPASy. Las aplicaciones de la proteómica basada en bioinformática incluyen medicina, diagnóstico de enfermedades, identificación de biomarcadores y muchas más.
Identificación de proteínas
La espectrometría de masas y los microarrays producen información sobre la fragmentación de péptidos, pero no identifican las proteínas específicas presentes en la muestra original. Debido a la falta de identificación de proteínas específicas, los investigadores anteriores se vieron obligados a descifrar los fragmentos de péptidos. Sin embargo, actualmente existen programas disponibles para la identificación de proteínas. Estos programas toman la salida de secuencias de péptidos de espectrometría de masas y micromatrices y devuelven información sobre proteínas similares o coincidentes. Esto se hace a través de algoritmos implementados por el programa que realizan alineaciones con proteínas de bases de datos conocidas como UniProt y PROSITE para predecir qué proteínas hay en la muestra con cierto grado de certeza.
Estructura proteica
La estructura biomolecular forma la configuración 3D de la proteína. Comprender la estructura de la proteína ayuda a identificar las interacciones y la función de la proteína. Solía ser que la estructura 3D de las proteínas solo podía determinarse mediante cristalografía de rayos X y espectroscopia de RMN. A partir de 2017, la microscopía crioelectrónica es una técnica líder que resuelve las dificultades de cristalización (en cristalografía de rayos X) y la ambigüedad conformacional (en RMN); la resolución era de 2,2 Å a partir de 2015. Ahora, a través de la bioinformática, existen programas informáticos que, en algunos casos, pueden predecir y modelar la estructura de las proteínas. Estos programas utilizan las propiedades químicas de los aminoácidos y las propiedades estructurales de las proteínas conocidas para predecir el modelo 3D de las proteínas de muestra. Esto también permite a los científicos modelar interacciones de proteínas a mayor escala. Además, los ingenieros biomédicos están desarrollando métodos para tener en cuenta la flexibilidad de las estructuras de proteínas para hacer comparaciones y predicciones.
Modificaciones postraduccionales
La mayoría de los programas disponibles para el análisis de proteínas no están escritos para proteínas que han sufrido modificaciones postraduccionales. Algunos programas aceptarán modificaciones posteriores a la traducción para ayudar en la identificación de proteínas, pero luego ignorarán la modificación durante el análisis de proteínas adicional. Es importante tener en cuenta estas modificaciones ya que pueden afectar la estructura de la proteína. A su vez, el análisis computacional de las modificaciones postraduccionales ha llamado la atención de la comunidad científica. Los actuales programas de modificación postraduccional son únicamente predictivos. Químicos, biólogos e informáticos están trabajando juntos para crear e introducir nuevos procesos que permitan el análisis de modificaciones postraduccionales que han sido identificadas experimentalmente por su efecto en la estructura y función de la proteína.
Métodos computacionales en el estudio de biomarcadores de proteínas
Un ejemplo del uso de la bioinformática y el uso de métodos computacionales es el estudio de biomarcadores de proteínas. Los modelos predictivos computacionales han demostrado que durante el embarazo se produce un tráfico extenso y diverso de proteínas feto-maternas y que se puede detectar fácilmente de forma no invasiva en la sangre entera materna. Este enfoque computacional eludió una limitación importante, la abundancia de proteínas maternas que interfieren con la detección de proteínas fetales, para el análisis proteómico fetal de la sangre materna. Los modelos computacionales pueden usar transcripciones de genes fetales previamente identificados en sangre completa materna para crear una red proteómica integral del término neonato. Tal trabajo muestra que las proteínas fetales detectadas en la sangre de la mujer embarazada se originan en un grupo diverso de tejidos y órganos del feto en desarrollo. Las redes proteómicas contienen muchos biomarcadores que son indicadores del desarrollo e ilustran la aplicación clínica potencial de esta tecnología como una forma de monitorear el desarrollo fetal normal y anormal.
También se ha introducido un marco teórico de la información para el descubrimiento de biomarcadores, que integra información de biofluidos y tejidos. Este nuevo enfoque aprovecha la sinergia funcional entre ciertos biofluidos y tejidos con el potencial de hallazgos clínicamente significativos que no serían posibles si los tejidos y los biofluidos se consideraran individualmente. Al conceptualizar los biofluidos tisulares como canales de información, se pueden identificar proxies de biofluidos significativos y luego utilizarlos para el desarrollo guiado de diagnósticos clínicos. Los biomarcadores candidatos se pronostican luego en función de los criterios de transferencia de información a través de los canales de biofluidos tisulares. Las relaciones biofluido-tejido significativas se pueden utilizar para priorizar la validación clínica de los biomarcadores.
Tendencias emergentes
Varios conceptos emergentes tienen el potencial de mejorar las características actuales de la proteómica. Obtener la cuantificación absoluta de las proteínas y monitorear las modificaciones postraduccionales son las dos tareas que impactan en la comprensión de la función de las proteínas en células sanas y enfermas. Para muchos eventos celulares, las concentraciones de proteínas no cambian; más bien, su función está modulada por modificaciones postraduccionales (PTM). Los métodos de monitoreo de PTM son un área subdesarrollada en proteómica. Seleccionar un subconjunto particular de proteína para el análisis reduce sustancialmente la complejidad de la proteína, lo que lo hace ventajoso para fines de diagnóstico donde la sangre es el material de partida. Otro aspecto importante de la proteómica, que aún no se aborda, es que los métodos proteómicos deben centrarse en estudiar las proteínas en el contexto del medio ambiente. El uso cada vez mayor de reticuladores químicos, introducidos en las células vivas para fijar proteínas-proteínas, proteínas-ADN y otras interacciones, puede mejorar parcialmente este problema. El desafío es identificar métodos adecuados para preservar las interacciones relevantes. Otro objetivo del estudio de las proteínas es desarrollar métodos más sofisticados para obtener imágenes de proteínas y otras moléculas en células vivas y en tiempo real.
Biología de sistemas
Los avances en la proteómica cuantitativa claramente permitirían un análisis más profundo de los sistemas celulares. Otra frontera de la investigación es el análisis de células individuales y la covariación de proteínas entre células individuales que refleja procesos biológicos como la formación de complejos de proteínas, funciones inmunitarias, así como el ciclo celular y la preparación de células cancerosas para la resistencia a los medicamentos. Los sistemas biológicos están sujetos a una variedad de perturbaciones (ciclo celular, diferenciación celular, carcinogénesis, medio ambiente (biofísico), etc.). Las respuestas transcripcionales y traduccionales a estas perturbaciones dan como resultado cambios funcionales en el proteoma implicado en respuesta al estímulo. Por lo tanto, describir y cuantificar los cambios en la abundancia de proteínas en todo el proteoma es crucial para comprender el fenómeno biológico de manera más holística, a nivel de todo el sistema. De esta manera, la proteómica puede verse como un complemento de la genómica, la transcriptómica, la epigenómica, la metabolómica y otros enfoques -ómicos en los análisis integradores que intentan definir los fenotipos biológicos de manera más integral. Como ejemplo, The Cancer Proteome Atlas proporciona datos cuantitativos de expresión de proteínas para ~200 proteínas en más de 4000 muestras de tumores con datos transcriptómicos y genómicos coincidentes de The Cancer Genome Atlas. Conjuntos de datos similares en otros tipos de células, tipos de tejidos y especies, en particular mediante espectrometría de masas de escopeta profunda, serán un recurso inmensamente importante para la investigación en campos como la biología del cáncer, la biología de células madre y del desarrollo, la medicina y la biología evolutiva.
Proteoma de plasma humano
La caracterización del proteoma del plasma humano se ha convertido en un objetivo importante en el campo de la proteómica, pero también es el proteoma más desafiante de todos los tejidos humanos. Contiene inmunoglobulina, citocinas, hormonas proteicas y proteínas secretadas indicativas de infección además de proteínas hemostáticas residentes. También contiene proteínas de fuga de tejido debido a la circulación sanguínea a través de diferentes tejidos del cuerpo. La sangre contiene así información sobre el estado fisiológico de todos los tejidos y, en combinación con su accesibilidad, hace que el proteoma de la sangre sea invaluable para fines médicos. Se cree que caracterizar el proteoma del plasma sanguíneo es un desafío abrumador.
La profundidad del proteoma plasmático abarca un rango dinámico de más de 1010 entre la proteína más abundante (albúmina) y la más baja (algunas citoquinas) y se cree que es uno de los principales desafíos para la proteómica. La dinámica temporal y espacial complica aún más el estudio del proteoma del plasma humano. El recambio de algunas proteínas es bastante más rápido que el de otras y el contenido proteico de una arteria puede variar sustancialmente del de una vena. Todas estas diferencias hacen que incluso la tarea proteómica más simple de catalogar el proteoma parezca fuera de alcance. Para abordar este problema, es necesario establecer prioridades. Capturar el subconjunto de proteínas más significativo entre todo el proteoma para generar una herramienta de diagnóstico es una de esas prioridades. En segundo lugar, dado que el cáncer está asociado con una mayor glicosilación de proteínas, también serán útiles los métodos que se centren en esta parte de las proteínas. De nuevo: el análisis multiparamétrico revela mejor un estado patológico. A medida que mejoran estas tecnologías, los perfiles de enfermedades deben relacionarse continuamente con los cambios de expresión génica respectivos. Debido a los problemas antes mencionados, la proteómica del plasma seguía siendo un desafío. Sin embargo, los avances tecnológicos y los desarrollos continuos parecen dar como resultado un renacimiento de la proteómica del plasma, como lo demostró recientemente una tecnología llamada perfilado del proteoma del plasma. Gracias a estas tecnologías, los investigadores pudieron investigar los procesos de inflamación en ratones, la heredabilidad de los proteomas plasmáticos y demostrar el efecto de un cambio de estilo de vida tan común como la pérdida de peso en el proteoma plasmático.
Diarios
Numerosas revistas están dedicadas al campo de la proteómica y áreas afines. Tenga en cuenta que las revistas que se ocupan de proteínas suelen centrarse más en la estructura y la función, mientras que las revistas de proteómica se centran más en el análisis a gran escala de proteomas completos o al menos grandes conjuntos de proteínas.. Algunos de los más importantes se enumeran a continuación (con sus editores).
- Proteomics moleculares y celulares (ASBMB)
- Journal of Proteome Research (ACS)
- Journal of Proteomics (Elsevier)
- Proteomics (Wiley)
Contenido relacionado
Hachís
Perciformes
Cuello uterino