Proceso termodinámico
La termodinámica clásica considera tres tipos principales de procesos termodinámicos: (1) cambios en un sistema, (2) ciclos en un sistema y (3) procesos de flujo.
(1) Un proceso termodinámico es un proceso en el que se cambia el estado termodinámico de un sistema. Un cambio en un sistema se define por el paso de un estado inicial a un estado final de equilibrio termodinámico. En la termodinámica clásica, el curso real del proceso no es la principal preocupación y, a menudo, se ignora. Un estado de equilibrio termodinámico perdura sin cambios a menos que sea interrumpido por una operación termodinámica que inicie un proceso termodinámico. Cada uno de los estados de equilibrio está completamente especificado, respectivamente, por un conjunto adecuado de variables de estado termodinámicas, que dependen sólo del estado actual del sistema, no del camino tomado por los procesos que producen el estado. En general, durante el curso real de un proceso termodinámico, el sistema puede pasar por estados físicos que no pueden describirse como estados termodinámicos, porque están lejos del equilibrio termodinámico interno. La termodinámica del desequilibrio, sin embargo, considera procesos en los que los estados del sistema están próximos al equilibrio termodinámico y pretende describir el paso continuo a lo largo del camino, a ritmos de progreso definidos.
Como caso límite teórico útil, pero no físicamente realizable, se puede imaginar que un proceso tiene lugar de manera prácticamente infinitamente lenta o lo suficientemente suave como para permitir que se describa mediante una trayectoria continua de estados termodinámicos de equilibrio, cuando se le llama & #34;cuasi-estático" proceso. Este es un ejercicio teórico de geometría diferencial, en contraposición a una descripción de un proceso físico realmente posible; en este caso idealizado, el cálculo puede ser exacto.
Un proceso termodinámico realmente posible o real, considerado de cerca, implica fricción. Esto contrasta con los procesos cuasiestáticos teóricamente idealizados, imaginados o limitantes, pero no posibles en realidad, que pueden ocurrir con una lentitud teórica que evita la fricción. También contrasta con los procesos idealizados sin fricción en el entorno, que pueden considerarse como "sistemas puramente mecánicos"; esta diferencia se acerca a definir un proceso termodinámico.
(2) Un proceso cíclico lleva al sistema a través de un ciclo de etapas, comenzando y finalizando en algún estado particular. Las descripciones de los estados escalonados del sistema no son la preocupación principal. La principal preocupación son las sumas de las entradas y salidas de materia y energía del ciclo. Los procesos cíclicos fueron dispositivos conceptuales importantes en los primeros días de la investigación termodinámica, mientras se desarrollaba el concepto de variable de estado termodinámico.
(3) Definido por los flujos a través de un sistema, un proceso de flujo es un estado estable de flujos que entran y salen de un recipiente con propiedades de pared definidas. El estado interno del contenido del recipiente no es la principal preocupación. Las cantidades de interés principal describen los estados de los materiales que entran y salen y, por otro lado, las transferencias de calor, trabajo y energías cinéticas y potenciales del buque. Los procesos de flujo son de interés en ingeniería.
Tipos de proceso
Proceso cíclico
Definido por un ciclo de transferencias dentro y fuera de un sistema, un proceso cíclico se describe por las cantidades transferidas en las distintas etapas del ciclo. Las descripciones de los estados escalonados del sistema pueden tener poco o incluso ningún interés. Un ciclo es una secuencia de un pequeño número de procesos termodinámicos que, a menudo de forma indefinida y repetida, devuelven el sistema a su estado original. Para ello no se describen necesariamente los estados por etapas, ya que lo que interesa son las transferencias. Se razona que si el ciclo puede repetirse indefinidamente, entonces se puede suponer que los estados se mantienen recurrentemente sin cambios. La condición del sistema durante los diversos procesos en etapas puede ser incluso de menos interés que la naturaleza precisa de los estados recurrentes. Sin embargo, si los distintos procesos en etapas son idealizados y cuasiestáticos, entonces el ciclo se describe mediante un camino a través de una progresión continua de estados de equilibrio.
Proceso de flujo
Un proceso de flujo, definido por los flujos a través de un sistema, es un estado estable de flujo que entra y sale de un recipiente con propiedades de pared definidas. El estado interno del contenido del recipiente no es la principal preocupación. Las cantidades de interés principal describen los estados de los materiales que entran y salen y, por otro lado, las transferencias de calor, trabajo y energías cinéticas y potenciales del buque. Los estados de los materiales que entran y salen consisten en sus estados internos y en sus energías cinética y potencial como cuerpos completos. Muy a menudo, las cantidades que describen los estados internos de los materiales de entrada y salida se estiman suponiendo que son cuerpos en sus propios estados de equilibrio termodinámico interno. Como se permiten reacciones rápidas, el tratamiento termodinámico puede ser aproximado, no exacto.
Un ciclo de procesos cuasiestáticos
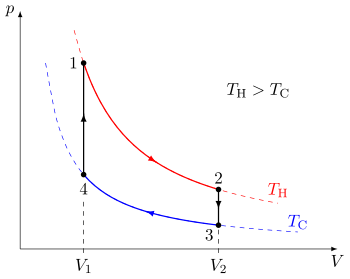
Se puede visualizar un proceso termodinámico cuasiestático trazando gráficamente la trayectoria de los cambios idealizados en las variables de estado del sistema. En el ejemplo se muestra un ciclo que consta de cuatro procesos cuasiestáticos. Cada proceso tiene un punto de inicio y fin bien definido en el espacio de estados de presión-volumen. En este ejemplo particular, los procesos 1 y 3 son isotérmicos, mientras que los procesos 2 y 4 son isocóricos. El diagrama PV es una visualización particularmente útil de un proceso cuasiestático, porque el área bajo la curva de un proceso es la cantidad de trabajo realizado por el sistema durante ese proceso. Por lo tanto, el trabajo se considera una variable de proceso, ya que su valor exacto depende del camino particular tomado entre los puntos inicial y final del proceso. De manera similar, el calor puede transferirse durante un proceso y también es una variable del proceso.
Procesos de variables conjugadas
A menudo resulta útil agrupar procesos en pares, en los que cada variable mantenida constante es un miembro de un par conjugado.
Presión – volumen
El par conjugado presión-volumen se ocupa de la transferencia de energía mecánica como resultado del trabajo.
- An proceso isobarico ocurre a presión constante. Un ejemplo sería tener un pistón móvil en un cilindro, para que la presión dentro del cilindro esté siempre a presión atmosférica, aunque esté separada de la atmósfera. En otras palabras, el sistema es dinámicamente conectado, por un límite móvil, a un depósito de presión constante.
- An proceso isochoric es uno en el que el volumen se mantiene constante, con el resultado de que el trabajo mecánico PV realizado por el sistema será cero. Por otro lado, el trabajo se puede realizar esocóricamente en el sistema, por ejemplo por un eje que conduce una paleta rotativa situada dentro del sistema. De ahí que, para el sistema simple de una variable de deformación, cualquier energía térmica transferida al sistema externamente será absorbida como energía interna. Un proceso isocólico también se conoce como un isométrica proceso o isovolumetric proceso. Un ejemplo sería colocar una lata cerrada de material en un fuego. A una primera aproximación, la lata no se expandirá, y el único cambio será que el contenido obtenga energía interna, evidenciada por el aumento de la temperatura y la presión. Matemáticamente, δ δ Q=dU{displaystyle delta Q=dU}. El sistema es dinámicamente aislado, por un límite rígido, desde el medio ambiente.
Temperatura – entropía
El par conjugado temperatura-entropía se ocupa de la transferencia de energía, especialmente para un sistema cerrado.
- An proceso isotérmico ocurre a una temperatura constante. Un ejemplo sería un sistema cerrado inmerso y térmicamente conectado con un gran baño de temperatura constante. La energía obtenida por el sistema, a través del trabajo realizado en él, se pierde al baño, de modo que su temperatura permanece constante.
- An proceso adiabático es un proceso en el que no hay materia o transferencia de calor, porque un pared aislante térmica separa el sistema de su entorno. Para que el proceso sea natural, ya sea (a) el trabajo debe hacerse en el sistema a un ritmo finito, de modo que la energía interna del sistema aumenta; la entropía del sistema aumenta a pesar de que está aislado térmicamente; o (b) el sistema debe hacer trabajo en el entorno, que luego sufre aumento de la entropía, así como obtener energía del sistema.
- An proceso istrópico se define habitualmente como un proceso adiabático cuasi estático idealizado, de transferencia de energía como trabajo. De lo contrario, para un proceso constante-entropía, si el trabajo se realiza irreversiblemente, la transferencia de calor es necesaria, de modo que el proceso no es adiabático, y es necesario un mecanismo de control artificial preciso; por lo tanto, no es un proceso termodinámico natural ordinario.
Potencial químico - número de partículas
Los procesos anteriores han asumido que los límites también son impermeables a las partículas. De lo contrario, podemos suponer que los límites son rígidos, pero permeables a uno o más tipos de partículas. Se aplican consideraciones similares para el par conjugado potencial químico-número de partícula, que se ocupa de la transferencia de energía a través de esta transferencia de partículas.
- En un proceso potencial químico constante el sistema es tarticle-transfer connected, por un límite permeable de partículas, a un depósito constante-μ.
- El conjugado aquí es un proceso constante de número de partículas. Estos son los procesos esbozados justo arriba. No hay energía añadida o restada del sistema por transferencia de partículas. El sistema es particle-transfer-insulated desde su entorno por un límite que es impermeable a partículas, pero permisivo de transferencias de energía como trabajo o calor. Estos procesos son los que definen el trabajo termodinámico y el calor, y para ellos se dice que el sistema está cerrado.
Potenciales termodinámicos
Cualquiera de los potenciales termodinámicos puede mantenerse constante durante un proceso. Por ejemplo:
- An proceso isenthalpic no introduce ningún cambio en la enthalpy en el sistema.
Procesos politrópicos
Un proceso politrópico es un proceso termodinámico que obedece a la relación:
- PVn=C,{displaystyle PV^{,n}=C}
donde P es la presión, V es el volumen, n es cualquier número real (el "índice politrópico" ), y C es una constante. Esta ecuación se puede utilizar para caracterizar con precisión procesos de ciertos sistemas, en particular la compresión o expansión de un gas, pero en algunos casos, líquidos y sólidos.
Procesos clasificados por la segunda ley de la termodinámica
Según Planck, se pueden pensar en tres clases principales de procesos termodinámicos: naturales, ficticiamente reversibles e imposibles o antinaturales.
Proceso natural
En la naturaleza sólo ocurren procesos naturales. Para la termodinámica, un proceso natural es una transferencia entre sistemas que aumenta la suma de sus entropías, y es irreversible. Los procesos naturales pueden ocurrir espontáneamente tras la eliminación de una restricción, o ante alguna otra operación termodinámica, o pueden desencadenarse en un sistema metaestable o inestable, como por ejemplo en la condensación de un vapor sobresaturado. Planck enfatizó la aparición de fricción como una característica importante de los procesos termodinámicos naturales que implican la transferencia de materia o energía entre el sistema y el entorno.
Proceso efectivamente reversible
Para describir la geometría de las superficies gráficas que ilustran las relaciones de equilibrio entre funciones termodinámicas de estado, nadie puede pensar ficticiamente en los llamados "procesos reversibles". Son objetos teóricos convenientes que trazan caminos a través de superficies gráficas. Se denominan "procesos" pero no describen procesos que ocurren naturalmente, que siempre son irreversibles. Debido a que los puntos de las trayectorias son puntos de equilibrio termodinámico, se acostumbra pensar en los "procesos" descrito por los caminos como ficticiamente "reversible". Los procesos reversibles son siempre procesos cuasiestáticos, pero lo contrario no siempre es cierto.
Proceso antinatural
Los procesos antinaturales son lógicamente concebibles pero no ocurren en la naturaleza. Disminuirían la suma de las entropías si ocurrieran.
Proceso cuasiestático
Un proceso cuasiestático es un modelo idealizado o ficticio de un “proceso” termodinámico. considerados en los estudios teóricos. No ocurre en la realidad física. Se puede imaginar que ocurre infinitamente lentamente, de modo que el sistema pasa a través de un continuo de estados que están infinitamente cerca del equilibrio.
Contenido relacionado
Ley de Fick
Fuerza nuclear débil
Dalton (unidad)
Fuerza nuclear fuerte
Cátodo

