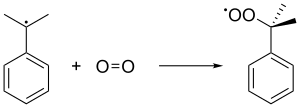Proceso de cumeno
El proceso cumeno (proceso cumeno-fenol, proceso Hock) es un proceso industrial para sintetizar fenol y acetona a partir de benceno y propileno. El término proviene del cumeno (isopropilbenceno), el material intermedio durante el proceso. Fue inventado por R. Ūdris y P. Sergeyev en 1942 (URSS), e independientemente por Heinrich Hock en 1944.
Este proceso convierte dos materiales de partida relativamente baratos, benceno y propileno, en dos más valiosos, fenol y acetona. Otros reactivos necesarios son el oxígeno del aire y pequeñas cantidades de un iniciador de radicales. La mayor parte de la producción mundial de fenol y acetona ahora se basa en este método. En 2003, se produjeron casi 7 millones de toneladas de fenol mediante el proceso de cumeno. Para que este proceso sea económico, también debe haber demanda del subproducto acetona, así como del fenol.
Pasos del proceso
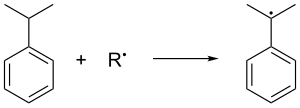
El cumeno se forma en la alquilación de benceno de Friedel-Crafts en fase gaseosa por propeno. El benceno y el propeno se comprimen juntos a una presión de 30 atmósferas estándar a 250 °C en presencia de un ácido de Lewis catalítico. El ácido fosfórico a menudo se prefiere a los haluros de aluminio. El cumeno se oxida en el aire, lo que elimina el hidrógeno bencílico terciario del cumeno y, por lo tanto, forma un radical cumeno:
El radical cumeno luego se une a una molécula de oxígeno para formar el radical peróxido de cumeno, que a su vez forma hidroperóxido de cumeno (C6H5C(CH3 )2O2H) extrayendo un hidrógeno bencílico de otra molécula de cumeno. Este último cumeno se convierte en radical cumeno y retroalimenta las formaciones de cadenas posteriores de hidroperóxidos de cumeno. Se utiliza una presión de 5 atm para asegurar que el peróxido inestable se mantenga en estado líquido.
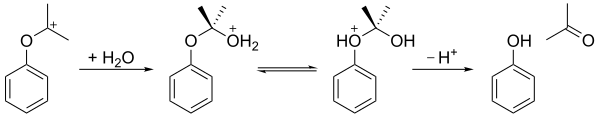
El hidroperóxido de cumeno sufre una reacción de reordenamiento en un medio ácido (el reordenamiento de Hock) para dar fenol y acetona. En el primer paso, se protona el átomo de oxígeno del hidroperoxi terminal. A esto le sigue un paso en el que el grupo fenilo migra del carbono bencilo al oxígeno adyacente y se pierde una molécula de agua, produciendo un carbocatión terciario estabilizado por resonancia. El mecanismo concertado de este paso es similar a los mecanismos de oxidación de Baeyer-Villiger y reacciones de reordenamiento de Criegee, y también al paso de oxidación del proceso de hidroboración-oxidación. En 2009, se demostró que una arcilla de bentonita acidificada era un catalizador más económico que el ácido sulfúrico como medio ácido.
El carbocatión resultante luego es atacado por el agua, formando una estructura similar a un hemiacetal. Después de la transferencia de un protón del oxígeno hidroxi al oxígeno del éter, el ion se descompone en fenol y acetona.
Reacciones y modificaciones relacionadas
Alternativas a la coproducción de acetona
El ciclohexilbenceno puede reemplazar al isopropilbenceno. A través del reordenamiento de Hock, el hidroperóxido de ciclohexilbenceno se escinde para dar fenol y ciclohexanona. La ciclohexanona es un importante precursor de algunas medias de nailon.
A partir de la alquilación del benceno con una mezcla de 1 y 2-butenos, el proceso de cumeno produce fenol y butanonas.
Alternativas a la producción de fenol
- La hidroquinona está preparada por dialkylation de benzene con propene para dar 1,4-diisopropylbenzene. Este compuesto reacciona con aire para permitir la bis (hidroperoxido). Analógico al comportamiento de hidróxido de cumene, se reorganiza en ácido para dar acetona e hidroquinona. La oxidación de la hidroquinona da 1,4-benzoquinona:
- C6H4O2 + 2 OCMe2 + H2O}}}" xmlns="http://www.w3.org/1998/Math/MathML">C6H4()CHMe2)2+212O2restablecimiento restablecimiento C6H4O2+2OCMe2+H2O{displaystyle {ce {C6H4(CHMe2)2 + 2 1/2 O2 - titulada C6H4O2 + 2 OCMe2 + H2O}}
C6H4O2 + 2 OCMe2 + H2O}}}" aria-hidden="true" class="mwe-math-fallback-image-inline" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/918ef74cbe89b0c160f1ab7f70e4f3925258213d" style="vertical-align: -1.171ex; width:57.97ex; height:3.509ex;"/>
- C6H4O2 + 2 OCMe2 + H2O}}}" xmlns="http://www.w3.org/1998/Math/MathML">C6H4()CHMe2)2+212O2restablecimiento restablecimiento C6H4O2+2OCMe2+H2O{displaystyle {ce {C6H4(CHMe2)2 + 2 1/2 O2 - titulada C6H4O2 + 2 OCMe2 + H2O}}
- El resorcinol se prepara analógicamente convirtiendo 1,3-Diisopropilbenzene en la bis (hidroperoxido), que fragmenta al resorcinol y acetona.
- 2-Nefthol también puede ser producido por un método análogo al proceso del cumene.
- 3-Clorophenol, que no surge por la cloración de fenol, puede ser producido por el proceso de Cumene comenzando con la alquilación de clorobenceno con propileno.
- Los cresoles se producen a partir de isopropiltolueno.
Procesamiento de acetona
La acetona cruda se hidrogena en fase líquida sobre níquel Raney o una mezcla de cobre y óxido de cromo para dar alcohol isopropílico. Este proceso es útil cuando va acompañado de un exceso de producción de acetona. Mitsui &erio; Co. desarrolló pasos adicionales para hidrogenar acetona y deshidrogenar el producto de isopropanol a propeno, que se recicla como reactivo de partida.
Subproductos
Los subproductos del proceso de cumeno para producir fenol y acetona son acetofenona y alfa-metilestireno.
Contenido relacionado
Robert Banks (químico)
Cu
Benjamín Silliman