Presión de vapor
Presión de vapor (o presión de vapor en países de habla inglesa que no sean EE. UU.; consulte las diferencias ortográficas) o presión de vapor de equilibrio se define como la presión ejercida por un vapor en equilibrio termodinámico con sus fases condensadas (sólidas o líquidas) a una temperatura dada en un sistema cerrado. La presión de vapor de equilibrio es una indicación de la tasa de evaporación de un líquido. Se relaciona con la tendencia de las partículas a escapar del líquido (o de un sólido). Una sustancia con una presión de vapor alta a temperaturas normales se suele denominar volátil. La presión que exhibe el vapor presente sobre la superficie de un líquido se conoce como presión de vapor. A medida que aumenta la temperatura de un líquido, también aumenta la energía cinética de sus moléculas. A medida que aumenta la energía cinética de las moléculas, también aumenta el número de moléculas que se convierten en vapor, lo que aumenta la presión de vapor.
La presión de vapor de cualquier sustancia aumenta de forma no lineal con la temperatura según la relación de Clausius-Clapeyron. El punto de ebullición a presión atmosférica de un líquido (también conocido como punto de ebullición normal) es la temperatura a la que la presión de vapor es igual a la presión atmosférica ambiental. Con cualquier aumento incremental de esa temperatura, la presión de vapor se vuelve suficiente para superar la presión atmosférica y elevar el líquido para formar burbujas de vapor dentro de la mayor parte de la sustancia. La formación de burbujas más profundas en el líquido requiere una temperatura más alta debido a la mayor presión del fluido, porque la presión del fluido aumenta por encima de la presión atmosférica a medida que aumenta la profundidad. Más importante a poca profundidad es la temperatura más alta requerida para comenzar la formación de burbujas. La tensión superficial de la pared de la burbuja conduce a una sobrepresión en las burbujas iniciales muy pequeñas.
La presión de vapor que un solo componente en una mezcla contribuye a la presión total en el sistema se llama presión parcial. Por ejemplo, el aire a nivel del mar, y saturado con vapor de agua a 20 °C, tiene presiones parciales de alrededor de 2,3 kPa de agua, 78 kPa de nitrógeno, 21 kPa de oxígeno y 0,9 kPa de argón, totalizando 102,2 kPa, lo que constituye la base para presión atmosférica estándar.
Medidas y unidades
La presión de vapor se mide en las unidades estándar de presión. El Sistema Internacional de Unidades (SI) reconoce la presión como una unidad derivada con la dimensión de fuerza por área y designa el pascal (Pa) como su unidad estándar. Un pascal es un newton por metro cuadrado (N·m−2 o kg·m−1·s−2).
La medición experimental de la presión de vapor es un procedimiento simple para presiones comunes entre 1 y 200 kPa. Los resultados más precisos se obtienen cerca del punto de ebullición de las sustancias y se producen grandes errores para mediciones inferiores a 1kPa . Los procedimientos a menudo consisten en purificar la sustancia de prueba, aislarla en un recipiente, evacuar cualquier gas extraño y luego medir la presión de equilibrio de la fase gaseosa de la sustancia en el recipiente a diferentes temperaturas. Se logra una mayor precisión cuando se tiene cuidado de garantizar que toda la sustancia y su vapor estén a la temperatura prescrita. Esto se hace a menudo, como con el uso de un isoteniscopio, sumergiendo el área de contención en un baño líquido.
Las presiones de vapor muy bajas de los sólidos se pueden medir mediante el método de celda de efusión de Knudsen.
En un contexto médico, la presión de vapor a veces se expresa en otras unidades, específicamente milímetros de mercurio (mmHg). Esto es importante para los anestésicos volátiles, la mayoría de los cuales son líquidos a temperatura corporal, pero con una presión de vapor relativamente alta.
Estimación de presiones de vapor con la ecuación de Antoine
La ecuación de Antoine es una expresión matemática pragmática de la relación entre la presión de vapor y la temperatura de sustancias líquidas o sólidas puras. Se obtiene por ajuste de curvas y se adapta al hecho de que la presión de vapor suele ser creciente y cóncava en función de la temperatura. La forma básica de la ecuación es:
y se puede transformar en esta forma explícita de temperatura:
donde:
- P{displaystyle P} es la presión absoluta de vapor de una sustancia
- T{displaystyle T} es la temperatura de la sustancia
- A{displaystyle A}, B{displaystyle B} y C{displaystyle C} son coeficientes específicos de sustancias (es decir, constantes o parámetros)
- log{displaystyle log } típicamente log10{displaystyle log _{10} o loge{displaystyle log _{e}
A veces se usa una forma más simple de la ecuación con solo dos coeficientes:
que se puede transformar en:
Las sublimaciones y vaporizaciones de la misma sustancia tienen conjuntos separados de coeficientes de Antoine, al igual que los componentes de las mezclas. Cada conjunto de parámetros para un compuesto específico solo se aplica en un rango de temperatura específico. En general, los rangos de temperatura se eligen para mantener la precisión de la ecuación de unos pocos hasta 8-10 por ciento. Para muchas sustancias volátiles, varios conjuntos diferentes de parámetros están disponibles y se utilizan para diferentes rangos de temperatura. La ecuación de Antoine tiene poca precisión con cualquier conjunto de parámetros individuales cuando se usa desde el punto de fusión de un compuesto hasta su temperatura crítica. La precisión también suele ser pobre cuando la presión de vapor es inferior a 10 Torr debido a las limitaciones del aparato utilizado para establecer los valores de los parámetros de Antoine.
La ecuación de Wagner da "uno de los mejores" se ajusta a los datos experimentales pero es bastante complejo. Expresa la presión de vapor reducida en función de la temperatura reducida.
Relación con el punto de ebullición de los líquidos
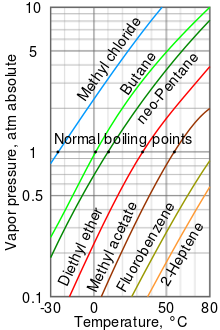
Como tendencia general, las presiones de vapor de los líquidos a temperatura ambiente aumentan con la disminución de los puntos de ebullición. Esto se ilustra en el gráfico de presión de vapor (ver a la derecha) que muestra gráficos de las presiones de vapor versus temperaturas para una variedad de líquidos. En el punto de ebullición normal de un líquido, la presión de vapor es igual a la presión atmosférica estándar definida como 1 atmósfera, 760 Torr, 101,325 kPa, o 14,69595 psi.
Por ejemplo, a cualquier temperatura dada, el cloruro de metilo tiene la presión de vapor más alta de todos los líquidos de la tabla. También tiene el punto de ebullición normal más bajo a −24,2 °C (−11,6 °F), que es donde la curva de presión de vapor del cloruro de metilo (la línea azul) se cruza con la línea de presión horizontal de una atmósfera (atm) de presión de vapor absoluta.
Aunque la relación entre la presión de vapor y la temperatura no es lineal, el gráfico usa un eje vertical logarítmico para producir líneas ligeramente curvas, por lo que un gráfico puede representar muchos líquidos. Se obtiene una línea casi recta cuando el logaritmo de la presión de vapor se grafica contra 1/(T + 230) donde T es la temperatura en grados Celsius. La presión de vapor de un líquido en su punto de ebullición es igual a la presión de su entorno circundante.
Mezclas líquidas: Ley de Raoult
La ley de Raoult da una aproximación a la presión de vapor de mezclas de líquidos. Establece que la actividad (presión o fugacidad) de una mezcla monofásica es igual a la suma ponderada por fracción molar de los componentes' presiones de vapor:
- Ptot=.. iPSí.i=.. iPisatxi{displaystyle P_{rm {tot}=sum ¿Qué? ¿Por qué? {sat}x_{i},}
Donde Ptot{displaystyle P_{rm {tot} es la presión de vapor de la mezcla, xi{displaystyle x_{i}} es la fracción mole del componente i{displaystyle i} en la fase líquida y Sí.i{displaystyle Y... es la fracción mole del componente i{displaystyle i} en la fase de vapor respectivamente. Pisat{displaystyle P_{i}{rm {}} es la presión de vapor del componente i{displaystyle i}. La ley de Raoult es aplicable sólo a los no electrólitos (especies no cargadas); es más apropiado para las moléculas no poliares con sólo atracciones intermoleculares débiles (como fuerzas de Londres).
Se dice que los sistemas que tienen presiones de vapor superiores a las indicadas por la fórmula anterior tienen desviaciones positivas. Tal desviación sugiere una atracción intermolecular más débil que en los componentes puros, por lo que se puede pensar que las moléculas están "retenidas" la fase líquida menos fuertemente que en el líquido puro. Un ejemplo es el azeótropo de aproximadamente 95% de etanol y agua. Debido a que la presión de vapor del azeótropo es más alta que la predicha por la ley de Raoult, hierve a una temperatura inferior a la de cualquiera de los componentes puros.
También hay sistemas con desviaciones negativas que tienen presiones de vapor inferiores a las esperadas. Tal desviación es evidencia de una atracción intermolecular más fuerte entre los constituyentes de la mezcla que la que existe en los componentes puros. Por lo tanto, las moléculas se "retienen" el líquido con más fuerza cuando hay una segunda molécula presente. Un ejemplo es una mezcla de triclorometano (cloroformo) y 2-propanona (acetona), que hierve por encima del punto de ebullición de cualquiera de los componentes puros.
Las desviaciones negativas y positivas se pueden utilizar para determinar los coeficientes de actividad termodinámica de los componentes de las mezclas.
Sólidos
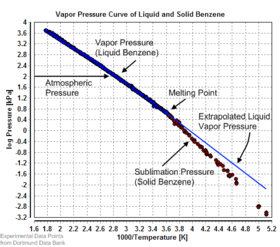
La presión de vapor de equilibrio se puede definir como la presión que se alcanza cuando una fase condensada está en equilibrio con su propio vapor. En el caso de un sólido en equilibrio, como un cristal, esto se puede definir como la presión cuando la tasa de sublimación de un sólido coincide con la tasa de deposición de su fase de vapor. Para la mayoría de los sólidos, esta presión es muy baja, pero algunas excepciones notables son la naftalina, el hielo seco (la presión de vapor del hielo seco es de 5,73 MPa (831 psi, 56,5 atm) a 20 °C, lo que hace que la mayoría de los recipientes sellados se rompan) y hielo. Todos los materiales sólidos tienen una presión de vapor. Sin embargo, debido a sus valores extremadamente bajos, la medición puede ser bastante difícil. Las técnicas típicas incluyen el uso de termogravimetría y transpiración de gases.
Existen varios métodos para calcular la presión de sublimación (es decir, la presión de vapor) de un sólido. Un método consiste en estimar la presión de sublimación a partir de las presiones de vapor del líquido extrapoladas (del líquido sobreenfriado), si se conoce el calor de fusión, utilizando esta forma particular de la relación Clausius-Clapeyron:
- InPssub=InPlsub− − Δ Δ fusHR()1Tsub− − 1Tfus){displaystyle ln ,P_{rm {}{rm {}=ln} {fnMicroc} {Delta _{rm {fus}H} {R}left({frac} {1} {fn} {fnMicroc} {1}{T_{rm {}}}right)}
donde:
- Pssub{displaystyle ¿Qué? {sub}} es la presión de sublimación del componente sólido a la temperatura <math alttext="{displaystyle T_{rm {sub}}Tsub.Tfus{displaystyle ¿Qué?<img alt="{displaystyle T_{rm {sub}}.
- Plsub{displaystyle ¿Qué? {sub}} es la presión de vapor extrapolada del componente líquido a la temperatura <math alttext="{displaystyle T_{rm {sub}}Tsub.Tfus{displaystyle ¿Qué?<img alt="{displaystyle T_{rm {sub}}.
- Δ Δ fusH{displaystyle Delta... es el calor de la fusión.
- R{displaystyle R. es la constante de gas.
- Tsub{displaystyle T_{rm {sub}} es la temperatura de sublimación.
- Tfus{displaystyle T_{rm {fus}} es la temperatura de punto de fusión.
Este método supone que el calor de fusión es independiente de la temperatura, ignora las temperaturas de transición adicionales entre diferentes fases sólidas y proporciona una estimación justa de las temperaturas no muy alejadas del punto de fusión. También muestra que la presión de sublimación es menor que la presión de vapor líquido extrapolada (ΔfusH > 0) y la diferencia crece con el aumento de la distancia desde el punto de fusión.
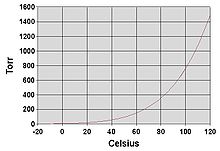
Punto de ebullición del agua
Como todos los líquidos, el agua hierve cuando su presión de vapor alcanza la presión que la rodea. En la naturaleza, la presión atmosférica es más baja a mayor altura y el agua hierve a una temperatura más baja. La temperatura de ebullición del agua para presiones atmosféricas se puede aproximar mediante la ecuación de Antoine:
- log10 ()P1Tor)=8.07131− − 1730.63∘ ∘ C233.426∘ ∘ C+Tb{displaystyle log _{10}left({frac {P}{1{text{ ¿Qué? {fnh} {fnK}} {fnK}}}} {fn}}}} {fn}}}}}} {fn}}}}}}}} {fn}}}}}} {fn}}}} {f}}} {f}}}}} {f}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}} {\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\
o transformado en esta forma explícita de temperatura:
- Tb=1730.63∘ ∘ C8.07131− − log10 ()P1Tor)− − 233.426∘ ∘ C{displaystyle T_{b}={frac {1730.63 {}{circ }{text{C}}{8.07131-log _{10}left({frac {frac{1{text{ Torr}}}right)}-233.426 {fnK} {fnMicrosoft}} {fnMicrosoft}} {fnK}}} {fnK}} {fnK}}}}} {fnK}}} {fnK}}}}} {f}}} {f}} {f}}}}}}}} {f}}}}}} {f}}}}}}}} {f}}}}}}}}}}}}}}}}}}} {f}}}}}}}} {f}}}} {f}}}}} {f}}}}}}} {f} {f}}}}}}}}}}f}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}
donde la temperatura Tb{displaystyle T_{b} es el punto de ebullición en grados Celsius y la presión P{displaystyle P} está en Torr.
Regla de Dühring
La regla de Dühring establece que existe una relación lineal entre las temperaturas a las que dos soluciones ejercen la misma presión de vapor.
Ejemplos
La siguiente tabla es una lista de una variedad de sustancias ordenadas por presión de vapor creciente (en unidades absolutas).
| Sustancia | Presión de vapor | Temperatura (°C) | ||
|---|---|---|---|---|
| (Pa) | (bar) | (mmHg) | ||
| Octaethylene glycol | 9.2×10−8 Pa | 9.2×10−13 | 6.9×10−10 | 89.85 |
| Glycerol | 0.4 Pa | 0,000004 | 0,003 | 50 |
| Mercurio | 1 Pa | 0,00001 | 0,0075 | 41.85 |
| Tungsten | 1 Pa | 0,00001 | 0,0075 | 3203 |
| Xenon difluoride | 600 Pa | 0,006 | 4.50 | 25 |
| Agua (H2O) | 2.3 kPa | 0,023 | 17,5 | 20 |
| Propanol | 2.4 kPa | 0,024 | 18.0 | 20 |
| Methyl isobutyl ketone | 2.66 kPa | 0,0266 | 19.95 | 25 |
| Ethanol | 5.83 kPa | 0,0583 | 43,7 | 20 |
| Freon 113 | 37,9 kPa | 0.379 | 284 | 20 |
| Acetaldehyde | 98.7 kPa | 0.987 | 740 | 20 |
| Butane | 220 kPa | 2.2 | 1650 | 20 |
| Formaldehyde | 435,7 kPa | 4.357 | 3268 | 20 |
| Propane | 997,8 kPa | 9.978 | 7584 | 26.85 |
| Carbonyl sulfide | 1.255 MPa | 12.55 | 9412 | 25 |
| Óxido nitroso | 5.660 MPa | 56.60 | 42453 | 25 |
| Dióxido de carbono | 5.7 MPa | 57 | 42753 | 20 |
Estimación de la presión de vapor a partir de la estructura molecular
Existen varios métodos empíricos para estimar la presión de vapor a partir de la estructura molecular de las moléculas orgánicas. Algunos ejemplos son el método SIMPOL.1, el método de Moller et al. y EVAPORACIÓN (Estimación de la presión de vapor de los orgánicos, contabilización de los efectos de temperatura, intramoleculares y no aditivos).
Significado en meteorología
En meteorología, el término presión de vapor significa la presión parcial del vapor de agua en la atmósfera, aunque no esté en equilibrio. Esto difiere de su significado en otras ciencias. Según el Glosario de Meteorología de la Sociedad Meteorológica Estadounidense, la presión de vapor de saturación se refiere propiamente a la presión de vapor de equilibrio del agua sobre una superficie plana de agua líquida o hielo sólido, y es una función únicamente de la temperatura y de si la fase condensada es líquida o sólida. La humedad relativa se define en relación con la presión de vapor de saturación. La presión de vapor de equilibrio no requiere que la fase condensada sea una superficie plana; podría consistir en pequeñas gotas que posiblemente contengan solutos (impurezas), como una nube. La presión de vapor de equilibrio puede diferir significativamente de la presión de vapor de saturación según el tamaño de las gotas y la presencia de otras partículas que actúan como núcleos de condensación de nubes.
Sin embargo, estos términos se usan de manera inconsistente, y algunos autores usan "presión de vapor de saturación" fuera del significado restringido dado por el Glosario de AMS. Por ejemplo, un texto sobre la convección atmosférica dice: "El efecto Kelvin hace que la presión de vapor de saturación sobre la superficie curva de la gota sea mayor que sobre una superficie de agua plana" (énfasis añadido).
El término aún actual presión de vapor de saturación se deriva de la teoría obsoleta de que el vapor de agua se disuelve en el aire, y que el aire a una temperatura dada solo puede contener una cierta cantidad de agua antes de convertirse en "saturado". En realidad, como establece la ley de Dalton (conocida desde 1802), la presión parcial del vapor de agua o cualquier sustancia no depende en absoluto del aire, y la temperatura relevante es la del líquido. Sin embargo, la creencia errónea persiste entre el público e incluso entre los meteorólogos, ayudada por los términos engañosos presión de saturación y supersaturación y la definición relacionada de humedad relativa.
Contenido relacionado
El poder de la fusion
Ascensor (fuerza)
Número imaginario