Precipitación (química)
En una solución acuosa, la precipitación es el proceso de transformación de una sustancia disuelta en un sólido insoluble a partir de una solución sobresaturada. El sólido formado se llama precipitado. En el caso de una reacción química inorgánica que conduce a la precipitación, el reactivo químico que causa la formación del sólido se denomina precipitante.
El líquido transparente que queda por encima de la fase sólida precipitada o centrifugada también se denomina sobrenadante o sobrenadante.
La noción de precipitación también puede extenderse a otros dominios de la química (química orgánica y bioquímica) e incluso aplicarse a las fases sólidas (p. ej., metalurgia y aleaciones) cuando las impurezas sólidas se segregan de una fase sólida.
Supersaturación
La precipitación de un compuesto puede ocurrir cuando su concentración excede su solubilidad. Esto puede deberse a cambios de temperatura, evaporación de solventes o mezcla de solventes. La precipitación ocurre más rápidamente a partir de una solución fuertemente sobresaturada.
La formación de un precipitado puede ser causada por una reacción química. Cuando una solución de cloruro de bario reacciona con ácido sulfúrico, se forma un precipitado blanco de sulfato de bario. Cuando una solución de yoduro de potasio reacciona con una solución de nitrato de plomo (II), se forma un precipitado amarillo de yoduro de plomo (II).
Nucleación
Una etapa importante del proceso de precipitación es el inicio de la nucleación. La creación de una partícula sólida implica la formación de una interfaz con la solución. Esto implica cambios de energía en función de la energía libre de la reacción de disolución (proceso endotérmico o exotérmico acompañado de un aumento de entropía) y la energía superficial relativa desarrollada entre el sólido y la solución. Si los cambios de energía no son favorables, o sin sitios de nucleación adecuados, no se produce precipitación y la solución permanece sobresaturada.
Química inorgánica
Precipitación en solución acuosa
Un ejemplo común de reacción de precipitación en solución acuosa es el del cloruro de plata. Cuando se agrega nitrato de plata (AgNO3) a una solución de cloruro de potasio (KCl) se observa la precipitación de un sólido blanco (AgCl).
- AgCl (v) + KNO3}}}" xmlns="http://www.w3.org/1998/Math/MathML">AgNO3+KClrestablecimiento restablecimiento AgCl↓ ↓ +KNO3{displaystyle {ce {AgNO3 + KCl - Confía AgCl (v) + KNO3}}
AgCl (v) + KNO3}}}" aria-hidden="true" class="mwe-math-fallback-image-inline" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/af35b0119997fef60bafa47b3e276136e6b0d8a7" style="vertical-align: -1.005ex; width:35.227ex; height:2.843ex;"/>
La ecuación iónica permite escribir esta reacción detallando los iones disociados presentes en solución acuosa.
- AgCl (v) + K+ + NO3^-}}}" xmlns="http://www.w3.org/1998/Math/MathML">Ag++NO3− − +K++Cl− − restablecimiento restablecimiento AgCl↓ ↓ +K++NO3− − {displaystyle {ce {fnAg+ + NO3^- + K+ + Cl^- AgCl (v) + K+ + NO3^-}}
AgCl (v) + K+ + NO3^-}}}" aria-hidden="true" class="mwe-math-fallback-image-inline" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/39c0d48de537d5c187a9ebaaf7567df895721aa6" style="vertical-align: -1.005ex; width:50.705ex; height:3.176ex;"/>
Precipitación reductora
El reductor de Walden es una ilustración de una reacción de reducción acompañada directamente por la precipitación de un compuesto menos soluble debido a su menor valencia química:
- Cu^2+ + 2 Ag}}}" xmlns="http://www.w3.org/1998/Math/MathML">Cu+2Ag+restablecimiento restablecimiento Cu2++2Ag{displaystyle {ce {Cu + 2 Ag+ - titulada Cu^2+ + 2 Ag}}
Cu^2+ + 2 Ag}}}" aria-hidden="true" class="mwe-math-fallback-image-inline" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/9741a27a0745d2480cba1a575221f4a97c2672dd" style="vertical-align: -0.671ex; width:29.472ex; height:3.009ex;"/>
El reductor de Walden hecho de diminutos cristales de plata obtenidos por la inmersión de un alambre de cobre en una solución de nitrato de plata se usa para reducir a su valencia más baja cualquier ion metálico ubicado sobre la pareja de plata (Ag+ + 1 e– → Ag) en la escala de potencial redox.
Colores precipitados
Muchos compuestos que contienen iones metálicos producen precipitados con colores distintivos. Los siguientes son algunos colores típicos para varios metales. Sin embargo, muchos de estos compuestos pueden producir colores muy diferentes a los enumerados.
| Metal | Color |
|---|---|
| Cromo | Azul, verde profundo, verde oscuro, naranja, amarillo, marrón |
| Cobalto | Rosa (cuando se hidrata) |
| Copper | Azul |
| Hierro (II) | Dirty Green |
| Irón (III) | Marrón rojo |
| Manganese | Pale rosa (Mn2+) |
| Nickel | Verde |
Muchos compuestos suelen formar precipitados blancos.
Análisis cualitativo de aniones/cationes
La formación de precipitados es útil en la detección del tipo de catión en una sal. Para hacer esto, primero un álcali reacciona con la sal desconocida para producir un precipitado que es el hidróxido de la sal desconocida. Para identificar el catión se anota el color del precipitado y su solubilidad en exceso. A menudo se utilizan procesos similares en secuencia; por ejemplo, una solución de nitrato de bario reaccionará con iones de sulfato para formar un precipitado de sulfato de bario sólido, lo que indica que es probable que haya iones de sulfato presentes.
Suspensiones coloidales
Sin suficientes fuerzas de atracción (p. ej., fuerza de Van der Waals) para agregar las partículas sólidas y eliminarlas de la solución por gravedad (sedimentación), permanecen en suspensión y forman coloides. La sedimentación se puede acelerar mediante centrifugación a alta velocidad. La masa compacta así obtenida se denomina a veces 'pellet'.
Digestión y crianza de precipitados
La digestión, o envejecimiento del precipitado, ocurre cuando se deja un precipitado recién formado, generalmente a una temperatura más alta, en la solución de la que precipita. Da como resultado partículas recristalizadas más puras y más grandes. El proceso físico-químico que subyace a la digestión se denomina maduración de Ostwald.
Química orgánica
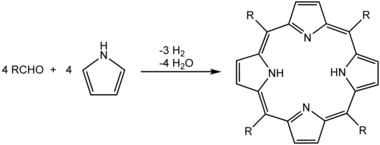
Si bien las reacciones de precipitación se pueden usar para fabricar pigmentos, eliminar iones de la solución en el tratamiento del agua y en el análisis inorgánico cualitativo clásico, la precipitación también se usa comúnmente para aislar los productos de una reacción orgánica durante las operaciones de procesamiento y purificación. Idealmente, el producto de la reacción es insoluble en el solvente usado para la reacción. Así, precipita a medida que se va formando, preferentemente formando cristales puros. Un ejemplo de esto sería la síntesis de porfirinas en ácido propiónico a reflujo. Al enfriar la mezcla de reacción a temperatura ambiente, los cristales de la porfirina precipitan y se recolectan por filtración en un filtro Büchner como se ilustra en la fotografía a continuación:
La precipitación también puede ocurrir cuando se agrega un antisolvente (un solvente en el cual el producto es insoluble), reduciendo drásticamente la solubilidad del producto deseado. Posteriormente, el precipitado se puede separar fácilmente por decantación, filtración o centrifugación. Un ejemplo sería la síntesis de cloruro de Cr3+tetrafenilporfirina: a la solución de dimetilformamida (DMF) en la que se produjo la reacción se le añade agua y el producto precipita. La precipitación es útil para purificar muchos otros productos: p. ej., el bmim-Cl crudo se absorbe en acetonitrilo y se vierte en acetato de etilo, donde precipita.
Bioquímica
La purificación y separación de proteínas se puede realizar por precipitación cambiando la naturaleza del solvente o el valor de su constante dieléctrica (por ejemplo, reemplazando el agua por etanol), o aumentando la fuerza iónica de la solución. Como las proteínas tienen estructuras terciarias y cuaternarias complejas debido a su plegamiento específico y varias interacciones intermoleculares débiles (por ejemplo,, puentes de hidrógeno), estas superestructuras pueden modificarse y las proteínas pueden desnaturalizarse y precipitarse. Otra aplicación importante de un antidisolvente es la precipitación de ADN con etanol.
Metalurgia y aleaciones
En las fases sólidas, la precipitación ocurre si la concentración de un sólido está por encima del límite de solubilidad en el sólido huésped, debido, p. enfriamiento rápido o implantación de iones, y la temperatura es lo suficientemente alta como para que la difusión pueda conducir a la segregación en precipitados. La precipitación en sólidos se usa rutinariamente para sintetizar nanoclusters.
En metalurgia, la precipitación de una solución sólida también es una forma de fortalecer las aleaciones.
La precipitación de fases cerámicas en aleaciones metálicas, como los hidruros de circonio en el revestimiento de zircaloy de las clavijas de combustible nuclear, también puede hacer que las aleaciones metálicas se vuelvan quebradizas y provocar fallas mecánicas. Dominar correctamente las condiciones precisas de temperatura y presión cuando se enfrían los combustibles nucleares gastados es, por lo tanto, esencial para evitar dañar su revestimiento y preservar la integridad de los elementos del combustible gastado a largo plazo en cofres de almacenamiento en seco y en condiciones de eliminación geológica.
Procesos industriales
La precipitación con hidróxido es probablemente el proceso de precipitación industrial más utilizado en el que se forman hidróxidos metálicos añadiendo hidróxido de calcio (cal apagada) o hidróxido de sodio (cáustico soda) como precipitante.
Historia
Los polvos derivados de diferentes procesos de precipitación también se conocen históricamente como 'flores'.
Contenido relacionado
Martín Kamén
Hemo
Unión metálica