Porfirina
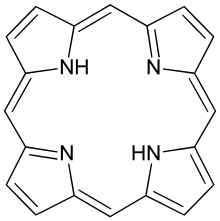
Las porfirinas (POR-fər-in) son un grupo de compuestos orgánicos macrocíclicos heterocíclicos, compuestos por cuatro subunidades de pirrol modificadas interconectadas en sus átomos de carbono α a través de puentes de metino (=CH−). En los vertebrados, un miembro esencial del grupo de las porfirinas es el hemo, que es un componente de las hemoproteínas, cuyas funciones incluyen el transporte de oxígeno en el torrente sanguíneo. En las plantas, un derivado de porfirina esencial es la clorofila, que participa en la captación de luz y la transferencia de electrones en la fotosíntesis.
El padre de las porfirinas es la porfina, un raro compuesto químico de interés exclusivamente teórico. Las porfinas sustituidas se denominan porfirinas. Con un total de 26 electrones π, de los cuales 18 electrones π forman un ciclo continuo plano, la estructura del anillo de porfirina a menudo se describe como aromática. Un resultado del gran sistema conjugado es que las porfirinas suelen absorber fuertemente en la región visible del espectro electromagnético, es decir, tienen un color intenso. El nombre "porfirina" deriva de la palabra griega πορφύρα (porphyra), que significa púrpura.
Estructura
Los complejos de porfirina consisten en un núcleo plano cuadrado de MN4. La periferia de las porfirinas, que consta de carbonos con hibridación sp2, generalmente muestra pequeñas desviaciones de la planaridad. "Con volantes" o porfirinas en forma de silla de montar se atribuye a las interacciones del sistema con su entorno. Además, el metal a menudo no está centrado en el plano N4. Para las porfirinas libres, los dos protones de pirrol son mutuamente trans y se proyectan fuera del plano N4. Estas distorsiones no planas están asociadas con propiedades químicas y físicas alteradas. Los anillos de clorofila son claramente no planos, pero están más saturados que las porfirinas.
Complejos de porfirinas
Concomitantemente con el desplazamiento de dos protones N-H, las porfirinas unen iones metálicos en el "bolsillo" N4. El ion metálico generalmente tiene una carga de 2+ o 3+. Se muestra una ecuación esquemática para estas síntesis:
- H2porfirina + [MLn]2+ → M(porfirinate) Ln4− + 4 L + 2 H+, donde M = iones metálicos y L = un ligand
La inserción del centro metálico es lenta en ausencia de catalizadores. En la naturaleza, estos catalizadores (enzimas) se denominan quelatasas. Cuando no hay ningún ion metálico (o átomo) unido a los nitrógenos en el centro, los compuestos se denominan porfina libre o porfirina libre. Si están unidos a un metal en el centro, entonces están unidos. Una porfirina con un átomo de hierro del tipo que se encuentra en la mioglobina, la hemoglobina o ciertos citocromos se denomina hemo. Los complejos metálicos derivados de las porfirinas, a menudo llamados metaloporfirinas, se producen de forma natural. Una de las familias más conocidas de complejos de porfirina es el hemo, el pigmento de los glóbulos rojos, un cofactor de la proteína hemoglobina. Porphin es la porfirina más simple, un compuesto raro de interés teórico.
- Representantes porfirinas y derivados
Porfirinas antiguas
Una geoporfirina, también conocida como petroporfirina, es una porfirina de origen geológico. Pueden ocurrir en petróleo crudo, esquisto bituminoso, carbón o rocas sedimentarias. La abelsonita es posiblemente el único mineral de geoporfirina, ya que es raro que las porfirinas se presenten aisladas y formen cristales.
El campo de la geoquímica orgánica tuvo su origen en el aislamiento de porfirinas del petróleo. Este hallazgo ayudó a establecer los orígenes biológicos del petróleo. El petróleo a veces es "huella digital" por análisis de trazas de porfirinas de níquel y vanadilo.
Biosíntesis
En eucariotas no fotosintéticos como animales, insectos, hongos y protozoos, así como en el grupo de bacterias α-proteobacteria, el paso comprometido para la biosíntesis de porfirina es la formación de ácido δ-aminolevulínico (δ-ALA, 5 -ALA o dALA) por la reacción del aminoácido glicina con succinil-CoA del ciclo del ácido cítrico. En plantas, algas, bacterias (excepto el grupo de las α-proteobacterias) y arqueas, se produce a partir del ácido glutámico mediante glutamil-tRNA y glutamato-1-semialdehído. Las enzimas involucradas en esta vía son glutamil-tRNA sintetasa, glutamil-tRNA reductasa y glutamato-1-semialdehído 2,1-aminomutasa. Esta vía se conoce como la vía C5 o Beale.
Luego, la porfobilinógeno sintasa combina dos moléculas de dALA para dar porfobilinógeno (PBG), que contiene un anillo de pirrol. A continuación, se combinan cuatro PBG mediante desaminación en hidroximetil bilano (HMB), que se hidroliza para formar tetrapirrol uroporfirinógeno III circular. Esta molécula sufre una serie de modificaciones adicionales. Los intermediarios se usan en diferentes especies para formar sustancias particulares, pero, en humanos, el principal producto final, la protoporfirina IX, se combina con hierro para formar hemo. Los pigmentos biliares son los productos de degradación del hemo.
El siguiente esquema resume la biosíntesis de porfirinas, con referencias por número EC y la base de datos OMIM. También se muestra la porfiria asociada a la deficiencia de cada enzima:
| Enzyme | Ubicación | Substrate | Producto | Cromosoma | CE | OMIM | Trastorno |
|---|---|---|---|---|---|---|---|
| ALA synthase | Mitocondrion | Glycine, succinyl CoA | δ-Aminolevulinic acid | 3p21.1 | 2.3.1.37 | 125290 | Protoporfiria dominante ligada a X, Anemia lateral parlante X |
| ALA deshidratación | Citosol | δ-Aminolevulinic acid | Porphobilinogen | 9q34 | 4.2.1.24 | 125270 | aminolevulinic acid dehydratase deficiencia porphyria |
| PBG deaminase | Citosol | Porphobilinogen | Hydroxymethyl bilane | 11q23.3 | 2.5.1.61 | 176000 | aguda porfiria intermitente |
| Uroporphyrinogen III sinthase | Citosol | Hydroxymethyl bilane | Uroporphyrinogen III | 10q25.2-q26.3 | 4.2.1.75 | 606938 | porfiria eritropoyética congénita |
| Uroporphyrinogen III decarboxylase | Citosol | Uroporphyrinogen III | Coproporphyrinogen III | 1p34 | 4.1.1.37 | 176100 | porphyria cutanea tarda, hepatoerythropoietic porphyria |
| Coproporphyrinogen III oxidase | Mitocondrion | Coproporphyrinogen III | Protoporphyrinogen IX | 3q12 | 1.3.3.3 | 121300 | hereditario coproporfiria |
| Protoporfirinogen oxidase | Mitocondrion | Protoporphyrinogen IX | Protoporfirina IX | 1q22 | 1.3.3.4 | 600923 | variegate porphyria |
| Ferrochelatase | Mitocondrion | Protoporfirina IX | Heme | 18q21.3 | 4.99.1.1 | 177000 | protoporfiria eritropoyética |
Síntesis de laboratorio
Una síntesis común para las porfirinas es la reacción de Rothemund, reportada por primera vez en 1936, que también es la base para métodos más recientes descritos por Adler y Longo. El esquema general es un proceso de condensación y oxidación a partir de pirrol y un aldehído.
Aplicaciones
Terapia fotodinámica
Las porfirinas se han evaluado en el contexto de la terapia fotodinámica (PDT) ya que absorben fuertemente la luz, que luego se convierte en calor en las áreas iluminadas. Esta técnica se ha aplicado en la degeneración macular utilizando verteporfina.
La TFD se considera un tratamiento no invasivo contra el cáncer, que implica la interacción entre la luz de una determinada frecuencia, un fotosensibilizador y el oxígeno. Esta interacción produce la formación de especies de oxígeno altamente reactivas (ROS), generalmente oxígeno singulete, así como anión superóxido, radical hidroxilo libre o peróxido de hidrógeno. Estas especies de oxígeno altamente reactivas reaccionan con biomoléculas orgánicas celulares susceptibles tales como; lípidos, aminoácidos aromáticos y bases heterocíclicas de ácidos nucleicos, para producir radicales oxidativos que dañan la célula, posiblemente induciendo apoptosis o incluso necrosis.
Toxicología
La biosíntesis de hemo se utiliza como biomarcador en estudios de toxicología ambiental. Mientras que la producción excesiva de porfirinas indica exposición a organoclorados, el plomo inhibe la enzima ALA deshidratasa.
Aplicaciones biológicas
Las porfirinas se han investigado como posibles agentes antiinflamatorios y se ha evaluado su actividad anticancerígena y antioxidante. Se encontró que varios conjugados de porfirina-péptido tenían actividad antiviral contra el VIH in vitro.
Aplicaciones sintéticas
Los complejos de porfirinas de cobalto(II) se han utilizado ampliamente como catalizadores en la síntesis orgánica. Debido a sus mecanismos de radicales biomiméticos distintivos que involucran intermediarios de radicales estabilizados con metales, el sistema de catálisis basado en porfirina Co(II) aborda algunos desafíos de larga data en las transformaciones orgánicas.
Posibles aplicaciones
Catálisis biomimética
Aunque no se comercializan, los complejos de metaloporfirinas son ampliamente estudiados como catalizadores para la oxidación de compuestos orgánicos. Particularmente populares para tales investigaciones de laboratorio son los complejos de meso-tetrafenilporfirina y octaetilporfirina. Los complejos con Mn, Fe y Co catalizan una variedad de reacciones de potencial interés en síntesis orgánica. Algunos complejos emulan la acción de varias enzimas hemo como el citocromo P450, la lignina peroxidasa. Las metaloporfirinas también se estudian como catalizadores para la división del agua, con el fin de generar hidrógeno molecular y oxígeno para celdas de combustible.
Electrónica molecular y sensores
Los compuestos a base de porfirina son de interés como posibles componentes de la electrónica molecular y la fotónica. Se han incorporado tintes de porfirina sintética en prototipos de células solares sensibilizadas con tinte.
Las metaloporfirinas se han investigado como sensores.
Las ftalocianinas, que están estructuralmente relacionadas con las porfirinas, se usan en el comercio como colorantes y catalizadores, pero las porfirinas no.
Química supramolecular
Las porfirinas se utilizan a menudo para construir estructuras en química supramolecular. Estos sistemas aprovechan la acidez de Lewis del metal, típicamente zinc. Un ejemplo de un complejo huésped-huésped que se construyó a partir de un macrociclo compuesto por cuatro porfirinas. Una porfirina base libre de huéspedes está unida al centro por coordinación con sus cuatro sustituyentes de piridina.
Interés teórico en aromaticidad
Los macrociclos de porfirinoides pueden mostrar una aromaticidad variable. Una porfirina aromática de Hückel es el porficeno. Se conocen macrociclos porfirinoides antiaromáticos, aromáticos de Mobius y no aromáticos.
Galería
Especies relacionadas
En la naturaleza
En la naturaleza se encuentran varios heterociclos relacionados con las porfirinas, casi siempre unidos a iones metálicos. Éstas incluyen
| N4-macrocycle | Nombre de cofactor | metal | comentario |
|---|---|---|---|
| cloro | clorofila | magnesio | existen varias versiones de clorofila (sidechain; excepción de clorofila c) |
| bacteriocloroína | bacterioclorofila (en parte) | magnesio | existen varias versiones de bacterioclorofila (sidechain; algunas usan un anillo de cloro habitual) |
| sirohidrocloro (un isobacteriocloro) | Señor | plancha | Cofactor importante en la asimilación de azufre |
| biosintético intermedio en ruta al cofactor F430 y B12 | |||
| corrin | vitamina B12 | cobalto | existen varias variantes de B12 (sidechain) |
| corphin | Cofactor F430 | Nickel | macrociclo muy reducido |
Sintético
Una benzoporfirina es una porfirina con un anillo de benceno fusionado con una de las unidades de pirrol. p.ej. la verteporfina es un derivado de la benzoporfirina.
Isómeros de porfirina no naturales
Emanual Vogel y colaboradores informaron sobre el primer isómero sintético de porfirina en 1986. Este isómero [18]porfirina-(2.0.2.0) se denomina porficeno, y el N4 central La cavidad forma un rectángulo como se muestra en la figura. Los porficenos mostraron un comportamiento fotofísico interesante y encontraron un compuesto versátil para la terapia fotodinámica. Esto inspiró a Vogel y Sessler a aceptar el desafío de preparar [18]porfirina-(2.1.0.1) y la llamaron corrficeno o porficerina. La tercera porfirina que es [18]porfirina-(2.1.1.0), fue reportada por Callot y Vogel-Sessler. Vogel y colaboradores informaron sobre el aislamiento exitoso de [18]porfirina-(3.0.1.0) o isoporficeno. El científico japonés Furuta y el científico polaco Latos-Grażyński informaron casi simultáneamente sobre las porfirinas confundidas con N. La inversión de una de las subunidades pirrólicas en el anillo macrocíclico dio como resultado que uno de los átomos de nitrógeno quedara fuera del núcleo del macrociclo.
Contenido relacionado
Basenji
Fenotipo
Bebé