Polimerización por apertura de anillo
Una polimerización en la que un monómero cíclico produce una unidad monomérica que es acíclica o contiene menos ciclos que el monómero. Nota: Si monómero es policíclico, la apertura de un solo anillo es suficiente para clasificar la reacción como polimerización en aros.
Modificado de la definición anterior .
Penczek S.; Moad, G. Pure Appl. Chem., 2008, 80(10), 2163-2193

En química de polímeros, la polimerización por apertura de anillo (ROP) es una forma de polimerización de crecimiento en cadena, en la que el extremo de una cadena de polímero ataca a los monómeros cíclicos para formar un polímero más largo (ver figura). El centro reactivo puede ser radical, aniónico o catiónico. Algunos monómeros cíclicos, como el norborneno o el ciclooctadieno, se pueden polimerizar en polímeros de alto peso molecular mediante el uso de catalizadores metálicos. ROP es un método versátil para la síntesis de biopolímeros.
La apertura del anillo de los monómeros cíclicos a menudo es impulsada por el alivio de la tensión del ángulo de enlace. Así, como es el caso de otros tipos de polimerización, el cambio de entalpía en la apertura del anillo es negativo.
Monómeros
Los monómeros cíclicos que son susceptibles de ROP incluyen epóxidos, trisiloxanos cíclicos, algunas lactonas, lactidas, carbonatos cíclicos y N-carboxianhídridos de aminoácidos. Muchos cicloalquenos tensados, por ejemplo, el norborneno, son monómeros adecuados mediante polimerización por metátesis con apertura de anillo.
Historia
La polimerización por apertura de anillo se ha utilizado desde principios del siglo XX para producir polímeros. La síntesis de polipéptidos que tiene la historia más antigua de ROP, se remonta al trabajo de 1906 de Leuchs. Posteriormente, la ROP de azúcares anhidro proporcionó polisacáridos, incluidos dextrano sintético, goma xantana, goma welan, goma gellan, goma diutan y pululano. Los mecanismos y la termodinámica de la polimerización por apertura de anillo se establecieron en la década de 1950. Los primeros polímeros de alto peso molecular (Mn hasta 105) con una unidad repetitiva fueron preparados por ROP ya en 1976.
Una aplicación industrial es la producción de nylon-6.
Mecanismos
La polimerización por apertura de anillo puede realizarse mediante polimerización por radicales, aniónica o catiónica, como se describe a continuación. Además, la ROP radical es útil en la producción de polímeros con grupos funcionales incorporados en la cadena principal que de otro modo no se pueden sintetizar a través de la polimerización de crecimiento de cadena convencional de monómeros de vinilo. Por ejemplo, la ROP radical puede producir polímeros con éteres, ésteres, amidas y carbonatos como grupos funcionales a lo largo de la cadena principal.
Polimerización aniónica por apertura de anillo (AROP)

Las polimerizaciones aniónicas de apertura de anillo (AROP) involucran reactivos nucleofílicos como iniciadores. Los monómeros con una estructura de anillo de tres miembros, como los epóxidos, las aziridinas y los episulfuros, experimentan una ROP aniónica.
Un ejemplo típico de ROP aniónica es la de ε-caprolactona, iniciada por un alcóxido.
Polimerización catiónica por apertura de anillo
Los iniciadores e intermedios catiónicos caracterizan la polimerización por apertura de anillo catiónica (CROP). Los ejemplos de monómeros cíclicos que polimerizan a través de este mecanismo incluyen lactonas, lactamas, aminas y éteres. CROP procede a través de un proceso de crecimiento en cadena de propagación SN1 o SN2. El mecanismo se ve afectado por la estabilidad de las especies catiónicas resultantes. Por ejemplo, si el átomo que lleva la carga positiva está estabilizado por grupos donantes de electrones, la polimerización procederá mediante el mecanismo SN1. La especie catiónica es un heteroátomo y la cadena crece mediante la adición de monómeros cíclicos, abriendo así el sistema de anillos.

The monomers can be activated by Bronsted acids, carbenium ions, oxonium ions, and metal cations.
CROP puede ser una polimerización viva y puede terminarse con reactivos nucleófilos como aniones fenoxi, fosfinas o polianiones. Cuando la cantidad de monómeros se agota, la terminación puede ocurrir intra o intermolecularmente. El extremo activo puede "refutar" la cadena, formando un macrociclo. También es posible la transferencia de cadenas de alquilo, donde el extremo activo se inactiva transfiriendo una cadena de alquilo a otro polímero.
Polimerización por metátesis de apertura de anillo
La polimerización por metátesis de apertura de anillo (ROMP) produce polímeros insaturados a partir de cicloalquenos o bicicloalquenos. Requiere catalizadores organometálicos.
El mecanismo de ROMP sigue vías similares a las de la metátesis de olefinas. El proceso de iniciación implica la coordinación del monómero de cicloalqueno con el complejo de alquilideno metálico, seguido de una cicloadición de tipo [2+2] para formar el metalaciclobutano intermedio que se ciclorevierte para formar una nueva especie de alquilideno.
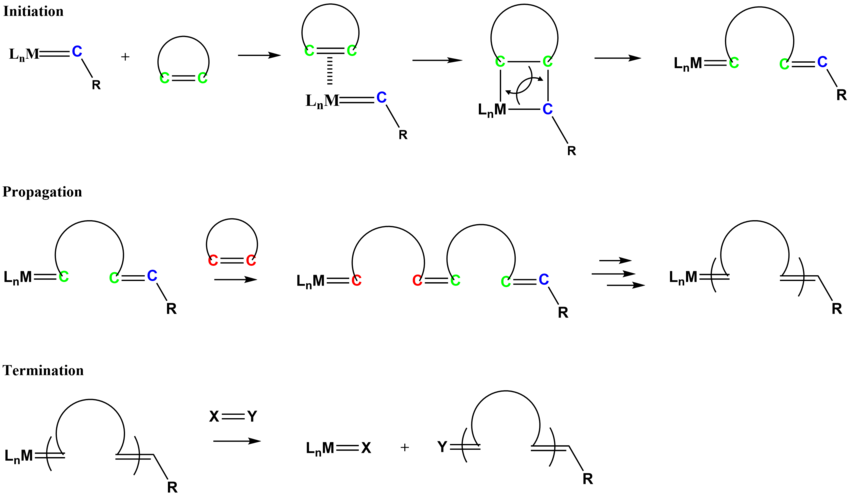
Los polímeros insaturados comercialmente relevantes sintetizados por ROMP incluyen Norsorex (polinorborneno), Vestenamer (policicloocteno) y Metton (policiclopentadieno).
Termodinámica
El criterio termodinámico formal de la polimerizabilidad de un monómero dado está relacionado con un signo de la entalpía libre (energía libre de Gibbs) de polimerización:
- Δ Δ Gp()xSí.)=Δ Δ Hp()xSí.)− − TΔ Δ Sp()xSí.){displaystyle Delta G_{p}(xy)=Delta H_{p}(xy)-TDelta S_{p}(xy)}
donde x e y indican estados de monómero y polímero, respectivamente (x y/o y = l (líquido), g (gaseoso), c (sólido amorfo), c' (sólido cristalino), s (solución)), ΔHp(xy) y ΔSp(xy) son la entalpía (unidad SI: julio por kelvin) y la entropía (unidad SI: julio) correspondientes de polimerización, y T es la temperatura absoluta (unidad SI: Kelvin). La entalpía libre de polimerización (ΔGp) se puede expresar como la suma de la entalpía estándar de polimerización (ΔGp°) y un término relacionado con moléculas de monómero instantáneas y macromoléculas en crecimiento. concentraciones:
- Δ Δ Gp=Δ Δ Gp∘ ∘ +RTIn [...− − ()m)i+1mAlternativa Alternativa ][M][...− − ()m)imAlternativa Alternativa ]{displaystyle Delta G_{p}=Delta G_{p} {circ }+RTln {frac [...-(m)_{i+1}m^{ast } {m] [m]_{i}m^{ast }}}}
donde R es la constante de los gases, M es el monómero, (m)i es el monómero en estado inicial y m* es el monómero activo. Siguiendo la teoría de la solución de Flory-Huggins de que la reactividad de un centro activo, situado en una macromolécula de una cadena macromolecular suficientemente larga, no depende de su grado de polimerización (DPi), y teniendo en cuenta que ΔGp° = ΔHp° - TΔSp° (donde ΔHp° y ΔSp° indican un entalpía y entropía de polimerización estándar, respectivamente), obtenemos:
- Δ Δ Gp=Δ Δ Hp∘ ∘ − − T()Δ Δ Sp∘ ∘ +RIn [M]){displaystyle Delta G_{p}=Delta ¿Qué? }-T(Delta S_{p}{circ }+Rln[M]}
En el equilibrio (ΔGp = 0), cuando se completa la polimerización, la concentración de monómero ([M]eq) asume un valor determinado por los parámetros de polimerización estándar (ΔHp° y ΔSp°) y temperatura de polimerización:
- [M]eq=eΔ Δ Hp∘ ∘ RT− − Δ Δ Sp∘ ∘ R{displaystyle [M] {Delta H_{} {fnMicrosoft Sans Serif} {fnMicrosoft Sans Serif} {fnMicrosoft Sans Serif}} {fnMicrosoft Sans Serif} {fnMicrosoft} {f} {fnMicrosoft}f}fnMicrosoft {fnMicrosoft}f}f}f}f}f}f}f}f}fnKf}fnKfnKf}fnKfnKfnKf}fnKfnKf}f}f}f}f}fnfnKfnKf}f}fnfnKfnfnfnfnKfnfnfnfnKfnfnKfnfnKf}fnKf}fnKfn } {RT}-{frac {Delta S_{} {fnMicrosoft Sans Serif} {fnMicrosoft Sans Serif} {fnMicrosoft Sans Serif} } {R}}}
- In DPnDPn− − 1[M]eq=Δ Δ Hp∘ ∘ RT− − Δ Δ Sp∘ ∘ R{displaystyle ln {frac {fn} {fn} {fn} {fn}} {fn}}} {fn}} {fn}} {fn}}} {fn}} {fn} {fn}} {fn}} {fn}} {fn}}}} {fn}}}} {fn}}}}} {\fn}}}}}}}}} {\\\\\\\\\fn}\\\\\\\\\\\fn}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}\\\\\\\\\\\\\fn}}\\\\\\\\\\\\\\\\\ {Delta H_{} {fnMicrosoft Sans Serif} {fnMicrosoft Sans Serif} {fnMicrosoft Sans Serif}} {fnMicrosoft Sans Serif} {fnMicrosoft} {f} {fnMicrosoft}f}fnMicrosoft {fnMicrosoft}f}f}f}f}f}f}f}f}fnKf}fnKfnKf}fnKfnKfnKf}fnKfnKf}f}f}f}f}fnfnKfnKf}f}fnfnKfnfnfnfnKfnfnfnfnKfnfnKfnfnKf}fnKf}fnKfn } {RT}-{frac {Delta S_{} {fnMicrosoft Sans Serif} {fnMicrosoft Sans Serif} {fnMicrosoft Sans Serif} } {R}}
- [M]eq=DPn− − 1DPneΔ Δ Hp∘ ∘ RT− − Δ Δ Sp∘ ∘ R{displaystyle [M]_{eq}={frac {fn} {fn} {fn}fn}} {fnfn}}} {\fn}}}}}}}\fn} {\fn}}}}}}}}\fnfn}\\\fn}}}\\\fn}}}}}\\\\\fn}}\\\\\\\\\\\\\\fn}}}\\\\\\\\\\\\\\\\\\\fn}}}\\\\\\\\\fn}}}}\\\\\\\\\\\\\\\\\\\\\\ {Delta H_{} {fnMicrosoft Sans Serif} {fnMicrosoft Sans Serif} {fnMicrosoft Sans Serif}} {fnMicrosoft Sans Serif} {fnMicrosoft} {f} {fnMicrosoft}f}fnMicrosoft {fnMicrosoft}f}f}f}f}f}f}f}f}fnKf}fnKfnKf}fnKfnKfnKf}fnKfnKf}f}f}f}f}fnfnKfnKf}f}fnfnKfnfnfnfnKfnfnfnfnKfnfnKfnfnKf}fnKf}fnKfn } {RT}-{frac {Delta S_{} {fnMicrosoft Sans Serif} {fnMicrosoft Sans Serif} {fnMicrosoft Sans Serif} } {R}}}
La polimerización solo es posible cuando [M]0 > [M]equivalente. Eventualmente, en o por encima de la llamada temperatura de techo (Tc), a la cual [M]eq = [M]0, la formación del alto polímero no se produce.
- <math alttext="{displaystyle T_{c}={frac {Delta H_{p}^{circ }}{Delta S_{p}^{circ }+Rln[M]_{0}}};(Delta H_{p}^{circ }<0,Delta S_{p}^{circ }Tc=Δ Δ Hp∘ ∘ Δ Δ Sp∘ ∘ +RIn [M]0;()Δ Δ Hp∘ ∘ .0,Δ Δ Sp∘ ∘ .0){displaystyle T_{c}={frac {Delta H_{} {fnMicrosoft Sans Serif} {fnMicrosoft Sans Serif} {fnMicrosoft Sans Serif}} {fnMicrosoft Sans Serif} {fnMicrosoft} {f} {fnMicrosoft}f}fnMicrosoft {fnMicrosoft}f}f}f}f}f}f}f}f}fnKf}fnKfnKf}fnKfnKfnKf}fnKfnKf}f}f}f}f}fnfnKfnKf}f}fnfnKfnfnfnfnKfnfnfnfnKfnfnKfnfnKf}fnKf}fnKfn ¿Qué? ♪ ♪ ♪ ♪ ♪ ♪ ♪ ♪ ♪ ♪ ♪ ♪ ♪ ♪ ♪ ♪ ♪ ♪ ♪ ♪ ♪ ♪ ♪ ♪ ♪ ♪ ♪ ♪ ♪ ♪ ♪ ♪ ♪ ♪ ♪ ♪ ♪ ♪ ♪ ♪ ♪ ♪ ♪ ♪ ♪ ♪ ♪ ♪ ♪ ♪ ♪ ♪ ♪ ♪ ♪ ♪ ♪ ♪♪ }<img alt="{displaystyle T_{c}={frac {Delta H_{p}^{circ }}{Delta S_{p}^{circ }+Rln[M]_{0}}};(Delta H_{p}^{circ }<0,Delta S_{p}^{circ }
- 0,Delta S_{p}^{circ }>0)}" xmlns="http://www.w3.org/1998/Math/MathML">Tf=Δ Δ Hp∘ ∘ Δ Δ Sp∘ ∘ +RIn [M]0;()Δ Δ Hp∘ ∘ ■0,Δ Δ Sp∘ ∘ ■0){displaystyle T_{f}={frac {Delta H_{} {fnMicrosoft Sans Serif} {fnMicrosoft Sans Serif} {fnMicrosoft Sans Serif}} {fnMicrosoft Sans Serif} {fnMicrosoft} {f} {fnMicrosoft}f}fnMicrosoft {fnMicrosoft}f}f}f}f}f}}f}f}f}fnKf}fnKf}f}fnKfnKfnKf}fnKfnfnf}f}f}f}fnfnKfnKfnKf}fnfnKfnfnKfnfnKfnfnKfnHfnfnKfnfnKfnKfnKf}f}fnMi {fnMicrosoft Sans Serif} {fnMicrosoft Sans Serif}}Delta H_{p}p}{circ }0}Delta S_{0}} {fnMicrosoft Sans Serif}
0,Delta S_{p}^{circ }>0)}" aria-hidden="true" class="mwe-math-fallback-image-inline" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/6e6df806a58eb14a0c1d2026a35060793abae2dc" style="vertical-align: -2.671ex; width:44.666ex; height:6.509ex;"/>
Por ejemplo, el tetrahidrofurano (THF) no puede polimerizarse por encima de Tc = 84 °C, ni el ciclooctasulfuro (S8) por debajo de Tf = 159 °C. Sin embargo, para muchos monómeros, Tc y Tf, para la polimerización en masa, están muy por encima o por debajo de las temperaturas de polimerización operativas, respectivamente. La polimerización de la mayoría de los monómeros va acompañada de una disminución de la entropía, debido principalmente a la pérdida de los grados de libertad de traslación. En esta situación, la polimerización se permite termodinámicamente solo cuando prevalece la contribución entálpica en ΔGp (por lo tanto, cuando ΔHp° < 0 y ΔSp° < 0, se requiere la desigualdad |ΔHp| > -TΔSp). Por lo tanto, cuanto mayor sea la tensión del anillo, menor será la concentración de monómero resultante en el equilibrio.
Lectura adicional
- Suerte, editado por Rajender K. Sadhir, Russell M. (1992). Monomers en expansión: Síntesis, caracterización y aplicaciones. Boca Raton, Florida: CRC Prensa. ISBN 9780849351563.
{{cite book}}:|first=tiene nombre genérico (ayuda)CS1 maint: múltiples nombres: lista de autores (link) - Sugiyama, J; R. Nagahata; M. Goyal; M. Asai; M. Ueda; K. Takeuchi (1998). ACS Polymer Preprints. 1. 40: 90.
{{cite journal}}: Desaparecido o vacío|title=(Ayuda)■/ref - Nikos Hadjichristidis, Hermis Iatrou, Marinos Pitsikalis, Georgios Sakellariou (2009). "Sintesis de materiales polipéptidos bien definidos a través de la polimerización abierta del anillo de α-Aminoácidos N-Carboxyanhydrides". Reseñas químicas. 109 (11): 5528–5578. doi:10.1021/cr900049t. PMID 19691359.
{{cite journal}}: CS1 maint: utiliza el parámetro autores (link) - Nahrain E. Kamber, Wonhee Jeong, Robert M. Waymouth, Russell C. Pratt, Bas G. Lohmeijer, James L. Hedrick (2007). "Organocatalytic Ring-Opening Polymerization". Reseñas químicas. 107 (12): 5813–5840. doi:10.1021/cr068415b. PMID 17988157.
{{cite journal}}: CS1 maint: utiliza el parámetro autores (link)■/ref - Matsumura, Shuichi; Tsukada, Keisuke; Toshima, Kazunobu (mayo de 1997). "Polímerización abierta de anillos enzimizados de 1,3-Dioxan-2-uno a Poly(trimetileno carbonato)". Macromolecules. 30 (10): 3122–3124. Código:1997Mala..30.3122M. doi:10.1021/ma961862g.
Contenido relacionado
Institución Smithsonian
Interfaz de tarifa básica
Excesión

![{displaystyle Delta G_{p}=Delta G_{p}^{circ }+RTln {frac {[...-(m)_{i+1}m^{ast }]}{[M][...-(m)_{i}m^{ast }]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/2f66c66b7d35e2dacc1671504f30e5493ab91515)
![{displaystyle Delta G_{p}=Delta H_{p}^{circ }-T(Delta S_{p}^{circ }+Rln[M])}](https://wikimedia.org/api/rest_v1/media/math/render/svg/220a922430e9e4f58818db0e2be969135dd4db24)
![{displaystyle [M]_{eq}=e^{{frac {Delta H_{p}^{circ }}{RT}}-{frac {Delta S_{p}^{circ }}{R}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4cd104ac37a2933a91a5db8cec562cc82c93fe2d)
![{displaystyle ln {frac {DP_{n}}{DP_{n}-1}}[M]_{eq}={frac {Delta H_{p}^{circ }}{RT}}-{frac {Delta S_{p}^{circ }}{R}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7e952ca7bef98adae8b44b05c2517e95f8506fce)
![{displaystyle [M]_{eq}={frac {DP_{n}-1}{DP_{n}}}e^{{frac {Delta H_{p}^{circ }}{RT}}-{frac {Delta S_{p}^{circ }}{R}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/d81a5355102302fa1c50ae9e83c576644f628884)