Plasmodium falciparum
Plasmodium falciparum es un parásito protozoario unicelular de los humanos y la especie más mortífera de Plasmodium que causa malaria en los humanos. El parásito se transmite a través de la picadura de una hembra de mosquito Anopheles y causa la forma más peligrosa de la enfermedad, la malaria falciparum. Es responsable de alrededor del 50% de todos los casos de malaria. P. falciparum se considera, por tanto, el parásito más mortal para los seres humanos. También se asocia con el desarrollo de cáncer de sangre (linfoma de Burkitt) y está clasificado como carcinógeno del Grupo 2A (probable).
La especie se originó a partir del parásito de la malaria Laverania que se encontraba en los gorilas, hace unos 10.000 años. Alphonse Laveran fue el primero en identificar el parásito en 1880 y lo llamó Oscillaria malariae. Ronald Ross descubrió su transmisión por mosquitos en 1897. Giovanni Battista Grassi aclaró la transmisión completa de un mosquito anofelino hembra a humanos en 1898. En 1897, William H. Welch creó el nombre Plasmodium falciparum, que ICZN formalmente adoptado en 1954. P. falciparum asume varias formas diferentes durante su ciclo de vida. La etapa infectiva para humanos son los esporozoitos de la glándula salival de un mosquito. Los esporozoitos crecen y se multiplican en el hígado para convertirse en merozoitos. Estos merozoítos invaden los eritrocitos (glóbulos rojos) para formar trofozoítos, esquizontes y gametocitos, durante los cuales se producen los síntomas de la malaria. En el mosquito, los gametocitos se reproducen sexualmente hasta formar un cigoto, que se convierte en ookinete. El oocineto forma ovocitos a partir de los cuales se forman los esporozoitos.
En 2021 se produjeron 247 millones de casos de malaria en todo el mundo, lo que provocó unas 619.000 muertes. Casi todas las muertes por malaria son causadas por P. falciparum, y el 95% de estos casos ocurren en África. Los niños menores de cinco años son los más afectados y representan el 80% del total de muertes. En África subsahariana, casi el 100% de los casos se debieron a P. falciparum, mientras que en la mayoría de los demás países donde hay malaria predominan otras especies de plasmodios menos virulentos.
Historia

Falciparum malaria era familiar para los antiguos griegos, que dieron el nombre general πyouρεός ()pyretós"fever". Hippocrates (c. 460-370 BCE) dio varias descripciones sobre fiebre terciana y fiebre cuartan. Era predominante en las antiguas civilizaciones egipcia y romana. Fueron los romanos quienes nombraron la enfermedad "malaria"—mala para mal, y aria para el aire, como creían que la enfermedad se diseminó por el aire contaminado, o el miasma.
Descubrimiento
Un médico alemán, Johann Friedrich Meckel, debe haber sido el primero en ver P. falciparum pero sin saber qué era. En 1847, informó de la presencia de gránulos de pigmento negro en la sangre y el bazo de un paciente que murió de malaria. El médico del ejército francés Charles Louis Alphonse Laveran, mientras trabajaba en el Hospital Bône (ahora Annaba en Argelia), identificó correctamente el parásito como patógeno causante de la malaria en 1880. Presentó su descubrimiento ante la Academia Francesa de Medicina en París y lo publicó. en The Lancet en 1881. Le dio el nombre científico Oscillaria malariae. Sin embargo, su descubrimiento fue recibido con escepticismo, principalmente porque en ese momento destacados médicos como Theodor Albrecht Edwin Klebs y Corrado Tommasi-Crudeli afirmaban haber descubierto una bacteria (a la que llamaron Bacillus malariae) como el patógeno de la malaria. El descubrimiento de Laveran sólo fue ampliamente aceptado después de cinco años, cuando Camillo Golgi confirmó el parásito utilizando mejores microscopios y técnicas de tinción. Laveran recibió el Premio Nobel de Fisiología o Medicina en 1907 por su trabajo. En 1900, el zoólogo italiano Giovanni Battista Grassi clasificó las especies de Plasmodium según el momento de la fiebre en el paciente; La malaria terciana maligna fue causada por Laverania malariae (ahora P. falciparum), la malaria terciana benigna por Haemamoeba vivax (ahora P. vivax ), y malaria cuartana por Haemamoeba malariae (ahora P. malariae).
El médico británico Patrick Manson formuló la teoría de la malaria por mosquitos en 1894; Hasta ese momento, se creía que los parásitos de la malaria se propagaban en el aire en forma de miasma, una palabra griega que significa contaminación. Su colega Ronald Ross, del Servicio Médico Indio, validó la teoría mientras trabajaba en la India. Ross descubrió en 1897 que los parásitos de la malaria vivían en ciertos mosquitos. Al año siguiente, demostró que un parásito de la malaria de las aves podía transmitirse mediante mosquitos de un ave a otra. Casi al mismo tiempo, Grassi demostró que P. falciparum fue transmitido en humanos únicamente por la hembra del mosquito anofelino (en su caso Anopheles claviger). Ross, Manson y Grassi fueron nominados al Premio Nobel de Fisiología o Medicina en 1902. En circunstancias controvertidas, sólo Ross fue seleccionado para el premio.
Hubo un largo debate sobre la taxonomía. No fue hasta 1954 que la Comisión Internacional de Nomenclatura Zoológica aprobó oficialmente el binomio Plasmodium falciparum. El género válido Plasmodium fue creado por dos médicos italianos Ettore Marchiafava y Angelo Celli en 1885. La palabra griega plasma significa "moho" o "forma"; oeidēs significa "ver" o "saber" El nombre de la especie fue introducido por el médico estadounidense William Henry Welch en 1897. Se deriva del latín falx, que significa "hoz" y parum que significa "parecido o igual a otro".
Origen y evolución
P. falciparum actualmente se acepta generalmente que evolucionó a partir de la especie Laverania (un subgénero de Plasmodium que se encuentra en los simios) presente en los gorilas de África occidental. La diversidad genética indica que el protozoo humano surgió hace unos 10.000 años. El pariente más cercano de P. falciparum es P. praefalciparum, un parásito de los gorilas, respaldado por secuencias de ADN mitocondrial, apicoplástico y nuclear. Estas dos especies están estrechamente relacionadas con el parásito chimpancé P. reichenowi, que anteriormente se pensaba que era el pariente más cercano de P. falciparum. P. falciparum también se pensó que se originaba a partir de un parásito de las aves.
Los niveles de polimorfismo genético son extremadamente bajos dentro del P. falciparum en comparación con el de especies estrechamente relacionadas de Plasmodium que infectan simios (incluido P. praefalciparum). Esto sugiere que el origen de P. falciparum en humanos es reciente, ya que un solo P. praefalciparum se volvió capaz de infectar a los humanos. La información genética de P. falciparum ha señalado una expansión reciente que coincide con la revolución agrícola. Es probable que el desarrollo de la agricultura extensiva aumentara la densidad de población de mosquitos al dar lugar a más sitios de reproducción, lo que puede haber desencadenado la evolución y expansión de P. falciparum.
Estructura


P. falciparum no tiene una estructura fija sino que sufre cambios continuos durante el transcurso de su ciclo de vida. Un esporozoito tiene forma de huso y mide entre 10 y 15 μm de largo. En el hígado crece hasta convertirse en un esquizonte ovoide de 30 a 70 μm de diámetro. Cada esquizonte produce merozoitos, cada uno de los cuales mide aproximadamente 1,5 μm de longitud y 1 μm de diámetro. En el eritrocito, los merozoítos forman una estructura en forma de anillo, convirtiéndose en un trofozoíto. Un trofozoito se alimenta de la hemoglobina y forma un pigmento granular llamado hemozoína. A diferencia de los de otras especies de Plasmodium, los gametocitos de P. falciparum son alargados y tienen forma de media luna, por lo que a veces se los identifica. Un gametocito maduro mide entre 8 y 12 μm de largo y entre 3 y 6 μm de ancho. El ookinete también es alargado y mide entre 18 y 24 μm. Un ooquiste es redondeado y puede crecer hasta 80 μm de diámetro. El examen microscópico de un frotis de sangre revela sólo trofozoítos y gametocitos tempranos (en forma de anillo) que se encuentran en la sangre periférica. Trofozoitos o esquizontes maduros en frotis de sangre periférica, ya que suelen estar secuestrados en los tejidos. En ocasiones, se observan puntos rojos débiles, en forma de coma, en la superficie de los eritrocitos. Estos puntos son la hendidura de Maurer y son orgánulos secretores que producen proteínas y enzimas esenciales para la absorción de nutrientes y los procesos de evasión inmune.
El complejo apical, que en realidad es una combinación de orgánulos, es una estructura importante. Contiene orgánulos secretores llamados rhoptries y micronemas, que son vitales para la movilidad, la adhesión, la invasión de la célula huésped y la formación de vacuolas parasitóforas. Como apicomplejo, alberga un plastidio, un apicoplasto, similar a los cloroplastos de las plantas, que probablemente adquirieron al envolver (o ser invadido por) un alga eucariota y retener el plastidio del alga como un orgánulo distintivo encerrado dentro de cuatro membranas. El apicoplasto participa en la síntesis de lípidos y varios otros compuestos y proporciona un objetivo farmacológico atractivo. Durante la etapa sanguínea asexual de la infección, una función esencial del apicoplasto es producir los precursores isoprenoides pirofosfato de isopentenilo (IPP) y pirofosfato de dimetilalilo (DMAPP) a través de la vía MEP (no mevalonato).
Genoma
En 1995 se creó el Proyecto Genoma de la Malaria para secuenciar el genoma de P. falciparum. El genoma de su mitocondria se informó en 1995, el del plastidio no fotosintético conocido como apicoplasto en 1996 y la secuencia del primer cromosoma nuclear (cromosoma 2) en 1998. La secuencia del cromosoma 3 se informó en 1999 y el genoma completo. se informó el 3 de octubre de 2002. El genoma de aproximadamente 24 megabases es extremadamente rico en AT (alrededor del 80%) y está organizado en 14 cromosomas. Se describieron poco más de 5.300 genes. Muchos genes implicados en la variación antigénica se encuentran en las regiones subteloméricas de los cromosomas. Estos se dividen en las familias var, rif y stevor. Dentro del genoma, existen 59 genes var, 149 rif y 28 stevor, junto con múltiples pseudogenes y truncamientos. Se estima que 551, o aproximadamente el 10%, de las proteínas codificadas en el núcleo nuclear predichas están dirigidas al apicoplasto, mientras que el 4,7% del proteoma está dirigida a las mitocondrias.
Ciclo de vida

Los humanos son los huéspedes intermediarios en los que se produce la reproducción asexual, y las hembras de los mosquitos anofelinos son los huéspedes definitivos que albergan la etapa de reproducción sexual.
En humanos
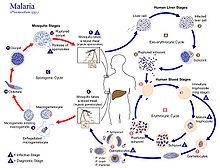
La infección en humanos comienza con la picadura de un mosquito Anopheles hembra infectado. De aproximadamente 460 especies de mosquitos Anopheles, más de 70 especies transmiten la malaria falciparum. Anopheles gambiae es uno de los vectores más conocidos y prevalentes, especialmente en África.
La etapa infecciosa llamada esporozoíto se libera de las glándulas salivales a través de la probóscide del mosquito para ingresar a través de la piel durante la alimentación. La saliva del mosquito contiene enzimas antihemostáticas y antiinflamatorias que alteran la coagulación de la sangre e inhiben la reacción dolorosa. Normalmente, cada picadura infectada contiene entre 20 y 200 esporozoitos. Una proporción de esporozoítos invade las células del hígado (hepatocitos). Los esporozoitos se mueven en el torrente sanguíneo mediante deslizamiento, impulsado por un motor formado por las proteínas actina y miosina debajo de su membrana plasmática.
Etapa hepática o esquizogonia exoeritrocítica
Al entrar en los hepatocitos, el parásito pierde su complejo apical y su capa superficial y se transforma en un trofozoíto. Dentro de la vacuola parasitófora del hepatocito, sufre de 13 a 14 rondas de mitosis que producen una célula sincitial (cenocito) llamada esquizonte. Este proceso se llama esquizogonia. Un esquizonte contiene decenas de miles de núcleos. De la superficie del esquizonte emergen decenas de miles de células hijas haploides (1n) llamadas merozoítos. La etapa hepática puede producir hasta 90.000 merozoítos, que finalmente se liberan al torrente sanguíneo en vesículas llenas de parásitos llamadas merosomas.
Estadio sanguíneo o esquizogonia eritrocítica
Los merozoítos utilizan los orgánulos de invasión apicomplejos (complejo apical, película y cubierta superficial) para reconocer e ingresar al eritrocito (glóbulo rojo) del huésped. Los merozoitos se unen primero al eritrocito en una orientación aleatoria. Luego se reorienta de manera que el complejo apical esté cerca de la membrana de los eritrocitos. El parásito forma una vacuola parasitófora, para permitir su desarrollo dentro del eritrocito. Este ciclo de infección se produce de forma muy sincrónica, con aproximadamente todos los parásitos de la sangre en la misma etapa de desarrollo. Se ha demostrado que este mecanismo de sincronización preciso depende del propio ritmo circadiano del huésped humano.
Dentro de los eritrocitos, el metabolismo del parásito depende de la digestión de la hemoglobina. Los síntomas clínicos de la malaria, como fiebre, anemia y trastornos neurológicos, se producen durante la etapa sanguínea.
El parásito también puede alterar la morfología de los eritrocitos, provocando protuberancias en la membrana de los eritrocitos. Los eritrocitos infectados suelen estar secuestrados en diversos tejidos u órganos humanos, como el corazón, el hígado y el cerebro. Esto se debe a que las proteínas de la superficie celular derivadas del parásito están presentes en la membrana de los eritrocitos, y son estas proteínas las que se unen a los receptores de las células humanas. El secuestro en el cerebro provoca malaria cerebral, una forma muy grave de la enfermedad, que aumenta la probabilidad de muerte de la víctima.
Trofozoíto
Después de invadir el eritrocito, el parásito pierde sus orgánulos de invasión específicos (complejo apical y cubierta superficial) y se desdiferencia en un trofozoíto redondo ubicado dentro de una vacuola parasitófora. El trofozoíto se alimenta de la hemoglobina del eritrocito, digiere sus proteínas y convierte (mediante biocristalización) el hemo restante en cristales de β-hematina insolubles y químicamente inertes llamados hemozoína. El trofozoíto joven (o etapa de "anillo", debido a su morfología en extensiones de sangre teñidas) crece sustancialmente antes de multiplicarse.
Esquizonte
En la etapa de esquizonte, el parásito replica su ADN varias veces y se producen múltiples divisiones mitóticas de forma asincrónica. La división y multiplicación celular en los eritrocitos se denomina esquizogonia eritrocítica. Cada esquizonte forma de 16 a 18 merozoítos. Los merozoítos rompen los glóbulos rojos. Los merozoítos liberados invaden los eritrocitos frescos. Un merozoíto libre permanece en el torrente sanguíneo durante aproximadamente 60 segundos antes de ingresar a otro eritrocito.
La duración de una esquizogonía eritrocítica completa es de aproximadamente 48 horas. Esto da lugar a las manifestaciones clínicas características de la malaria falciparum, como fiebre y escalofríos, correspondientes a la rotura sincrónica de los eritrocitos infectados.
Gametocito
Algunos merozoitos se diferencian en formas sexuales, gametocitos masculinos y femeninos. Estos gametocitos tardan aproximadamente entre 7 y 15 días en alcanzar la madurez completa, mediante el proceso llamado gametocitogénesis. Luego, estos son absorbidos por una hembra de mosquito Anopheles durante su ingesta de sangre.
Período de incubación
El tiempo de aparición de los síntomas de la infección (llamado período de incubación) es más corto para P. falciparum entre las especies de Plasmodium. El período de incubación promedio es de 11 días, pero puede oscilar entre 9 y 30 días. En casos aislados se han registrado períodos de incubación prolongados de hasta 2, 3 o incluso 8 años. El embarazo y la coinfección con el VIH son condiciones importantes para el retraso de los síntomas. Los parásitos se pueden detectar a partir de muestras de sangre al décimo día después de la infección (período previo a la patente).
En mosquitos
Dentro del intestino medio del mosquito, el proceso de maduración del gameto femenino conlleva ligeros cambios morfológicos, volviéndose más agrandados y esféricos. El gametocito masculino sufre una rápida división nuclear en 15 minutos, produciendo ocho microgametos flagelados mediante un proceso llamado exflagelación. El microgameto flagelado fertiliza al macrogameto femenino para producir una célula diploide llamada cigoto. Luego, el cigoto se convierte en un oikinet. El oikinet es una célula móvil, capaz de invadir otros órganos del mosquito. Atraviesa la membrana peritrófica del intestino medio del mosquito y cruza el epitelio del intestino medio. Una vez que atraviesa el epitelio, el ookinete ingresa a la lámina basal y se asienta en un ooquiste inmóvil. Durante varios días, el ooquiste sufre de 10 a 11 rondas de división celular para crear una célula sincitial (esporoblasto) que contiene miles de núcleos. La meiosis tiene lugar dentro del esporoblasto para producir más de 3000 células hijas haploides llamadas esporozoitos en la superficie de la célula madre. Los esporozoitos inmaduros atraviesan la pared del ooquiste hacia la hemolinfa. Migran a las glándulas salivales de los mosquitos, donde se desarrollan aún más y se vuelven infecciosos para los humanos.
Meiosis
Plasmodium falciparum es haploide (un conjunto de cromosomas) durante sus etapas reproductivas en la sangre y el hígado humanos. Cuando un mosquito se alimenta de sangre de un huésped humano infectado con Plasmodium, esta comida puede incluir microgametos y macrogametos haploides. Estos gametos pueden fusionarse dentro del mosquito para formar un cigoto de plasmodio diploide (2N), la única etapa diploide en el ciclo de vida de estos parásitos. El cigoto puede sufrir otra ronda de replicación cromosómica para formar un ookinete (4N) (ver Figura: Ciclo de vida del plasmodium). El okinato que se diferencia del cigoto es una etapa muy móvil que invade el intestino medio del mosquito. Los oikinetes pueden sufrir una meiosis que implica dos divisiones meióticas que conducen a la liberación de esporozoítos haploides (ver Figura). El esporozoíto es un estadio invasivo con forma de media luna alargada. Estos esporozoitos pueden migrar a las glándulas salivales del mosquito y pueden ingresar a un huésped humano cuando el mosquito ingiere sangre. Luego, el esporozoito puede trasladarse al hígado del huésped humano e infectar los hepatocitos.
El perfil de genes codificados por Plasmodium que se emplean en la meiosis tiene cierta superposición con el perfil de genes empleados en la meiosis en otros organismos mejor estudiados, pero es más divergente y carece de algunos componentes del proceso meiótico que se encuentran en otros organismos.. Durante la meiosis del Plasmodium, la recombinación se produce entre cromosomas homólogos como en otros organismos.
Interacción con el sistema inmunológico humano
Respuesta inmune
Un solo mosquito anofelino puede transmitir cientos de P. falciparum en un solo bocado en condiciones experimentales, pero en la naturaleza el número es generalmente inferior a 80. Los esporozoitos no ingresan directamente al torrente sanguíneo, sino que permanecen en la piel durante dos o tres horas. Aproximadamente entre el 15 y el 20% de los esporozoitos ingresan al sistema linfático, donde activan las células dendríticas, que las envían para su destrucción por los linfocitos T (células T CD8+). 48 horas después de la infección, se pueden detectar células T CD8+ específicas de Plasmodium en los ganglios linfáticos conectados a las células de la piel. La mayoría de los esporozoitos que quedan en el tejido de la piel son posteriormente destruidos por el sistema inmunológico innato. La glicoproteína del esporozoíto activa específicamente los mastocitos. Luego, los mastocitos producen moléculas de señalización como TNFα y MIP-2, que activan los devoradores de células (fagocitos profesionales), como los neutrófilos y los macrófagos.
Sólo una pequeña cantidad (0,5-5%) de esporozoítos ingresa al torrente sanguíneo hacia el hígado. En el hígado, las células T CD8+ activadas de la linfa se unen a los esporozoítos a través de la proteína circumsporozoíto (CSP). La presentación de antígenos por parte de las células dendríticas del tejido cutáneo a las células T también es un proceso crucial. A partir de esta etapa, los parásitos producen diferentes proteínas que ayudan a suprimir la comunicación de las células inmunes. Incluso en el punto álgido de la infección, cuando los glóbulos rojos (RBC) se rompen, las señales inmunes no son lo suficientemente fuertes como para activar los macrófagos o las células asesinas naturales.
Evasión del sistema inmunológico
Aunque P. falciparum es fácilmente reconocido por el sistema inmunológico humano, mientras que en el torrente sanguíneo evade la inmunidad al producir más de 2000 antígenos de membrana celular. Los esporozoitos en la etapa infecciosa inicial producen proteína circumsporozoíto (CSP), que se une a los hepatocitos. La proteína anónima relacionada con la trombospondina (TRAP) ayuda a unirse y entrar en los hepatocitos. TRAP y otras proteínas secretoras (incluida la proteína del micronema de esporozoitos esencial para el recorrido celular 1, SPECT1 y SPECT2) del micronema permiten que el esporozoito se mueva a través de la sangre, evitando las células inmunitarias y penetrando en los hepatocitos.
Durante la invasión de eritrocitos, los merozoitos liberan proteína de cubierta de merozoito 1 (MCP1), antígeno de membrana apical 1 (AMA1), antígenos de unión a eritrocitos (EBA), proteína de interacción con el dominio de cola de miosina A (MTIP) y proteínas de superficie de merozoito (MSP).). De estas MSP, MSP1 y MSP2 son las principales responsables de evitar las células inmunitarias. La virulencia de P. falciparum está mediada por proteínas de la membrana de los eritrocitos, que son producidas por los esquizontes y trofozoítos dentro de los eritrocitos y se muestran en la membrana de los eritrocitos. PfEMP1 es el más importante, capaz de actuar como antígeno y molécula de adhesión.
Patogenicidad
Los síntomas clínicos de la malaria falciparum se producen por la ruptura y destrucción de los eritrocitos por los merozoítos. La fiebre alta, llamada paroxismo, es la indicación más básica. La fiebre tiene un ciclo característico de etapa de calor, etapa de frío y etapas de sudoración. Dado que cada esquizogonia eritrocítica dura un ciclo de 48 horas, es decir, dos días, el síntoma febril aparece cada tres días. Esta es la razón por la que la infección recibe el nombre clásico de fiebre maligna terciana (terciana, un derivado de la palabra latina que significa "tercera"). Los síntomas más comunes son fiebre (>92% de los casos), escalofríos (79%), dolores de cabeza (70%) y sudoración (64%). Generalmente también se asocian mareos, malestar general, dolores musculares, dolores abdominales, náuseas, vómitos, diarrea leve y tos seca. También se diagnostican frecuencia cardíaca elevada, ictericia, palidez, hipotensión ortostática, agrandamiento del hígado y agrandamiento del bazo.
Los cristales insolubles de β-hematina, haemozoina, producidos a partir de la digestión de la hemoglobina de los RBCs es el principal agente que afecta a los órganos del cuerpo. Actuando como toxina sanguínea, los RBC que contienen haemozoína no pueden ser atacados por los fagocitos durante la respuesta inmunitaria a la malaria. Los fagocitos pueden ingerir haemozoínas libres liberadas después de la ruptura de RBCs por las que son inducidos a iniciar cadenas de reacción inflamatoria que resulta en aumento de fiebre. Es la hemozoina que se deposita en órganos corporales como el bazo y el hígado, así como en riñones y pulmones, para causar su ampliación y decoloración. Debido a esto, la haemozoina también se conoce como pigmento malaria.
A diferencia de otras malarias, que muestran una periodicidad regular de la fiebre, falciparum, aunque presenta un ciclo de 48 horas, generalmente se presenta como ataques irregulares de fiebre. Esta diferencia se debe a la capacidad de P. falciparum invadir una gran cantidad de glóbulos rojos secuencialmente sin intervalos coordinados, lo que no se observa en otros parásitos de la malaria. P. falciparum es, por lo tanto, responsable de casi todas las enfermedades humanas graves y muertes debidas a la malaria, en una condición llamada malaria perniciosa o complicada o grave. La malaria complicada ocurre con mayor frecuencia en niños menores de 5 años y, a veces, en mujeres embarazadas (una afección llamada específicamente malaria asociada al embarazo). Las mujeres se vuelven susceptibles a la malaria grave durante su primer embarazo. La susceptibilidad a la malaria grave se reduce en embarazos posteriores debido al aumento de los niveles de anticuerpos contra antígenos de superficie variantes que aparecen en los eritrocitos infectados. Pero una mayor inmunidad de la madre aumenta la susceptibilidad a la malaria en los recién nacidos.
P. falciparum trabaja a través de la secuestro, un proceso por el cual se agrupan grupos de RBC infectados, que no es exhibido por ninguna otra especie de parásitos malariales. Los esquizontes maduros cambian las propiedades superficiales de los eritrocitos infectados, causando que se adhieren a las paredes del vaso sanguíneo (citoadherencia). Esto conduce a la obstrucción de la microcirculación y produce disfunción de múltiples órganos, como el cerebro en la malaria cerebral.
La malaria cerebral es la afección más peligrosa de cualquier infección de malaria y la forma más grave de trastorno neurológico. Según la definición de la OMS, el síntoma clínico está indicado por el coma y el diagnóstico por un nivel elevado de merozoitos en las muestras de sangre periférica. Es la forma más mortífera de malaria, y a ella se le atribuyen entre 0,2 y más de un millón de muertes anuales a lo largo de los siglos. La mayoría de las muertes corresponden a niños menores de 5 años. Ocurre cuando los merozoítos invaden el cerebro y provocan daños cerebrales de diversos grados. La muerte es causada por la privación de oxígeno (hipoxia) debido a la producción de citoquinas inflamatorias y la fuga vascular inducida por los merozoítos. Entre los supervivientes, existen condiciones médicas persistentes como deterioro neurológico, discapacidad intelectual y problemas de conducta. Entre ellos, la epilepsia es la afección más común y la malaria cerebral es la principal causa de epilepsia adquirida entre los niños africanos.
La reaparición del síntoma falciparum, un fenómeno llamado recrudecimiento, se observa a menudo en los supervivientes. El recrudecimiento puede ocurrir incluso después de una medicación antipalúdica exitosa. Pueden pasar algunos meses o incluso varios años. En algunas personas, esto lleva hasta tres años. En casos aislados, la duración puede alcanzar o superar los 10 años. También es un incidente común entre las mujeres embarazadas.
Distribución y epidemiología

P. falciparum es endémica en 84 países y se encuentra en todos los continentes excepto Europa. Históricamente estuvo presente en la mayoría de los países europeos, pero la mejora de las condiciones de salud llevó a su desaparición a principios del siglo XX. Italia, el único país europeo donde históricamente prevalecía y de donde surgió el nombre de malaria, había sido declarado país erradicado de la malaria. En 1947, el gobierno italiano lanzó el Programa Nacional de Erradicación de la Malaria y, posteriormente, se implementó una campaña contra los mosquitos utilizando DDT. La OMS declaró a Italia libre de malaria en 1970.
En 2021 se produjeron 247 millones de casos de malaria en todo el mundo, lo que provocó unas 619.000 muertes. La infección es más frecuente en África, donde se produce el 94% de las muertes por malaria. Los niños menores de cinco años son los más afectados y el 67% de las muertes por malaria se produjeron en este grupo de edad. El 80% de la infección se encuentra en el África subsahariana, el 7% en el sudeste asiático y el 2% en el Mediterráneo oriental. Nigeria tiene la mayor incidencia, con el 27% del total de casos mundiales. Fuera de África, India tiene la incidencia más alta, con el 4,5% de la carga mundial. Europa se considera una región libre de malaria. Históricamente, el parásito y su enfermedad eran más conocidos en Europa. Pero los programas médicos desde principios del siglo XX, como la fumigación con insecticidas, la terapia con medicamentos y la ingeniería ambiental, dieron como resultado una erradicación completa en la década de 1970. Se estima que aproximadamente 2.400 millones de personas corren un riesgo constante de infección.
Tratamiento
Historia
En 1640, Huan del Vego empleó por primera vez la tintura de corteza de quina para tratar la malaria; los indios nativos de Perú y Ecuador lo usaban incluso antes para tratar la fiebre. Thompson (1650) introdujo este concepto de "jesuitas' ladrar" a Inglaterra. Su primer uso registrado allí fue por John Metford de Northampton en 1656. Morton (1696) presentó la primera descripción detallada del cuadro clínico de la malaria y de su tratamiento con quina. Gize (1816) estudió la extracción de quinina cristalina de la corteza de quina y Pelletier y Caventou (1820) en Francia extrajeron alcaloides de quinina pura, a los que denominaron quinina y cinconina. La síntesis total de quinina fue lograda por los químicos estadounidenses R.B. Woodward y W.E. Doering en 1944. Woodward recibió el Premio Nobel de Química en 1965.
Los intentos de fabricar antipalúdicos sintéticos comenzaron en 1891. Atabrine, desarrollado en 1933, se utilizó ampliamente en todo el Pacífico durante la Segunda Guerra Mundial, pero fue impopular debido a sus efectos adversos. A finales de la década de 1930, los alemanes desarrollaron la cloroquina, que se empezó a utilizar en las campañas del norte de África. Al crear un proyecto militar secreto llamado Proyecto 523, Mao Zedong alentó a los científicos chinos a encontrar nuevos antipalúdicos después de ver las bajas en la guerra de Vietnam. Tu Youyou descubrió la artemisinina en la década de 1970 a partir del ajenjo dulce (Artemisia annua). Este fármaco llegó a ser conocido por los científicos occidentales a finales de los años 1980 y principios de los 1990 y ahora es un tratamiento estándar. Tu ganó el Premio Nobel de Fisiología o Medicina en 2015.
Palaria no complicada
Según las directrices de la OMS de 2010, las terapias combinadas basadas en artemisinina (ACT) son los tratamientos antipalúdicos de primera línea recomendados para la malaria no complicada causada por P. falciparum. La OMS recomienda combinaciones como arteméter/lumefantrina, artesunato/amodiaquina, artesunato/mefloquina, artesunato/sulfadoxina/pirimetamina y dihidroartemisinina/piperaquina.
La elección de ACT se basa en el nivel de resistencia a los componentes de la combinación. La artemisinina y sus derivados no son apropiados para monoterapia. Como tratamiento antipalúdico de segunda línea, cuando el tratamiento inicial no funciona, se recomienda un TCA alternativo que se sabe que es eficaz en la región, como artesunato más tetraciclina o doxiciclina o clindamicina, y quinina más tetraciclina, doxiciclina o clindamicina. Cualquiera de estas combinaciones se debe administrar durante 7 días. Para las mujeres embarazadas, el tratamiento de primera línea recomendado durante el primer trimestre es quinina más clindamicina durante 7 días. Si este tratamiento falla, está indicado artesunato más clindamicina durante 7 días. Para los viajeros que regresan a países no endémicos, se recomienda atovacuona/proguanil, arteméter/lumefantrina y quinina más doxiciclina o clindamicina.
Palaria grave
Para adultos, se recomienda el artesunato intravenoso (IV) o intramuscular (IM). La quinina es una alternativa aceptable si no se dispone de artesunato parenteral.
Para los niños, especialmente en las áreas endémicas de malaria de África, se recomienda artesunato IV o IM, quinina (infusión IV o inyección IM dividida) y arteméter IM.
Los antipalúdicos parenterales deben administrarse durante un mínimo de 24 horas, independientemente de la capacidad del paciente para tolerar antes la medicación oral. Posteriormente, se recomienda un tratamiento completo que incluya un ciclo completo de ACT o quinina más clindamicina o doxiciclina.
Vacunación
RTS,S es la única candidata a vacuna contra la malaria que ha pasado por ensayos clínicos. El análisis de los resultados del ensayo de fase III (realizado entre 2011 y 2016) reveló una eficacia bastante baja (20-39% según la edad, con hasta un 50% en bebés de 5 a 17 meses), lo que indica que la vacuna no conducirá a una protección y erradicación totales.
El 6 de octubre de 2021, la Organización Mundial de la Salud recomendó la vacunación contra la malaria a los niños en riesgo.
Cáncer
La Agencia Internacional para la Investigación del Cáncer (IARC) ha clasificado la malaria debido a P. falciparum como carcinógeno del Grupo 2A, lo que significa que el parásito es probablemente un agente causante de cáncer en humanos. Está establecida su asociación con un cáncer de células sanguíneas (linfocitos) llamado linfoma de Burkitt. El linfoma de Burkitt fue descubierto por Denis Burkitt en 1958 en niños africanos, y más tarde especuló que el cáncer probablemente se debía a ciertas enfermedades infecciosas. En 1964, se identificó a partir de células cancerosas un virus, más tarde llamado virus de Epstein-Barr (VEB), en honor a sus descubridores. Posteriormente se demostró que el virus era el agente cancerígeno directo y ahora está clasificado como carcinógeno del grupo 1.
En 1989, se descubrió que el EBV requiere otras infecciones, como la malaria, para provocar la transformación de los linfocitos. Se informó que la incidencia del linfoma de Burkitt disminuyó con el tratamiento eficaz de la malaria durante varios años. El papel real desempeñado por P. falciparum permaneció sin estar clara durante las siguientes dos décadas y media. Se sabía que el VEB inducía a los linfocitos a volverse cancerosos utilizando sus proteínas virales (antígenos como EBNA-1, EBNA-2, LMP1 y LMP2A). A partir de 2014 quedó claro que P. falciparum contribuye al desarrollo del linfoma. P. falciparum infectados con eritrocitos se unen directamente a los linfocitos B a través del dominio CIDR1α de PfEMP1. Esta unión activa los receptores tipo peaje (TLR7 y TLR10), lo que provoca una activación continua de los linfocitos para que experimenten proliferación y diferenciación en células plasmáticas, aumentando así la secreción de IgM y citoquinas. Esto, a su vez, activa una enzima llamada citidina desaminasa inducida por activación (AID), que tiende a causar mutaciones en el ADN (por rotura de doble cadena) de los linfocitos infectados por EBV. El ADN dañado sufre una replicación incontrolada, lo que hace que la célula sea cancerosa.
Influencia en el genoma humano
La alta mortalidad y morbilidad causada por P. falciparum ha ejercido una gran presión selectiva sobre el genoma humano. Varios factores genéticos proporcionan cierta resistencia a la infección por Plasmodium, incluido el rasgo de células falciformes, los rasgos de talasemia, la deficiencia de glucosa-6-fosfato deshidrogenasa y la ausencia de antígenos de Duffy en los glóbulos rojos. E. A. Beet, un médico que trabajaba en Rhodesia del Sur (ahora Zimbabwe) había observado en 1948 que la anemia falciforme estaba relacionada con una tasa más baja de infecciones por malaria. Esta sugerencia fue reiterada por J. B. S. Haldane en 1948, quien sugirió que la talasemia podría proporcionar una protección similar. Desde entonces, esta hipótesis ha sido confirmada y ampliada a la hemoglobina E y la hemoglobina C.