Planchar
Hierro () es un elemento químico de símbolo Fe (del latín: ferrum) y número atómico 26. Es un metal que pertenece a la primera serie de transición y al grupo 8 de la tabla periódica. Es, por masa, el elemento más común en la Tierra, justo delante del oxígeno (32,1 % y 30,1 %, respectivamente), y forma gran parte del núcleo exterior e interior de la Tierra. Es el cuarto elemento más común en la corteza terrestre.
En su estado metálico, el hierro es raro en la corteza terrestre y se limita principalmente a la deposición de meteoritos. Los minerales de hierro, por el contrario, se encuentran entre los más abundantes en la corteza terrestre, aunque extraer metal utilizable de ellos requiere hornos u hornos capaces de alcanzar los 1500 °C (2730 °F) o más, unos 500 °C (932 °F) más alto que el requerido para fundir cobre. Los humanos comenzaron a dominar ese proceso en Eurasia durante el segundo milenio a. C. y el uso de herramientas y armas de hierro comenzó a desplazar a las aleaciones de cobre, en algunas regiones, solo alrededor del 1200 a. Ese evento se considera la transición de la Edad del Bronce a la Edad del Hierro. En el mundo moderno, las aleaciones de hierro, como el acero, el acero inoxidable, el hierro fundido y los aceros especiales, son con mucho los metales industriales más comunes, debido a sus propiedades mecánicas y bajo costo. La industria del hierro y el acero es, por lo tanto, muy importante económicamente, y el hierro es el metal más barato, con un precio de unos pocos dólares por kilogramo o por libra (ver Usos del metal).
Las superficies de hierro puro impecables y suaves son de color gris plateado como un espejo. Sin embargo, el hierro reacciona fácilmente con el oxígeno y el agua para dar óxidos de hierro hidratados de color marrón a negro, comúnmente conocidos como herrumbre. A diferencia de los óxidos de algunos otros metales que forman capas de pasivación, el óxido ocupa más volumen que el metal y, por lo tanto, se descascara, exponiendo más superficies frescas a la corrosión. Aunque el hierro reacciona fácilmente, el hierro de alta pureza, llamado hierro electrolítico, tiene mejor resistencia a la corrosión.
El cuerpo de un ser humano adulto contiene alrededor de 4 gramos (0,005 % del peso corporal) de hierro, principalmente en hemoglobina y mioglobina. Estas dos proteínas juegan un papel esencial en el metabolismo de los vertebrados, respectivamente, el transporte de oxígeno por la sangre y el almacenamiento de oxígeno en los músculos. Para mantener los niveles necesarios, el metabolismo del hierro humano requiere un mínimo de hierro en la dieta. El hierro también es el metal en el sitio activo de muchas enzimas redox importantes que se ocupan de la respiración celular y la oxidación y reducción en plantas y animales.
Químicamente, los estados de oxidación más comunes del hierro son el hierro (II) y el hierro (III). El hierro comparte muchas propiedades con otros metales de transición, incluidos los otros elementos del grupo 8, el rutenio y el osmio. El hierro forma compuestos en una amplia gama de estados de oxidación, de -2 a +7. El hierro también forma muchos compuestos de coordinación; algunos de ellos, como el ferroceno, el ferrioxalato y el azul de Prusia, tienen importantes aplicaciones industriales, médicas o de investigación.
Características
Alótropos
Se conocen al menos cuatro alótropos de hierro (diferentes arreglos de átomos en el sólido), denominados convencionalmente α, γ, δ y ε.
Las tres primeras formas se observan a presiones ordinarias. A medida que el hierro fundido se enfría más allá de su punto de congelación de 1538 °C, cristaliza en su alótropo δ, que tiene una estructura cristalina cúbica centrada en el cuerpo (bcc). A medida que se enfría más a 1394 °C, cambia a su alótropo de hierro γ, una estructura cristalina cúbica centrada en las caras (fcc) o austenita. A 912 °C o menos, la estructura cristalina vuelve a convertirse en el alótropo bcc α-hierro.
Las propiedades físicas del hierro a presiones y temperaturas muy altas también se han estudiado ampliamente debido a su relevancia para las teorías sobre los núcleos de la Tierra y otros planetas. Por encima de aproximadamente 10 GPa y temperaturas de unos pocos cientos de Kelvin o menos, el hierro α cambia a otra estructura compacta hexagonal (hcp), que también se conoce como hierro ε. La fase γ de temperatura más alta también se transforma en hierro ε, pero lo hace a una presión más alta.
Existe cierta evidencia experimental controvertida de una fase β estable a presiones superiores a 50 GPa y temperaturas de al menos 1500 K. Se supone que tiene una estructura ortorrómbica o doble hcp. (Confusamente, el término 'hierro β' a veces también se usa para referirse al hierro α por encima de su punto de Curie, cuando cambia de ser ferromagnético a paramagnético, aunque su estructura cristalina no ha cambiado).
En general, se supone que el núcleo interno de la Tierra consiste en una aleación de hierro y níquel con estructura ε (o β).
Puntos de fusión y ebullición
Los puntos de fusión y ebullición del hierro, junto con su entalpía de atomización, son más bajos que los de los elementos 3D anteriores, desde el escandio hasta el cromo, lo que muestra la menor contribución de los electrones 3D a los enlaces metálicos a medida que se atraen cada vez más. en el núcleo inerte por el núcleo; sin embargo, son más altos que los valores del elemento anterior manganeso porque ese elemento tiene una subcapa 3d llena a la mitad y, en consecuencia, sus electrones d no se deslocalizan fácilmente. Esta misma tendencia aparece para el rutenio pero no para el osmio.
El punto de fusión del hierro está bien definido experimentalmente para presiones inferiores a 50 GPa. Para presiones mayores, los datos publicados (a partir de 2007) todavía varían en decenas de gigapascales y más de mil kelvin.
Propiedades magnéticas
Por debajo de su punto de Curie de 770 °C (1420 °F; 1040 K), el hierro α cambia de paramagnético a ferromagnético: los espines de los dos electrones desapareados en cada átomo generalmente se alinean con los espines de sus vecinos, creando un campo magnético total. Esto sucede porque los orbitales de esos dos electrones (dz2 y dx 2 −. y2) no apuntan hacia los átomos vecinos en la red y, por lo tanto, no están involucrados en el enlace metálico.
En ausencia de una fuente externa de campo magnético, los átomos se dividen espontáneamente en dominios magnéticos, de unos 10 micrómetros de ancho, de modo que los átomos en cada dominio tienen espines paralelos, pero algunos dominios tienen otras orientaciones. Por lo tanto, una pieza macroscópica de hierro tendrá un campo magnético general casi nulo.
La aplicación de un campo magnético externo hace que los dominios que están magnetizados en la misma dirección general crezcan a expensas de los adyacentes que apuntan en otras direcciones, reforzando el campo externo. Este efecto se aprovecha en dispositivos que necesitan canalizar campos magnéticos para cumplir la función de diseño, como transformadores eléctricos, cabezales de grabación magnética y motores eléctricos. Las impurezas, los defectos reticulares o los límites de granos y partículas pueden "fijar" los dominios en las nuevas posiciones, de modo que el efecto persiste incluso después de que se elimine el campo externo, convirtiendo así el objeto de hierro en un imán (permanente).
Algunos compuestos de hierro exhiben un comportamiento similar, como las ferritas, incluido el mineral magnetita, una forma cristalina del óxido mixto de hierro (II, III) Fe3O4 (aunque el mecanismo a escala atómica, el ferrimagnetismo, es algo diferente). Piezas de magnetita con magnetización permanente natural (piedras de imán) proporcionaron las primeras brújulas para la navegación. Las partículas de magnetita se utilizaron ampliamente en medios de grabación magnéticos, como memorias centrales, cintas magnéticas, disquetes y discos, hasta que fueron reemplazadas por materiales a base de cobalto.
Isótopos
El hierro tiene cuatro isótopos estables: 54Fe (5,845 % del hierro natural), 56Fe (91,754 %), 57Fe (2,119 %) y 58 Fe (0,282%). También se han creado 24 isótopos artificiales. De estos isótopos estables, solo 57Fe tiene un espín nuclear (−1⁄2). El nucleido 54Fe teóricamente puede sufrir una captura de doble electrón a 54Cr, pero el proceso nunca se ha observado y solo se ha observado un límite inferior en la vida media de 3,1 × 1022 años.
60Fe es un radionúclido extinto de vida media larga (2,6 millones de años). No se encuentra en la Tierra, pero su último producto de descomposición es su nieta, el nucleido estable 60Ni. Gran parte del trabajo anterior sobre la composición isotópica del hierro se ha centrado en la nucleosíntesis de 60Fe a través de estudios de meteoritos y formación de minerales. En la última década, los avances en espectrometría de masas han permitido la detección y cuantificación de variaciones diminutas que ocurren naturalmente en las proporciones de los isótopos estables de hierro. Gran parte de este trabajo está impulsado por las comunidades científicas terrestres y planetarias, aunque están surgiendo aplicaciones a sistemas biológicos e industriales.
En fases de los meteoritos Semarkona y Chervony Kut, una correlación entre la concentración de 60Ni, la nieta de 60 Fe, y la abundancia de los isótopos estables de hierro proporcionaron evidencia de la existencia de 60Fe en el momento de la formación del Sistema Solar. Posiblemente, la energía liberada por la descomposición del 60Fe, junto con la liberada por el 26Al, contribuyeron a la refundición y diferenciación de los asteroides después de su formación hace 4600 millones de años. La abundancia de 60Ni presente en el material extraterrestre puede aportar más información sobre el origen y la historia temprana del Sistema Solar.
El isótopo de hierro más abundante 56Fe es de particular interés para los científicos nucleares porque representa el punto final más común de la nucleosíntesis. Dado que 56Ni (14 partículas alfa) se produce fácilmente a partir de núcleos más ligeros en el proceso alfa en reacciones nucleares en supernovas (ver proceso de combustión de silicio), es el punto final de las cadenas de fusión dentro de estrellas extremadamente masivas, ya que la adición de otra partícula alfa, que da como resultado 60Zn, requiere mucha más energía. Este 56Ni, que tiene una vida media de unos 6 días, se crea en cantidad en estas estrellas, pero pronto se desintegra mediante dos emisiones sucesivas de positrones dentro de los productos de desintegración de la supernova en la nube de gas remanente de la supernova, primero a 56Co radiactivo, y luego a 56Fe estable. Como tal, el hierro es el elemento más abundante en el núcleo de las gigantes rojas y es el metal más abundante en los meteoritos de hierro y en los núcleos metálicos densos de planetas como la Tierra. También es muy común en el universo, en relación con otros metales estables de aproximadamente el mismo peso atómico. El hierro es el sexto elemento más abundante en el universo y el elemento refractario más común.
Aunque se podría extraer una pequeña ganancia de energía adicional sintetizando 62Ni, que tiene una energía de enlace marginalmente más alta que 56Fe, las condiciones en las estrellas no son adecuadas para este proceso. La producción de elementos en las supernovas favorece mucho al hierro sobre el níquel y, en cualquier caso, el 56Fe todavía tiene una masa por nucleón más baja que el 62Ni debido a su mayor fracción de protones más ligeros. Por lo tanto, los elementos más pesados que el hierro requieren una supernova para su formación, lo que implica la captura rápida de neutrones al iniciar núcleos de 56Fe.
En el futuro lejano del universo, suponiendo que no se produzca la descomposición de los protones, la fusión fría que se produce a través de un túnel cuántico haría que los núcleos ligeros de la materia ordinaria se fusionaran en núcleos de 56Fe. La fisión y la emisión de partículas alfa harían que los núcleos pesados se descompusieran en hierro, convirtiendo todos los objetos de masa estelar en frías esferas de hierro puro.
Origen y presencia en la naturaleza
Cosmogénesis
La abundancia de hierro en planetas rocosos como la Tierra se debe a su abundante producción durante la fusión y explosión descontroladas de supernovas de tipo Ia, que dispersan el hierro en el espacio.
Hierro metálico
El hierro nativo o metálico rara vez se encuentra en la superficie de la Tierra porque tiende a oxidarse. Sin embargo, se cree que tanto el núcleo interno como el externo de la Tierra, que representan el 35% de la masa de toda la Tierra, consisten en gran parte en una aleación de hierro, posiblemente con níquel. Se cree que las corrientes eléctricas en el núcleo externo líquido son el origen del campo magnético de la Tierra. Se cree que los otros planetas terrestres (Mercurio, Venus y Marte), así como la Luna, tienen un núcleo metálico que consiste principalmente en hierro. También se cree que los asteroides de tipo M están hechos en parte o en su mayoría de una aleación de hierro metálico.
Los raros meteoritos de hierro son la principal forma de hierro metálico natural en la superficie de la Tierra. En varios yacimientos arqueológicos se han encontrado piezas de hierro meteorítico trabajado en frío que datan de una época en la que aún no se había desarrollado la fundición del hierro; y se ha informado que los inuit en Groenlandia usan hierro del meteorito de Cape York para herramientas y armas de caza. Aproximadamente 1 de cada 20 meteoritos consiste en los minerales únicos de hierro y níquel taenita (35 a 80% de hierro) y kamacita (90 a 95% de hierro). El hierro nativo también se encuentra raramente en los basaltos que se han formado a partir de magmas que han entrado en contacto con rocas sedimentarias ricas en carbono, que han reducido la fugacidad del oxígeno lo suficiente como para que el hierro cristalice. Esto se conoce como hierro telúrico y se describe en algunas localidades, como la isla Disko en el oeste de Groenlandia, Yakutia en Rusia y Bühl en Alemania.
Minerales del manto
Ferropericlasa (Mg,Fe)O, una solución sólida de periclasa (MgO) y wüstita (FeO), constituye aproximadamente el 20 % del volumen del manto inferior de la Tierra, lo que la convierte en la segunda fase mineral más abundante en esa región después de la perovskita de silicato (Mg,Fe)SiO3; también es el principal huésped de hierro en el manto inferior. En la parte inferior de la zona de transición del manto, la reacción γ-(Mg,Fe)2[SiO4] ↔ (Mg,Fe)[SiO3] + (Mg,Fe)O transforma la γ-olivina en una mezcla de perovskita de silicato y ferropericlasa y viceversa. En la literatura, esta fase mineral del manto inferior también suele denominarse magnesiowüstita. La perovskita de silicato puede formar hasta el 93 % del manto inferior y la forma de hierro y magnesio, (Mg,Fe)SiO3, es considerado el mineral más abundante en la Tierra, representando el 38% de su volumen.
La corteza terrestre
Si bien el hierro es el elemento más abundante en la Tierra, la mayor parte de este hierro se concentra en los núcleos interno y externo. La fracción de hierro que se encuentra en la corteza terrestre solo representa alrededor del 5% de la masa total de la corteza y, por lo tanto, es solo el cuarto elemento más abundante en esa capa (después del oxígeno, el silicio y el aluminio).
La mayor parte del hierro de la corteza se combina con varios otros elementos para formar muchos minerales de hierro. Una clase importante son los minerales de óxido de hierro como la hematita (Fe2O3), magnetita (Fe3O4) y siderita (FeCO3), que son los principales minerales de hierro. Muchas rocas ígneas también contienen los minerales de sulfuro pirrotita y pentlandita. Durante la meteorización, el hierro tiende a lixiviarse de los depósitos de sulfuro como sulfato y de los depósitos de silicato como bicarbonato. Ambos se oxidan en solución acuosa y precipitan incluso con un pH levemente elevado como óxido de hierro (III).
Los grandes depósitos de hierro son formaciones de hierro en bandas, un tipo de roca que consta de capas delgadas repetidas de óxidos de hierro que se alternan con bandas de pizarra y pedernal pobres en hierro. Las formaciones de bandas de hierro se establecieron en el tiempo entre hace 3700 millones de años y hace 1800 millones de años.
Los materiales que contienen óxidos u óxidos de hidróxidos de hierro (III) finamente triturados, como el ocre, se han utilizado como pigmentos amarillos, rojos y marrones desde tiempos prehistóricos. Contribuyen también al color de varias rocas y arcillas, incluidas formaciones geológicas enteras como Painted Hills en Oregón y Buntsandstein ("arenisca coloreada", British Bunter). A través de Eisensandstein (una 'arenisca de hierro' del Jurásico, por ejemplo, de Donzdorf en Alemania) y la piedra de Bath en el Reino Unido, los compuestos de hierro son responsables del color amarillento de muchos edificios históricos y esculturas. El proverbial color rojo de la superficie de Marte se deriva de un regolito rico en óxido de hierro.
En la pirita mineral de sulfuro de hierro (FeS2) se encuentran cantidades significativas de hierro, pero es difícil extraer hierro de ella y, por lo tanto, no se explota. De hecho, el hierro es tan común que la producción generalmente se enfoca solo en minerales con cantidades muy altas.
Según el informe Existencias de metales en la sociedad del Panel Internacional de Recursos, la existencia mundial de hierro en uso en la sociedad es de 2200 kg per cápita. Los países más desarrollados difieren en este aspecto de los países menos desarrollados (7000–14 000 frente a 2000 kg per cápita).
Océanos
La ciencia oceánica demostró el papel del hierro en los mares antiguos tanto en la biota marina como en el clima.
Química y compuestos
| Oxidación estado | compuesto por representantes |
|---|---|
| −2 d10) | Disodium tetracarbonylferrate (Reactivo del Collman) |
| −1 d9) | Fe 2(CO)2 - 2 8 |
| 0 (d8) | Iron pentacarbonyl |
| 1 d7) | Cyclopentadienyliron dicarbonyl dimer ("Fp2") |
| 2 d6) | Sulfato ferroso, ferroceno |
| 3 d5) | Cloruro férrico, tetrafluoroborate de ferroceno |
| 4 d4) | Fe(diars) 2Cl2+ 2, Ferryl tetrafluoroborate |
| 5 d3) | Feo3 - 3 4 |
| 6 d2) | Ferrate de potasio |
| 7 d1) | [FeO4]– (Aislamiento de la matriz, 4K) |
El hierro muestra las propiedades químicas características de los metales de transición, a saber, la capacidad de formar estados de oxidación variables que difieren por pasos de uno y una gran coordinación y química organometálica: de hecho, fue el descubrimiento de un compuesto de hierro, el ferroceno, que revolucionó este último campo en la década de 1950. El hierro a veces se considera como un prototipo para todo el bloque de metales de transición, debido a su abundancia y al inmenso papel que ha jugado en el progreso tecnológico de la humanidad. Sus 26 electrones están dispuestos en la configuración [Ar]3d64s2, de los cuales los electrones 3d y 4s tienen una energía relativamente cercana y, por lo tanto, puede perder una variable número de electrones y no hay un punto claro en el que una mayor ionización no sea rentable.
El hierro forma compuestos principalmente en los estados de oxidación +2 (hierro(II), "ferroso") y +3 (hierro(III), "férrico"). El hierro también se presenta en estados de oxidación más altos, p. el ferrato de potasio púrpura (K2FeO4), que contiene hierro en su estado de oxidación +6. Aunque se ha reclamado óxido de hierro (VIII) (FeO4), el informe no se pudo reproducir y tal especie de la eliminación de todos los electrones del elemento más allá de la configuración de gas inerte anterior (al menos con hierro en su estado de oxidación +8) se ha encontrado que es improbable computacionalmente. Sin embargo, una forma de [FeO4]– aniónico con hierro en su estado de oxidación +7, junto con un isómero de hierro (V)-peroxo, ha sido detectada por infrarrojos. espectroscopia a 4 K tras cocondensación de átomos de Fe ablacionados con láser con una mezcla de O2/Ar. El hierro (IV) es un intermediario común en muchas reacciones bioquímicas de oxidación. Numerosos compuestos orgánicos de hierro contienen estados de oxidación formales de +1, 0, -1 o incluso -2. Los estados de oxidación y otras propiedades de unión a menudo se evalúan utilizando la técnica de espectroscopia de Mössbauer. Muchos compuestos de valencia mixta contienen centros de hierro (II) y hierro (III), como magnetita y azul de Prusia (Fe4(Fe[CN]6)3). Este último se utiliza como el tradicional "azul" en planos.
El hierro es el primero de los metales de transición que no puede alcanzar su estado de oxidación de grupo de +8, aunque sus congéneres más pesados, el rutenio y el osmio, sí pueden, teniendo el rutenio más dificultades que el osmio. El rutenio exhibe una química catiónica acuosa en sus bajos estados de oxidación similar a la del hierro, pero el osmio no, lo que favorece estados de oxidación altos en los que forma complejos aniónicos. En la segunda mitad de la serie de transición 3d, las similitudes verticales de los grupos compiten con las similitudes horizontales del hierro con sus vecinos cobalto y níquel en la tabla periódica, que también son ferromagnéticos a temperatura ambiente y comparten una química similar. Como tal, el hierro, el cobalto y el níquel a veces se agrupan como la tríada de hierro.
A diferencia de muchos otros metales, el hierro no forma amalgamas con el mercurio. Como resultado, el mercurio se comercializa en frascos estandarizados de 76 libras (34 kg) hechos de hierro.
El hierro es, con diferencia, el elemento más reactivo de su grupo; es pirofórico cuando está finamente dividido y se disuelve fácilmente en ácidos diluidos, dando Fe2+. Sin embargo, no reacciona con el ácido nítrico concentrado y otros ácidos oxidantes debido a la formación de una capa de óxido impermeable que, sin embargo, puede reaccionar con el ácido clorhídrico. El hierro de alta pureza, llamado hierro electrolítico, se considera resistente a la oxidación, debido a su capa de óxido.
Compuestos binarios
Óxidos y sulfuros
El hierro forma varios compuestos de óxido e hidróxido; los más comunes son el óxido de hierro (II, III) (Fe3O4) y el óxido de hierro (III) (Fe2O3). También existe el óxido de hierro (II), aunque es inestable a temperatura ambiente. A pesar de sus nombres, en realidad todos son compuestos no estequiométricos cuyas composiciones pueden variar. Estos óxidos son los principales minerales para la producción de hierro (ver bloomery y alto horno). También se utilizan en la producción de ferritas, medios de almacenamiento magnético útiles en computadoras y pigmentos. El sulfuro más conocido es la pirita de hierro (FeS2), también conocida como oro de los tontos debido a su brillo dorado. No es un compuesto de hierro (IV), pero en realidad es un polisulfuro de hierro (II) que contiene Fe2+ y S2−
2 iones en una estructura distorsionada de cloruro de sodio.
Haluros
Los haluros ferrosos y férricos binarios son bien conocidos. Los haluros ferrosos normalmente surgen del tratamiento del metal de hierro con el ácido hidrohálico correspondiente para dar las sales hidratadas correspondientes.
- Fe + 2 HX → FeX2 + H2 (X = F, Cl, Br, I)
El hierro reacciona con el flúor, el cloro y el bromo para dar los haluros férricos correspondientes, siendo el cloruro férrico el más común.
- 2 Fe + 3 X2 → 2 FeX3 (X = F, Cl, Br)
El yoduro férrico es una excepción, siendo termodinámicamente inestable debido al poder oxidante del Fe3+ y al alto poder reductor del I−:
- 2 I− + 2 Fe3+ → I2 + 2 Fe2+ (E)0 = +0,23 V)
El yoduro férrico, un sólido negro, no es estable en condiciones ordinarias, pero se puede preparar mediante la reacción del pentacarbonilo de hierro con yodo y monóxido de carbono en presencia de hexano y luz a la temperatura de -20 °C, con oxígeno y agua excluida. Se sabe que los complejos de yoduro férrico con algunas bases blandas son compuestos estables.
Química de la solución
Los potenciales de reducción estándar en solución acuosa ácida para algunos iones de hierro comunes se dan a continuación:
| Fe2+ + 2 e− | ⇌ Fe | E0 = 0,447 V |
| Fe3+ + e− | ⇌ Fe2+ | E0 = +0,77 V |
| Feo2 - 2 4 + 8 H+ + 3 e− | ⇌ Fe3+ + 4 H2O | E0 = +2.20 V |
El anión tetraédrico rojo-púrpura ferrato (VI) es un agente oxidante tan fuerte que oxida el nitrógeno y el amoníaco a temperatura ambiente, e incluso el agua en soluciones ácidas o neutras:
- 4 Feo2 - 2
4 + 10 H
2O → 4 Fe3+
+ 20 Oh.−
+ 3 O2
El ion Fe3+ tiene una gran química catiónica simple, aunque el ion hexaquo violeta pálido [Fe(H2O)6]3+ se hidroliza muy fácilmente cuando el pH aumenta por encima 0 de la siguiente manera:
| [Fe(H)2O)6]3+ | ⇌ [Fe(H)2O)5(OH)]2+ + H+ | K = 10−3.05 mol dm−3 |
| [Fe(H)2O)5(OH)]2+ | ⇌ [Fe(H)2O)4(OH)2]+ + H+ | K = 10−3.26 mol dm−3 |
| 2[Fe(H)2O)6]3+ | ⇌ [Fe(H)2O)4(OH)]4+2 + 2H+ + 2H2O | K = 10−2.91 mol dm−3 |
A medida que el pH sube por encima de 0, se forman las especies hidrolizadas amarillas anteriores y, cuando sube por encima de 2–3, el óxido de hierro (III) hidratado de color marrón rojizo precipita fuera de la solución. Aunque el Fe3+ tiene una configuración d5, su espectro de absorción no es como el del Mn2+ con su d débil y con espín prohibido. bandas d, porque Fe3+ tiene una carga positiva más alta y es más polarizante, lo que reduce la energía de sus absorciones de transferencia de carga de ligando a metal. Por lo tanto, todos los complejos anteriores tienen un color bastante fuerte, con la única excepción del ion hexaquo, e incluso ese tiene un espectro dominado por la transferencia de carga en la región ultravioleta cercana. Por otro lado, el ion hexaquo de hierro (II) verde pálido [Fe(H2O)6]2+ no sufre una hidrólisis apreciable. El dióxido de carbono no se desprende cuando se añaden aniones de carbonato, lo que da como resultado la precipitación de carbonato de hierro (II) blanco. En exceso de dióxido de carbono se forma el bicarbonato ligeramente soluble, que ocurre comúnmente en el agua subterránea, pero se oxida rápidamente en el aire para formar óxido de hierro (III) que explica los depósitos marrones presentes en un número considerable de corrientes.
Compuestos de coordinación
Debido a su estructura electrónica, el hierro tiene una gran coordinación y química organometálica.
Se conocen muchos compuestos de coordinación del hierro. Un anión típico de seis coordenadas es el hexacloroferrato (III), [FeCl6]3−, que se encuentra en el cloruro de hexacloroferrato (III) de tetrakis (metilamonio) de sal mixta. Los complejos con múltiples ligandos bidentados tienen isómeros geométricos. Por ejemplo, el complejo trans-clorohidridobis(bis-1,2-(difenilfosfino)etano)hierro(II) se utiliza como material de partida para compuestos con el Resto Fe(dppe)2. El ion ferrioxalato con tres ligandos de oxalato (que se muestra a la derecha) muestra quiralidad helicoidal con sus dos geometrías no superponibles etiquetadas como Λ (lambda) para el eje del tornillo zurdo y Δ (delta) para el eje del tornillo a la derecha, en línea con las convenciones de la IUPAC. El ferrioxalato de potasio se usa en actinometría química y, junto con su sal de sodio, se somete a fotorreducción aplicada en procesos fotográficos antiguos. El dihidrato de oxalato de hierro (II) tiene una estructura polimérica con iones de oxalato coplanares que forman puentes entre los centros de hierro con el agua de cristalización ubicada formando las tapas de cada octaedro, como se ilustra a continuación.
Los complejos de hierro (III) son bastante similares a los de cromo (III) con la excepción de la preferencia del hierro (III) por el donante O en lugar de N-ligandos donantes. Estos últimos tienden a ser bastante más inestables que los complejos de hierro (II) y, a menudo, se disocian en agua. Muchos complejos de Fe-O muestran colores intensos y se usan como pruebas para fenoles o enoles. Por ejemplo, en la prueba del cloruro férrico, utilizada para determinar la presencia de fenoles, el cloruro de hierro (III) reacciona con un fenol para formar un complejo de color violeta intenso:
- 3 ArOH + FeCl3 → Fe(OAr)3 + 3 HCl (Ar = aryl)
Entre los complejos de haluros y pseudohaluros, los complejos de flúor de hierro (III) son los más estables, con el [FeF5(H2O)] incoloro2− siendo el más estable en solución acuosa. Los complejos de cloro son menos estables y favorecen la coordinación tetraédrica como en [FeCl4]−; [FeBr4]− y [FeI4]− se reducen fácilmente a hierro (II). El tiocianato es una prueba común para la presencia de hierro (III) ya que forma el [Fe(SCN)(H2O)5]2 de color rojo sangre +. Al igual que el manganeso (II), la mayoría de los complejos de hierro (III) son de espín alto, con la excepción de aquellos con ligandos altos en la serie espectroquímica, como el cianuro. Un ejemplo de un complejo de hierro (III) de espín bajo es [Fe(CN)6]3−. Los ligandos de cianuro pueden separarse fácilmente en [Fe(CN)6]3− y, por lo tanto, este complejo es venenoso, a diferencia del complejo de hierro (II) [Fe(CN)6]4− encontrado en el azul de Prusia, que no libera cianuro de hidrógeno excepto cuando se agregan ácidos diluidos. El hierro muestra una gran variedad de estados de espín electrónico, incluidos todos los valores de números cuánticos de espín posibles para un elemento del bloque d desde 0 (diamagnético) hasta 5⁄2 (5 electrones desapareados). Este valor es siempre la mitad del número de electrones desapareados. Los complejos con cero a dos electrones desapareados se consideran de espín bajo y los que tienen cuatro o cinco se consideran de espín alto.
Los complejos de hierro(II) son menos estables que los complejos de hierro(III), pero la preferencia por los ligandos donantes de O es menos marcada, por lo que, por ejemplo, [ Fe(NH3)6]2+ se conoce mientras que [Fe(NH3)6]3+ no lo es. Tienen tendencia a oxidarse a hierro (III), pero esto puede ser moderado por un pH bajo y los ligandos específicos utilizados.
Compuestos organometálicos
La química del organohierro es el estudio de los compuestos organometálicos del hierro, en los que los átomos de carbono están unidos covalentemente al átomo metálico. Son muchos y variados, incluidos los complejos de cianuro, los complejos de carbonilo, los compuestos tipo sándwich y medio sándwich.
El azul de Prusia o "ferrocianuro férrico", Fe4[Fe(CN)6]3, es un antiguo y bien conocido complejo de cianuro de hierro, ampliamente utilizado como pigmento y en varias otras aplicaciones. Su formación se puede utilizar como una prueba simple de química húmeda para distinguir entre soluciones acuosas de Fe2+ y Fe3+ cuando reaccionan (respectivamente) con ferricianuro de potasio y ferrocianuro de potasio. para formar azul de Prusia.
Otro ejemplo antiguo de un compuesto de organohierro es el pentacarbonilo de hierro, Fe(CO)5, en el que un átomo de hierro neutro está unido a los átomos de carbono de cinco moléculas de monóxido de carbono. El compuesto se puede usar para hacer polvo de carbonil hierro, una forma altamente reactiva de hierro metálico. La termólisis del pentacarbonilo de hierro da trihierro dodecacarbonilo, Fe3(CO) 12, un complejo con un grupo de tres átomos de hierro en su núcleo. El reactivo de Collman, el tetracarbonilferrato disódico, es un reactivo útil para la química orgánica; contiene hierro en el estado de oxidación −2. El dímero de dicarbonilo de ciclopentadieniliron contiene hierro en el raro estado de oxidación +1.
Un hito en este campo fue el descubrimiento en 1951 del compuesto sándwich ferroceno notablemente estable Fe(C5H 5)2, por Pauson y Kealy e independientemente por Miller y colegas, cuya sorprendente estructura molecular fue determinada solo un año después por Woodward y Wilkinson y Fischer. El ferroceno sigue siendo una de las herramientas y modelos más importantes de esta clase.
Especies organometálicas centradas en hierro se utilizan como catalizadores. El complejo de Knölker, por ejemplo, es un catalizador de hidrogenación de transferencia para cetonas.
Usos industriales
Los compuestos de hierro producidos a mayor escala en la industria son el sulfato de hierro(II) (FeSO4·7H2O) y el cloruro de hierro(III) (FeCl3). La primera es una de las fuentes de hierro (II) más disponibles, pero es menos estable a la oxidación aérea que la sal de Mohr ((NH4)2Fe(SO4)2·6H2O). Los compuestos de hierro (II) tienden a oxidarse a compuestos de hierro (III) en el aire.
Historia
Desarrollo de la metalurgia del hierro
El hierro es uno de los elementos sin duda conocidos por el mundo antiguo. Se ha trabajado, o forjado, durante milenios. Sin embargo, los artefactos de hierro de gran antigüedad son mucho más raros que los objetos hechos de oro o plata debido a la facilidad con la que se corroe el hierro. La tecnología se desarrolló lentamente, e incluso después del descubrimiento de la fundición, se necesitaron muchos siglos para que el hierro reemplazara al bronce como el metal elegido para herramientas y armas.
Hierro meteorítico
G.A. Wainwright. Las cuentas contienen un 7,5 % de níquel, que es una firma de origen meteórico, ya que el hierro que se encuentra en la corteza terrestre generalmente tiene solo minúsculas impurezas de níquel.
El hierro meteórico era muy apreciado debido a su origen en los cielos y se usaba a menudo para forjar armas y herramientas. Por ejemplo, se encontró una daga hecha de hierro meteórico en la tumba de Tutankamón, que contenía proporciones similares de hierro, cobalto y níquel a un meteorito descubierto en el área, depositado por una antigua lluvia de meteoritos. Los artículos que probablemente los egipcios fabricaron con hierro datan del 3000 al 2500 a. C.
El hierro meteorítico es comparativamente suave y dúctil y se forja fácilmente en frío, pero puede volverse quebradizo cuando se calienta debido al contenido de níquel.
Hierro forjado
La primera producción de hierro comenzó en la Edad del Bronce Medio, pero pasaron varios siglos antes de que el hierro desplazara al bronce. Las muestras de hierro fundido de Asmar, Mesopotamia y Tall Chagar Bazaar en el norte de Siria se hicieron en algún momento entre el 3000 y el 2700 a. C. Los hititas establecieron un imperio en el centro-norte de Anatolia alrededor del 1600 a. Parecen ser los primeros en comprender la producción de hierro a partir de sus minerales y lo consideran muy bien en su sociedad. Los hititas comenzaron a fundir hierro entre 1500 y 1200 a. C. y la práctica se extendió al resto del Cercano Oriente después de la caída de su imperio en 1180 a. El período posterior se llama la Edad del Hierro.
Se han encontrado artefactos de hierro fundido en la India que datan de 1800 a 1200 a. C., y en el Levante desde alrededor de 1500 a. C. (lo que sugiere una fundición en Anatolia o el Cáucaso). Las supuestas referencias (compárese la historia de la metalurgia en el sur de Asia) al hierro en los Vedas indios se han utilizado para afirmar un uso muy temprano del hierro en la India, respectivamente, para fechar los textos como tales. El término rigveda ayas (metal) se refiere al cobre, mientras que el hierro, que se denomina śyāma ayas, literalmente "cobre negro", se menciona por primera vez en el Atharvaveda posrigvédico.
Alguna evidencia arqueológica sugiere que el hierro se fundió en Zimbabue y el sureste de África ya en el siglo VIII a. El trabajo del hierro se introdujo en Grecia a finales del siglo XI a. C., desde donde se extendió rápidamente por toda Europa.
La expansión del trabajo del hierro en Europa central y occidental está asociada con la expansión celta. Según Plinio el Viejo, el uso del hierro era común en la época romana. En las tierras de lo que ahora se considera China, el hierro aparece aproximadamente entre el 700 y el 500 a. C. Es posible que la fundición de hierro se haya introducido en China a través de Asia Central. La evidencia más temprana del uso de un alto horno en China data del siglo I d. C., y los hornos de cúpula se usaron ya en el período de los Reinos Combatientes (403–221 a. C.). El uso del alto horno y la cúpula se mantuvo generalizado durante las dinastías Tang y Song.
Durante la Revolución Industrial en Gran Bretaña, Henry Cort comenzó a refinar hierro desde arrabio hasta hierro forjado (o barra de hierro) utilizando sistemas de producción innovadores. En 1783 patentó el proceso de charcos para refinar el mineral de hierro. Más tarde fue mejorado por otros, incluido Joseph Hall.
Hierro fundido
El hierro fundido se produjo por primera vez en China durante el siglo V a. C., pero apenas estuvo en Europa hasta la época medieval. Los primeros artefactos de hierro fundido fueron descubiertos por arqueólogos en lo que ahora es el moderno condado de Luhe, Jiangsu en China. El hierro fundido se usaba en la antigua China para la guerra, la agricultura y la arquitectura. Durante el período medieval, se encontraron medios en Europa para producir hierro forjado a partir de hierro fundido (en este contexto conocido como arrabio) utilizando forjas finas. Para todos estos procesos se requería carbón vegetal como combustible.
Los altos hornos medievales tenían unos 3 m (10 pies) de altura y estaban hechos de ladrillos resistentes al fuego; el aire forzado generalmente se proporcionaba mediante fuelles manuales. Los altos hornos modernos se han vuelto mucho más grandes, con hogares de catorce metros de diámetro que les permiten producir miles de toneladas de hierro cada día, pero esencialmente funcionan de la misma manera que en la época medieval.
En 1709, Abraham Darby I estableció un alto horno alimentado con coque para producir hierro fundido, en sustitución del carbón vegetal, aunque siguió utilizando altos hornos. La consiguiente disponibilidad de hierro barato fue uno de los factores que llevaron a la Revolución Industrial. Hacia fines del siglo XVIII, el hierro fundido comenzó a reemplazar al hierro forjado para ciertos usos, porque era más económico. El contenido de carbono en el hierro no estuvo implicado como la razón de las diferencias en las propiedades del hierro forjado, el hierro fundido y el acero hasta el siglo XVIII.
Dado que el hierro se estaba volviendo más barato y más abundante, también se convirtió en un material estructural importante luego de la construcción del innovador primer puente de hierro en 1778. Este puente sigue en pie hoy como un monumento al papel que desempeñó el hierro en la Revolución Industrial. Posteriormente, el hierro se usó en rieles, botes, barcos, acueductos y edificios, así como en cilindros de hierro en máquinas de vapor. Los ferrocarriles han sido fundamentales para la formación de la modernidad y las ideas de progreso y varios idiomas (por ejemplo, francés, español, italiano y alemán) se refieren a los ferrocarriles como camino de hierro.
Acero
El acero (con un contenido de carbono menor que el arrabio pero más que el hierro forjado) se produjo por primera vez en la antigüedad mediante el uso de un bloomery. Los herreros de Luristán, en el oeste de Persia, fabricaban buen acero hacia el año 1000 a. C. Luego, se desarrollaron versiones mejoradas, el acero Wootz de la India y el acero de Damasco alrededor del 300 a. C. y el 500 d. C., respectivamente. Estos métodos eran especializados, por lo que el acero no se convirtió en un producto importante hasta la década de 1850.
En el siglo XVII se idearon nuevos métodos para producirlo mediante la cementación de barras de hierro en el proceso de cementación. En la Revolución Industrial, se idearon nuevos métodos para producir barras de hierro sin carbón, que luego se aplicaron para producir acero. A fines de la década de 1850, Henry Bessemer inventó un nuevo proceso de fabricación de acero que consistía en soplar aire a través de arrabio fundido para producir acero dulce. Esto hizo que el acero fuera mucho más económico, lo que provocó que el hierro forjado ya no se produjera en grandes cantidades.
Fundamentos de la química moderna
En 1774, Antoine Lavoisier utilizó la reacción del vapor de agua con hierro metálico dentro de un tubo de hierro incandescente para producir hidrógeno en sus experimentos que condujeron a la demostración de la conservación de la masa, que fue fundamental para cambiar la química de una ciencia cualitativa a una uno cuantitativo.
Función simbólica
El hierro juega un cierto papel en la mitología y ha encontrado varios usos como metáfora y en el folclore. Los Trabajos y días del poeta griego Hesíodo (líneas 109–201) enumeran diferentes edades del hombre con nombres de metales como el oro, la plata, el bronce y el hierro para dar cuenta de las sucesivas edades de la humanidad. La Edad del Hierro estaba estrechamente relacionada con Roma, y en las Metamorfosis de Ovidio
Los Virtudes, desesperados, abandonan la tierra; y la depravación del hombre se vuelve universal y completa. El acero duro tuvo éxito entonces.
—Ovid, Metamorfosis, Libro I, Edad de hierro, línea 160 ff
Un ejemplo de la importancia del papel simbólico del hierro se puede encontrar en la campaña alemana de 1813. Federico Guillermo III encargó entonces la primera Cruz de Hierro como condecoración militar. La joyería de hierro de Berlín alcanzó su punto máximo de producción entre 1813 y 1815, cuando la familia real prusiana instó a los ciudadanos a donar joyas de oro y plata para la financiación militar. La inscripción Gold gab ich für Eisen (Di oro por hierro) también se usó en esfuerzos de guerra posteriores.
Producción de hierro metálico
Rutas de laboratorio
Para algunos propósitos limitados cuando es necesario, el hierro puro se produce en el laboratorio en pequeñas cantidades reduciendo el óxido o hidróxido puro con hidrógeno, o formando pentacarbonilo de hierro y calentándolo a 250 °C para que se descomponga y forme polvo de hierro puro. Otro método es la electrólisis de cloruro ferroso sobre un cátodo de hierro.
Ruta industrial principal
| País | Iron ore | Plancha de hierro | Hierro directo | Acero |
|---|---|---|---|---|
| 1.114.9 | 549.4 | 573.6 | ||
| 393.9 | 4.4 | 5.2 | ||
| 30,0 | 25.1 | 0,011 | 26,5 | |
| 66,9 | 87,5 | |||
| 257.4 | 38.2 | 23.4 | 63,5 | |
| 92.1 | 43.9 | 4.7 | 60.0 | |
| 65.8 | 25.7 | 29.9 | ||
| 0.1 | 27.3 | 48.6 | ||
| 0,4 | 20.1 | 0,38 | 32.7 | |
| Mundo | 1,594,9 | 914.0 | 64,5 | 1.232,4 |
Hoy en día, la producción industrial de hierro o acero consta de dos etapas principales. En la primera etapa, el mineral de hierro se reduce con coque en un alto horno y el metal fundido se separa de las impurezas gruesas, como los minerales de silicato. Esta etapa produce una aleación, arrabio, que contiene cantidades relativamente grandes de carbono. En la segunda etapa, la cantidad de carbono en el arrabio se reduce por oxidación para producir hierro forjado, acero o hierro fundido. Se pueden agregar otros metales en esta etapa para formar aceros aleados.
Procesamiento en alto horno
El alto horno se carga con minerales de hierro, generalmente hematita Fe2O3 o magnetita Fe3O4, junto con coque (carbón que se ha horneado por separado para eliminar los componentes volátiles) y fundente (piedra caliza o dolomita). "Explosiones" de aire precalentado a 900 °C (a veces con oxígeno enriquecido) se sopla a través de la mezcla, en cantidad suficiente para convertir el carbono en monóxido de carbono:
- 2 CO}}}" xmlns="http://www.w3.org/1998/Math/MathML">2C+O2restablecimiento restablecimiento 2CO{displaystyle {ce {2 C + O2} 2 CO}}}
2 CO}}}" aria-hidden="true" class="mwe-math-fallback-image-inline" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/6a08fa443a8bbb0b73a3296e72f9cb4eeed8f242" style="vertical-align: -1.005ex; width:19.062ex; height:2.843ex;"/>
Esta reacción eleva la temperatura a unos 2000 °C. El monóxido de carbono reduce el mineral de hierro a hierro metálico.
- 2 Fe + 3 CO2}}}" xmlns="http://www.w3.org/1998/Math/MathML">Fe2O3+3COrestablecimiento restablecimiento 2Fe+3CO2{displaystyle {ce {Fe2O3 + 3 CO - titulada 2 Fe + 3 CO2}}
2 Fe + 3 CO2}}}" aria-hidden="true" class="mwe-math-fallback-image-inline" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/7e73b85a60f0d9f95f49255ca9a1f82605419331" style="vertical-align: -1.005ex; width:32.469ex; height:2.843ex;"/>
Algo de hierro en la región inferior de alta temperatura del horno reacciona directamente con el coque:
- 4Fe + 3CO2}}}" xmlns="http://www.w3.org/1998/Math/MathML">2Fe2O3+3Crestablecimiento restablecimiento 4Fe+3CO2{displaystyle {ce {2Fe2O3 + 3C - titulada 4Fe + 3CO2}}}
4Fe + 3CO2}}}" aria-hidden="true" class="mwe-math-fallback-image-inline" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/f48752473973ce8b21bd34db10ddeedea6072d35" style="vertical-align: -1.005ex; width:32.21ex; height:2.843ex;"/>
El fundente elimina los minerales silíceos del mineral, que de otro modo obstruirían el horno: el calor del horno descompone los carbonatos en óxido de calcio, que reacciona con cualquier exceso de sílice para formar una escoria compuesta de silicato de calcio CaSiO3 u otros productos. A la temperatura del horno, tanto el metal como la escoria están fundidos. Se acumulan en el fondo como dos capas líquidas inmiscibles (con la escoria en la parte superior), que luego se separan fácilmente. La escoria se puede utilizar como material en la construcción de carreteras o para mejorar los suelos pobres en minerales para la agricultura.
La fabricación de acero sigue siendo uno de los mayores contribuyentes industriales de emisiones de CO2 en el mundo.
Fabricación de acero
El arrabio producido por el proceso de alto horno contiene hasta un 4-5 % de carbono (en masa), con pequeñas cantidades de otras impurezas como azufre, magnesio, fósforo y manganeso. Este alto nivel de carbono lo hace relativamente débil y quebradizo. La reducción de la cantidad de carbono a 0,002–2,1 % produce acero, que puede ser hasta 1000 veces más duro que el hierro puro. Se puede fabricar una gran variedad de artículos de acero mediante trabajo en frío, laminado en caliente, forjado, mecanizado, etc. La eliminación de las impurezas del arrabio, pero dejando entre un 2% y un 4% de carbono, da como resultado el hierro fundido, que las fundiciones transforman en artículos. como estufas, tuberías, radiadores, farolas y rieles.
Los productos de acero a menudo se someten a varios tratamientos térmicos después de que se forjan para darles forma. El recocido consiste en calentarlos a 700-800 °C durante varias horas y luego enfriarlos gradualmente. Hace que el acero sea más blando y manejable.
Reducción directa de hierro
Debido a preocupaciones ambientales, se han desarrollado métodos alternativos de procesamiento de hierro. "Reducción directa de hierro" reduce el mineral de hierro a un bulto ferroso llamado "esponja" hierro o "directo" hierro que es adecuado para la fabricación de acero. Dos reacciones principales comprenden el proceso de reducción directa:
El gas natural se oxida parcialmente (con calor y un catalizador):
- 2 CO + 4 H2}}}" xmlns="http://www.w3.org/1998/Math/MathML">2CH4+O2restablecimiento restablecimiento 2CO+4H2{displaystyle {ce {2 CH4 + O2 - titulada 2 CO + 4 H2}}
2 CO + 4 H2}}}" aria-hidden="true" class="mwe-math-fallback-image-inline" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/ae01cdb44cf6bdde0b53d5846145ca36aebced5b" style="vertical-align: -1.005ex; width:29.047ex; height:2.843ex;"/>
El mineral de hierro luego se trata con estos gases en un horno, produciendo hierro esponja sólido:
- 2 Fe + CO2 + 2 H2O}}}" xmlns="http://www.w3.org/1998/Math/MathML">Fe2O3+CO+2H2restablecimiento restablecimiento 2Fe+CO2+2H2O{displaystyle {ce {Fe2O3 + CO + 2 H2 - título 2 Fe + CO2 + 2 H2O}}
2 Fe + CO2 + 2 H2O}}}" aria-hidden="true" class="mwe-math-fallback-image-inline" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/5f8b74e30cfaa662446037515c84fda65948cdb7" style="vertical-align: -1.005ex; width:45.553ex; height:2.843ex;"/>
La sílice se elimina agregando un fundente de piedra caliza como se describe anteriormente.
Proceso termita
La ignición de una mezcla de polvo de aluminio y óxido de hierro produce hierro metálico a través de la reacción de la termita:
- 2 Fe + Al2O3}}}" xmlns="http://www.w3.org/1998/Math/MathML">Fe2O3+2Alrestablecimiento restablecimiento 2Fe+Al2O3{displaystyle {ce {Fe2O3 + 2 Al - titulada 2 Fe + Al2O3}}
2 Fe + Al2O3}}}" aria-hidden="true" class="mwe-math-fallback-image-inline" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/cf92fb33d8c44dcd261741b96d32765d1cfc69ec" style="vertical-align: -1.005ex; width:31.589ex; height:2.843ex;"/>
Alternativamente, el arrabio se puede convertir en acero (con hasta un 2% de carbono) o hierro forjado (hierro comercialmente puro). Se han utilizado varios procesos para esto, incluyendo forjas finas, hornos de charcos, convertidores Bessemer, hornos de solera abierta, hornos de oxígeno básico y hornos de arco eléctrico. En todos los casos, el objetivo es oxidar una parte o la totalidad del carbono, junto con otras impurezas. Por otro lado, se pueden agregar otros metales para hacer aceros aleados.
Aplicaciones
Como material estructural
El hierro es el más utilizado de todos los metales y representa más del 90 % de la producción mundial de metales. Su bajo costo y alta resistencia a menudo lo convierten en el material de elección para resistir el estrés o transmitir fuerzas, como la construcción de maquinaria y máquinas herramienta, rieles, automóviles, cascos de barcos, barras de refuerzo de hormigón y el marco de carga de los edificios. Dado que el hierro puro es bastante blando, lo más común es combinarlo con elementos de aleación para fabricar acero.
Propiedades mecánicas
| Material | TS (MPa) | BH (Brinell) |
|---|---|---|
| Iron whiskers | 11000 | |
| Ausformed (hardened) acero | 2930 | 850–1200 |
| Acero martenítico | 2070 | 600 |
| Acero bainitico | 1380 | 400 |
| Acero perlatico | 1200 | 350 |
| Hierro de trabajo frío | 690 | 200 |
| Hierro de grano pequeño | 340 | 100 |
| Hierro que contiene carbono | 140 | 40 |
| Hierro puro de cristal | 10 | 3 |
Las propiedades mecánicas del hierro y sus aleaciones son extremadamente relevantes para sus aplicaciones estructurales. Esas propiedades se pueden evaluar de varias maneras, incluida la prueba Brinell, la prueba Rockwell y la prueba de dureza Vickers.
Las propiedades del hierro puro se utilizan a menudo para calibrar medidas o comparar pruebas. Sin embargo, las propiedades mecánicas del hierro se ven significativamente afectadas por la pureza de la muestra: los cristales simples de hierro puro son en realidad más blandos que el aluminio, y el hierro más puro producido industrialmente (99,99 %) tiene una dureza de 20-30 Brinell. El hierro puro (99,9 %~99,999 %), especialmente llamado hierro electrolítico, se produce industrialmente mediante refinado electrolítico.
Un aumento en el contenido de carbono provocará un aumento significativo en la dureza y la resistencia a la tracción del hierro. La dureza máxima de 65 Rc se logra con un contenido de carbono del 0,6%, aunque la aleación tiene una baja resistencia a la tracción. Debido a la suavidad del hierro, es mucho más fácil trabajar con él que con sus congéneres más pesados, el rutenio y el osmio.
Tipos de aceros y aleaciones
El hierro α es un metal bastante blando que solo puede disolver una pequeña concentración de carbono (no más del 0,021 % en masa a 910 °C). La austenita (hierro γ) es igualmente blanda y metálica, pero puede disolver una cantidad considerablemente mayor de carbono (hasta un 2,04 % en masa a 1146 °C). Esta forma de hierro se usa en el tipo de acero inoxidable que se usa para fabricar cubiertos y equipos para hospitales y servicios de alimentos.
El hierro disponible comercialmente se clasifica según la pureza y la abundancia de aditivos. El arrabio tiene de 3,5 a 4,5 % de carbono y contiene cantidades variables de contaminantes como azufre, silicio y fósforo. El arrabio no es un producto comercializable, sino un paso intermedio en la producción de hierro fundido y acero. La reducción de contaminantes en el arrabio que afectan negativamente las propiedades del material, como el azufre y el fósforo, produce hierro fundido que contiene entre un 2% y un 4% de carbono, entre un 1% y un 6% de silicio y pequeñas cantidades de manganeso. El arrabio tiene un punto de fusión en el rango de 1420-1470 K, que es más bajo que cualquiera de sus dos componentes principales, y lo convierte en el primer producto que se funde cuando el carbono y el hierro se calientan juntos. Sus propiedades mecánicas varían mucho y dependen de la forma que adopte el carbono en la aleación.
"Blanco" los hierros fundidos contienen su carbono en forma de cementita o carburo de hierro (Fe3C). Este compuesto duro y quebradizo domina las propiedades mecánicas de las fundiciones blancas, haciéndolas duras, pero no resistentes a los golpes. La superficie rota de un hierro fundido blanco está llena de finas facetas del carburo de hierro roto, un material muy pálido, plateado y brillante, de ahí la denominación. El enfriamiento lento de una mezcla de hierro con 0,8 % de carbono por debajo de 723 °C a temperatura ambiente da como resultado capas alternas separadas de cementita y hierro α, que es suave y maleable y se llama perlita por su apariencia. El enfriamiento rápido, por otro lado, no deja tiempo para esta separación y crea martensita dura y quebradiza. Luego, el acero se puede templar recalentándolo a una temperatura intermedia, cambiando las proporciones de perlita y martensita. El producto final por debajo del 0,8% de contenido de carbono es una mezcla de perlita-αFe, y por encima del 0,8% de contenido de carbono es una mezcla de perlita-cementita.
En el hierro gris, el carbono existe como escamas finas de grafito separadas, y también hace que el material se vuelva quebradizo debido a las escamas de grafito con bordes afilados que producen sitios de concentración de tensión dentro del material. Una variante más nueva de hierro gris, conocida como hierro dúctil, se trata especialmente con trazas de magnesio para alterar la forma del grafito a esferoides o nódulos, lo que reduce las concentraciones de tensión y aumenta enormemente la tenacidad y resistencia del material.
El hierro forjado contiene menos del 0,25 % de carbono pero grandes cantidades de escoria que le confieren una característica fibrosa. Es un producto resistente y maleable, pero no tan fusible como el arrabio. Si se perfecciona hasta el borde, se pierde rápidamente. El hierro forjado se caracteriza por la presencia de finas fibras de escoria atrapadas dentro del metal. El hierro forjado es más resistente a la corrosión que el acero. Ha sido reemplazado casi por completo por acero dulce para el tradicional "hierro forjado" productos y herrería.
El acero dulce se corroe más fácilmente que el hierro forjado, pero es más barato y está más disponible. El acero al carbono contiene 2,0% de carbono o menos, con pequeñas cantidades de manganeso, azufre, fósforo y silicio. Los aceros aleados contienen cantidades variables de carbono y otros metales, como cromo, vanadio, molibdeno, níquel, tungsteno, etc. Su contenido de aleación aumenta su costo, por lo que generalmente solo se emplean para usos especializados. Sin embargo, un acero de aleación común es el acero inoxidable. Los desarrollos recientes en la metalurgia ferrosa han producido una gama cada vez mayor de aceros microaleados, también denominados 'HSLA' o aceros de baja aleación y alta resistencia, que contienen pequeñas adiciones para producir altas resistencias y, a menudo, una dureza espectacular a un costo mínimo.
Las aleaciones con composiciones elementales de alta pureza (como las aleaciones de hierro electrolítico) tienen propiedades específicamente mejoradas, como ductilidad, resistencia a la tracción, tenacidad, resistencia a la fatiga, resistencia al calor y resistencia a la corrosión.
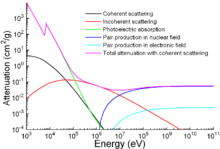
Además de las aplicaciones tradicionales, el hierro también se utiliza para protegerse de las radiaciones ionizantes. Aunque es más ligero que otro material de protección tradicional, el plomo, es mucho más resistente mecánicamente. En el gráfico se muestra la atenuación de la radiación en función de la energía.
La principal desventaja del hierro y el acero es que el hierro puro, y la mayoría de sus aleaciones, se oxidan gravemente si no se protegen de alguna manera, un costo que asciende a más del 1 % de la economía mundial. La pintura, la galvanización, la pasivación, el revestimiento de plástico y el pavonado se utilizan para proteger el hierro de la oxidación mediante la exclusión de agua y oxígeno o mediante protección catódica. El mecanismo de oxidación del hierro es el siguiente:
- Cathode: 3 O2 + 6 H2O + 12 e− → 12 OH−
- Anodo: 4 Fe → 4 Fe2+ + 8 e−; 4 Fe2+ → 4 Fe3+ + 4 e−
- Total: 4 Fe + 3 O2 + 6 H2O → 4 Fe3+ + 12 OH− → 4 Fe(OH)3 o 4 FeO(OH) + 4 H2O
El electrolito suele ser sulfato de hierro (II) en áreas urbanas (formado cuando el dióxido de azufre atmosférico ataca al hierro) y partículas de sal en la atmósfera en áreas costeras.
Catálisis
Los catalizadores de hierro se utilizan tradicionalmente en el proceso Haber-Bosch para la producción de amoníaco y el proceso Fischer-Tropsch para la conversión de monóxido de carbono en hidrocarburos para combustibles y lubricantes. El hierro en polvo en un solvente ácido se usó en la reducción de Bechamp, la reducción de nitrobenceno a anilina. Los catalizadores a base de hierro desempeñan un papel crucial en la conversión de materias primas de origen biológico en valiosos productos químicos finos y a granel, en celdas de combustible y en la eliminación de productos químicos peligrosos.
Compuestos de hierro
El óxido de hierro (III) mezclado con polvo de aluminio se puede encender para crear una reacción de termita, que se usa para soldar piezas grandes de hierro (como rieles) y purificar minerales. El óxido y el oxihidróxido de hierro (III) se utilizan como pigmentos rojizos y ocres.
El cloruro de hierro (III) se usa en la purificación de agua y el tratamiento de aguas residuales, en el teñido de telas, como agente colorante en pinturas, como aditivo en la alimentación animal y como grabador de cobre en la fabricación de placas de circuito impreso.. También se puede disolver en alcohol para formar tintura de hierro, que se usa como medicamento para detener el sangrado en los canarios.
El sulfato de hierro (II) se utiliza como precursor de otros compuestos de hierro. También se utiliza para reducir el cromato en el cemento. Se utiliza para fortificar alimentos y tratar la anemia por deficiencia de hierro. El sulfato de hierro (III) se usa para sedimentar partículas diminutas de aguas residuales en el agua del tanque. El cloruro de hierro (II) se utiliza como agente floculante reductor, en la formación de complejos de hierro y óxidos de hierro magnéticos, y como agente reductor en síntesis orgánica.
Papel biológico y patológico
El hierro es necesario para la vida. Los grupos de hierro y azufre son omnipresentes e incluyen nitrogenasa, las enzimas responsables de la fijación biológica de nitrógeno. Las proteínas que contienen hierro participan en el transporte, almacenamiento y uso del oxígeno. Las proteínas de hierro están involucradas en la transferencia de electrones.
Ejemplos de proteínas que contienen hierro en organismos superiores incluyen hemoglobina, citocromo (ver hierro de alta valencia) y catalasa. El ser humano adulto promedio contiene alrededor del 0,005 % del peso corporal de hierro, o alrededor de cuatro gramos, de los cuales tres cuartas partes se encuentran en la hemoglobina, un nivel que permanece constante a pesar de que solo se absorbe alrededor de un miligramo de hierro cada día, porque el cuerpo humano recicla su hemoglobina. por el contenido de hierro.
El crecimiento microbiano puede verse favorecido por la oxidación del hierro (II) o por la reducción del hierro (III).
Bioquímica
La adquisición de hierro plantea un problema para los organismos aeróbicos porque el hierro férrico es poco soluble cerca del pH neutro. Por lo tanto, estos organismos han desarrollado medios para absorber hierro en forma de complejos, a veces absorbiendo hierro ferroso antes de oxidarlo de nuevo a hierro férrico. En particular, las bacterias han desarrollado agentes secuestrantes de muy alta afinidad llamados sideróforos.
Después de la absorción en las células humanas, el almacenamiento de hierro se regula con precisión. Un componente importante de esta regulación es la proteína transferrina, que se une a los iones de hierro absorbidos del duodeno y los transporta por la sangre a las células. La transferrina contiene Fe3+ en medio de un octaedro distorsionado, unido a un nitrógeno, tres oxígenos y un anión carbonato quelante que atrapa el ion Fe3+: tiene tal una alta constante de estabilidad que es muy eficaz para captar iones Fe3+ incluso de los complejos más estables. En la médula ósea, la transferrina se reduce de Fe3+ y Fe2+ y se almacena como ferritina para incorporarse a la hemoglobina.
Los compuestos bioinorgánicos de hierro (moléculas biológicas de hierro) más conocidos y estudiados son las proteínas hemo: ejemplos son la hemoglobina, la mioglobina y el citocromo P450. Estos compuestos participan en el transporte de gases, la construcción de enzimas y la transferencia de electrones. Las metaloproteínas son un grupo de proteínas con cofactores de iones metálicos. Algunos ejemplos de metaloproteínas de hierro son la ferritina y la rubredoxina. Muchas enzimas vitales para la vida contienen hierro, como la catalasa, las lipoxigenasas y la IRE-BP.
La hemoglobina es un transportador de oxígeno que se produce en los glóbulos rojos y aporta su color, transportando oxígeno en las arterias desde los pulmones hasta los músculos donde se transfiere a la mioglobina, que lo almacena hasta que se necesita para la oxidación metabólica de la glucosa, generando energía. Aquí, la hemoglobina se une al dióxido de carbono, producido cuando se oxida la glucosa, que es transportado a través de las venas por la hemoglobina (predominantemente como aniones de bicarbonato) de vuelta a los pulmones, donde se exhala. En la hemoglobina, el hierro se encuentra en uno de los cuatro grupos hemo y tiene seis posibles sitios de coordinación; cuatro están ocupados por átomos de nitrógeno en un anillo de porfirina, el quinto por un nitrógeno de imidazol en un residuo de histidina de una de las cadenas proteicas unidas al grupo hemo, y el sexto está reservado para la molécula de oxígeno a la que puede unirse de forma reversible. Cuando la hemoglobina no está unida al oxígeno (y entonces se llama desoxihemoglobina), el ion Fe2+ en el centro del grupo hemo (en el interior de la proteína hidrofóbica) está en una configuración de espín alto. Por lo tanto, es demasiado grande para caber dentro del anillo de porfirina, que en cambio se dobla en una cúpula con el ion Fe2+ a unos 55 picómetros por encima. En esta configuración, el sexto sitio de coordinación reservado para el oxígeno está bloqueado por otro residuo de histidina.
Cuando la desoxihemoglobina recoge una molécula de oxígeno, este residuo de histidina se aleja y regresa una vez que el oxígeno está firmemente unido para formar un enlace de hidrógeno con él. Esto da como resultado que el ion Fe2+ cambie a una configuración de espín bajo, lo que resulta en una disminución del 20 % en el radio iónico, de modo que ahora puede encajar en el anillo de porfirina, que se vuelve plano. (Además, este enlace de hidrógeno da como resultado la inclinación de la molécula de oxígeno, lo que da como resultado un ángulo de enlace Fe-O-O de alrededor de 120° que evita la formación de Fe-O-Fe o Fe-O2–Fe puentes que conducirían a la transferencia de electrones, la oxidación de Fe2+ a Fe3+, y la destrucción de la hemoglobina). Esto da como resultado un movimiento de todos las cadenas de proteínas que conducen a que las otras subunidades de hemoglobina cambien de forma a una forma con mayor afinidad por el oxígeno. Por lo tanto, cuando la desoxihemoglobina absorbe oxígeno, aumenta su afinidad por más oxígeno y viceversa. La mioglobina, por otro lado, contiene solo un grupo hemo y, por lo tanto, este efecto cooperativo no puede ocurrir. Así, mientras que la hemoglobina está casi saturada de oxígeno en las altas presiones parciales de oxígeno que se encuentran en los pulmones, su afinidad por el oxígeno es mucho menor que la de la mioglobina, que oxigena incluso a bajas presiones parciales de oxígeno que se encuentran en el tejido muscular. Como lo describe el efecto Bohr (llamado así por Christian Bohr, el padre de Niels Bohr), la afinidad por el oxígeno de la hemoglobina disminuye en presencia de dióxido de carbono.
El monóxido de carbono y el trifluoruro de fósforo son venenosos para los humanos porque se unen a la hemoglobina de manera similar al oxígeno, pero con mucha más fuerza, de modo que el oxígeno ya no puede transportarse por todo el cuerpo. La hemoglobina unida al monóxido de carbono se conoce como carboxihemoglobina. Este efecto también juega un papel menor en la toxicidad del cianuro, pero allí el efecto principal es, con mucho, su interferencia con el funcionamiento adecuado de la proteína transportadora de electrones citocromo a. Las proteínas del citocromo también involucran grupos hemo y participan en la oxidación metabólica de la glucosa por el oxígeno. El sexto sitio de coordinación es ocupado por otro nitrógeno de imidazol o azufre de metionina, por lo que estas proteínas son en gran medida inertes al oxígeno, con la excepción del citocromo a, que se une directamente al oxígeno y, por lo tanto, se envenena muy fácilmente con cianuro. Aquí, la transferencia de electrones tiene lugar cuando el hierro permanece en espín bajo pero cambia entre los estados de oxidación +2 y +3. Dado que el potencial de reducción de cada paso es ligeramente mayor que el anterior, la energía se libera paso a paso y, por lo tanto, puede almacenarse en trifosfato de adenosina. El citocromo a es ligeramente distinto, ya que ocurre en la membrana mitocondrial, se une directamente al oxígeno y transporta protones y electrones, de la siguiente manera:
- 4 Cytc2+ + O2 + 8H+
dentro → 4 Cytc3+ + 2 H2O + 4H+
afuera
Aunque las proteínas hem son la clase más importante de proteínas que contienen hierro, las proteínas de hierro y azufre también son muy importantes y están involucradas en la transferencia de electrones, lo cual es posible ya que el hierro puede existir de manera estable en el +2 o en el +3 estados de oxidación. Estos tienen uno, dos, cuatro u ocho átomos de hierro, cada uno de los cuales está aproximadamente tetraédricamente coordinado con cuatro átomos de azufre; debido a esta coordinación tetraédrica, siempre tienen hierro de alto espín. El más simple de estos compuestos es la rubredoxina, que tiene solo un átomo de hierro coordinado con cuatro átomos de azufre de los residuos de cisteína en las cadenas peptídicas circundantes. Otra clase importante de proteínas de hierro y azufre son las ferredoxinas, que tienen múltiples átomos de hierro. La transferrina no pertenece a ninguna de estas clases.
La capacidad de los mejillones marinos para mantener su agarre en las rocas del océano se ve facilitada por el uso de enlaces organometálicos a base de hierro en sus cutículas ricas en proteínas. Sobre la base de réplicas sintéticas, la presencia de hierro en estas estructuras aumentó el módulo elástico 770 veces, la resistencia a la tracción 58 veces y la tenacidad 92 veces. La cantidad de estrés requerida para dañarlos permanentemente aumentó 76 veces.
Nutrición
Dieta
El hierro es omnipresente, pero las fuentes particularmente ricas de hierro en la dieta incluyen carnes rojas, ostras, lentejas, frijoles, aves, pescado, vegetales de hoja, berros, tofu, garbanzos, guisantes y melaza negra. El pan y los cereales para el desayuno a veces están específicamente fortificados con hierro.
El hierro proporcionado por los suplementos dietéticos a menudo se encuentra como fumarato de hierro (II), aunque el sulfato de hierro (II) es más económico y se absorbe igualmente bien. El hierro elemental, o hierro reducido, a pesar de ser absorbido en solo un tercio o dos tercios de la eficiencia (en relación con el sulfato de hierro), a menudo se agrega a alimentos como cereales para el desayuno o harina de trigo enriquecida. El hierro está más disponible para el cuerpo cuando se quela en aminoácidos y también está disponible para su uso como un suplemento de hierro común. La glicina, el aminoácido menos costoso, se usa con mayor frecuencia para producir suplementos de glicinato de hierro.
Recomendaciones dietéticas
El Instituto de Medicina de EE. UU. (IOM) actualizó los requisitos promedio estimados (EAR) y las cantidades diarias recomendadas (RDA) de hierro en 2001. El EAR actual de hierro para mujeres de 14 a 18 años es de 7,9 mg/día, 8,1 para las edades 19–50 y 5,0 a partir de entonces (posmenopausia). Para los hombres, la EAR es de 6,0 mg/día a partir de los 19 años. La dosis diaria recomendada es de 15,0 mg/día para mujeres de 15 a 18 años, 18,0 para mujeres de 19 a 50 y 8,0 a partir de entonces. Para hombres, 8,0 mg/día a partir de los 19 años. Las RDA son más altas que las EAR para identificar montos que cubrirán a las personas con requisitos superiores al promedio. La dosis diaria recomendada para el embarazo es de 27 mg/día y, para la lactancia, de 9 mg/día. Para niños de 1 a 3 años, 7 mg/día, 10 para los de 4 a 8 años y 8 para los de 9 a 13 años. En cuanto a la seguridad, el IOM también establece niveles máximos de ingesta tolerable (UL) para vitaminas y minerales cuando la evidencia es suficiente. En el caso del hierro la UL se establece en 45 mg/día. En conjunto, las EAR, las RDA y las UL se denominan ingestas dietéticas de referencia.
La Autoridad Europea de Seguridad Alimentaria (EFSA) se refiere al conjunto colectivo de información como Valores dietéticos de referencia, con Ingesta de referencia de la población (PRI) en lugar de RDA y Requerimiento promedio en lugar de EAR. AI y UL definieron lo mismo que en Estados Unidos. Para las mujeres, el PRI es de 13 mg/día de 15 a 17 años, 16 mg/día para mujeres de 18 años en adelante que son premenopáusicas y 11 mg/día posmenopáusicas. Para embarazo y lactancia, 16 mg/día. Para los hombres, el PRI es de 11 mg/día a partir de los 15 años. Para niños de 1 a 14 años, el PRI aumenta de 7 a 11 mg/día. Los PRI son más altos que los RDA de EE. UU., con la excepción del embarazo. La EFSA revisó la misma pregunta de seguridad y no estableció un UL.
Los bebés pueden necesitar suplementos de hierro si son alimentados con leche de vaca con biberón. Los donantes de sangre frecuentes corren el riesgo de tener niveles bajos de hierro y, a menudo, se les recomienda complementar su ingesta de hierro.
Para fines de etiquetado de alimentos y suplementos dietéticos de EE. UU., la cantidad en una porción se expresa como un porcentaje del valor diario (%DV). Para fines de etiquetado de hierro, el 100 % del valor diario fue de 18 mg y, a partir del 27 de mayo de 2016, se mantuvo sin cambios en 18 mg. Se proporciona una tabla de los valores diarios para adultos antiguos y nuevos en la Ingesta diaria de referencia.
Deficiencia
La deficiencia de hierro es la deficiencia nutricional más común en el mundo. Cuando la pérdida de hierro no se compensa adecuadamente con una ingesta adecuada de hierro en la dieta, se produce un estado de deficiencia de hierro latente, que con el tiempo conduce a la anemia por deficiencia de hierro si no se trata, que se caracteriza por un número insuficiente de glóbulos rojos y una cantidad insuficiente de de hemoglobina Los niños, las mujeres premenopáusicas (mujeres en edad fértil) y las personas con una dieta deficiente son más susceptibles a la enfermedad. La mayoría de los casos de anemia por deficiencia de hierro son leves, pero si no se tratan pueden causar problemas como latidos cardíacos rápidos o irregulares, complicaciones durante el embarazo y retraso en el crecimiento de bebés y niños.
Exceso
La absorción de hierro está estrictamente regulada por el cuerpo humano, que no tiene medios fisiológicos regulados para excretar hierro. Solo se pierden pequeñas cantidades de hierro diariamente debido al desprendimiento de las células epiteliales de la piel y la mucosa, por lo que el control de los niveles de hierro se logra principalmente mediante la regulación de la absorción. La regulación de la absorción de hierro se ve afectada en algunas personas como resultado de un defecto genético que se asigna a la región del gen HLA-H en el cromosoma 6 y conduce a niveles anormalmente bajos de hepcidina, un regulador clave de la entrada de hierro en el sistema circulatorio en mamíferos. En estas personas, la ingesta excesiva de hierro puede provocar trastornos de sobrecarga de hierro, conocidos médicamente como hemocromatosis. Muchas personas tienen una susceptibilidad genética no diagnosticada a la sobrecarga de hierro y no conocen antecedentes familiares del problema. Por esta razón, las personas no deben tomar suplementos de hierro a menos que sufran deficiencia de hierro y hayan consultado a un médico. Se estima que la hemocromatosis es la causa del 0,3 al 0,8% de todas las enfermedades metabólicas de los caucásicos.
Las sobredosis de hierro ingerido pueden causar niveles excesivos de hierro libre en la sangre. Los niveles altos de hierro ferroso libre en la sangre reaccionan con los peróxidos para producir radicales libres altamente reactivos que pueden dañar el ADN, las proteínas, los lípidos y otros componentes celulares. La toxicidad del hierro ocurre cuando la célula contiene hierro libre, lo que generalmente ocurre cuando los niveles de hierro exceden la disponibilidad de transferrina para unir el hierro. El daño a las células del tracto gastrointestinal también puede evitar que regulen la absorción de hierro, lo que lleva a mayores aumentos en los niveles sanguíneos. Por lo general, el hierro daña las células del corazón, el hígado y otros lugares, lo que provoca efectos adversos que incluyen coma, acidosis metabólica, shock, insuficiencia hepática, coagulopatía, daño de órganos a largo plazo e incluso la muerte. Los seres humanos experimentan toxicidad por hierro cuando el hierro supera los 20 miligramos por cada kilogramo de masa corporal; 60 miligramos por kilogramo se considera una dosis letal. El consumo excesivo de hierro, a menudo el resultado de que los niños ingieren grandes cantidades de tabletas de sulfato ferroso destinadas al consumo de adultos, es una de las causas toxicológicas más comunes de muerte en niños menores de seis años. La Ingesta Dietética de Referencia (DRI) establece el Nivel Superior de Ingesta Tolerable (UL) para adultos en 45 mg/día. Para niños menores de catorce años, la UL es de 40 mg/día.
El manejo médico de la toxicidad por hierro es complicado y puede incluir el uso de un agente quelante específico llamado deferoxamina para unir y expulsar el exceso de hierro del cuerpo.
TDAH
Algunas investigaciones han sugerido que los niveles bajos de hierro en el tálamo pueden desempeñar un papel en la fisiopatología del TDAH. Algunos investigadores han descubierto que los suplementos de hierro pueden ser efectivos, especialmente en el subtipo del trastorno por falta de atención. Un estudio también mostró que el hierro puede disminuir el riesgo de eventos cardiovasculares durante el tratamiento con medicamentos para el TDAH.
Algunos investigadores en la década de 2000 sugirieron un vínculo entre los niveles bajos de hierro en la sangre y el TDAH. Un estudio de 2012 no encontró tal correlación.
Cáncer
El papel del hierro en la defensa contra el cáncer puede describirse como un "arma de doble filo" debido a su presencia generalizada en procesos no patológicos. Las personas que reciben quimioterapia pueden desarrollar deficiencia de hierro y anemia, para lo cual se utiliza la terapia con hierro intravenoso para restaurar los niveles de hierro. La sobrecarga de hierro, que puede ocurrir por un alto consumo de carne roja, puede iniciar el crecimiento del tumor y aumentar la susceptibilidad a la aparición del cáncer, particularmente del cáncer colorrectal.
Sistemas marinos
El hierro juega un papel esencial en los sistemas marinos y puede actuar como un nutriente limitante para la actividad planctónica. Debido a esto, una disminución excesiva de hierro puede conducir a una disminución en las tasas de crecimiento de los organismos fitoplanctónicos como las diatomeas. El hierro también puede ser oxidado por microbios marinos en condiciones altas en hierro y bajas en oxígeno.
El hierro puede ingresar a los sistemas marinos a través de los ríos adyacentes y directamente desde la atmósfera. Una vez que el hierro ingresa al océano, puede distribuirse por toda la columna de agua a través de la mezcla del océano y mediante el reciclaje a nivel celular. En el Ártico, el hielo marino juega un papel importante en el almacenamiento y distribución de hierro en el océano, agotando el hierro oceánico a medida que se congela en el invierno y liberándolo nuevamente al agua cuando ocurre el deshielo en el verano. El ciclo del hierro puede hacer que las formas de hierro fluctúen de formas acuosas a partículas, alterando la disponibilidad de hierro para los productores primarios. El aumento de la luz y el calor aumenta la cantidad de hierro que se encuentra en formas que pueden utilizar los productores primarios.
Contenido relacionado
Carbamazepina
Estireno
Emanuel Bronner