Placas amiloides
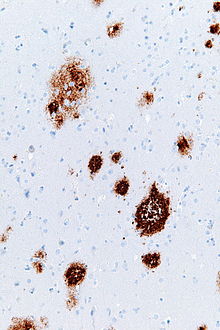
placas amiloides (también conocidas como placas neuríticas, placas de beta amiloide o placas seniles) son depósitos extracelulares. de la proteína beta amiloide (Aβ) principalmente en la materia gris del cerebro. Elementos neuronales degenerativos y una abundancia de microglía y astrocitos pueden estar asociados con placas amiloides. Algunas placas se producen en el cerebro como resultado del envejecimiento, pero una gran cantidad de placas y ovillos neurofibrilares son rasgos característicos de la enfermedad de Alzheimer. Las placas son muy variables en forma y tamaño; en secciones de tejido inmunoteñidas para Aβ, comprenden una curva de distribución de tamaño logarítmico normal, con un área de placa promedio de 400 a 450 micrómetros cuadrados (μm²). Son particularmente numerosas las placas más pequeñas (menos de 200 µm²), que a menudo consisten en depósitos difusos de Aβ. Las placas se forman cuando Aβ se plega mal y se agrega en oligómeros y polímeros más largos, los últimos de los cuales son característicos del amiloide.
Historia
En 1892, Paul Blocq y Gheorghe Marinescu describieron por primera vez la presencia de placas en la materia gris. Se refirieron a las placas como "nódulos de esclerosis neuroglial". En 1898, Emil Redlich informó sobre placas en tres pacientes, dos de los cuales tenían demencia clínicamente verificada. Redlich utilizó el término "esclerosis miliar" para referirse a ella. describió las placas porque pensaba que se parecían a semillas de mijo, y fue el primero en referirse a las lesiones como 'placas'.
A principios del siglo XX, Oskar Fischer notó su similitud con actinomyces 'Drusen' (lesiones en forma de geoda), lo que le llevó a llamar al proceso degenerativo 'drusige Nekrose'. A Alois Alzheimer se le atribuye a menudo el mérito de haber vinculado por primera vez las placas con la demencia en una presentación de 1906 (publicada en 1907), pero este breve informe se centró principalmente en los ovillos neurofibrilares, y las placas sólo se mencionaron brevemente. La primera descripción sustancial de las placas de Alzheimer apareció en 1911. Por el contrario, Oskar Fischer publicó una serie de investigaciones exhaustivas sobre las placas y la demencia en 1907, 1910 y 1912. En 1911, Max Bielschowsky propuso la naturaleza amiloide de los depósitos de placas. Esto lo confirmó más tarde Paul Divry, quien demostró que las placas teñidas con el colorante Rojo Congo muestran la propiedad óptica de birrefringencia, característica de los amiloides en general.
En 1911, Teofil Simchowicz introdujo el término 'placas seniles' para denotar su presencia frecuente en el cerebro de personas mayores. En 1968, un análisis cuantitativo confirmó la asociación de las placas seniles con la demencia. El término 'placas neuríticas' se utilizó en 1973 para designar placas que incluyen procesos neuronales anormales (neuritas). Un avance en 1984 y 1985 fue la identificación de Aβ como la proteína que forma los núcleos de las placas. Este descubrimiento condujo a la generación de nuevas herramientas para estudiar las placas, en particular los anticuerpos contra Aβ, y presentó una diana molecular para el desarrollo de posibles terapias para la enfermedad de Alzheimer.
La generación de beta amiloide
La beta amiloide (Aβ) es una proteína pequeña, generalmente de 40 o 42 aminoácidos de longitud, que se libera a partir de una proteína madre más larga llamada proteína precursora de Aβ (APP). La APP es producida por muchos tipos de células del cuerpo, pero es especialmente abundante en las neuronas. Es una proteína transmembrana de paso único que atraviesa una vez las membranas celulares.
El segmento Aβ de APP está en parte dentro de la membrana y en parte fuera de la membrana. Para liberar Aβ, la APP se escinde secuencialmente mediante dos enzimas: primero, por la beta secretasa (o enzima de escisión del β-amiloide (BACE)) fuera de la membrana y, en segundo lugar, por la gamma secretasa (γ-secretasa), un complejo enzimático dentro de la membrana. . Las acciones secuenciales de estas secretasas dan como resultado fragmentos de proteína Aβ que se liberan al espacio extracelular. Además de los péptidos Aβ que tienen 40 o 42 aminoácidos de longitud, también se generan varios fragmentos Aβ menos abundantes. El Aβ puede modificarse químicamente de varias maneras, y la longitud de la proteína y las modificaciones químicas pueden influir tanto en su tendencia a agregarse como en su toxicidad.
Identificación

Las placas amiloides son visibles con el microscopio óptico utilizando una variedad de técnicas de tinción, que incluyen tinciones de plata, rojo Congo, tioflavina, violeta de cresilo, reacción PAS y oligotiofenos conjugados luminiscentes (LCO). Estos métodos a menudo tiñen diferentes componentes de las placas y varían en su sensibilidad. Las placas también se pueden visualizar inmunohistoquímicamente con anticuerpos dirigidos contra Aβ u otros componentes de las lesiones. Las tinciones inmunohistoquímicas son especialmente útiles porque son sensibles y específicas para los antígenos asociados con las placas.
Composición
Los depósitos de Aβ que componen las placas amiloides son variables en tamaño y apariencia. Bajo el microscopio óptico, varían desde acumulaciones pequeñas y tenues de unas pocas micras de diámetro hasta masas densas o difusas mucho más grandes. Las llamadas 'placas clásicas' Consisten en un núcleo compacto de Aβ-amiloide rodeado por una corona de Aβ algo menos densamente empaquetada. Las placas clásicas también incluyen procesos neuronales (neuritas) anormales e inflamados que se derivan de muchos tipos diferentes de neuronas, junto con astrocitos y microglia activados. Las neuritas anormales y las células gliales activadas no son típicas de la mayoría de las placas difusas y se ha sugerido que los depósitos difusos son una etapa temprana en el desarrollo de las placas.
Distribución anatómica
Dietmar Thal y sus colegas han propuesto una secuencia de etapas de formación de placas en el cerebro de pacientes con Alzheimer. En la Fase 1, las placas aparecen en la neocorteza; en la Fase 2, aparecen en la alocorteza, la formación del hipocampo y la amígdala; en la Fase 3 se afectan los ganglios basales y el diencéfalo; en la fase 4, aparecen placas en el mesencéfalo y el bulbo raquídeo; y en la Fase 5 aparecen en la protuberancia y el cerebelo. Por lo tanto, en la etapa terminal de la enfermedad de Alzheimer, se pueden encontrar placas en la mayor parte del cerebro. Son poco comunes en la médula espinal.
Formación y difusión
La función normal de Aβ no es cierta, pero las placas surgen cuando la proteína se extravía y comienza a acumularse en el cerebro por un proceso de templanzamiento molecular ('verding'). Mathias Jucker y Lary Walker han asimilado este proceso a la formación y propagación de priones en enfermedades conocidas como encefalopatías espongiformes o enfermedades prion. Según el paradigma del prión, ciertas proteínas se miden en formas ricas en estructura secundaria de hoja beta.
Implicación en la enfermedad
Las abundantes placas de Aβ, junto con los ovillos neurofibrilares formados por proteína tau agregada, son las dos lesiones necesarias para el diagnóstico neuropatológico de la enfermedad de Alzheimer. Aunque el número de ovillos neurofibrilares se correlaciona más fuertemente con el grado de demencia que el número de placas, los hallazgos genéticos y patológicos indican que el Aβ desempeña un papel central en el riesgo, la aparición y la progresión de la enfermedad de Alzheimer.
El diagnóstico de la enfermedad de Alzheimer generalmente requiere un análisis microscópico de placas y ovillos en el tejido cerebral, generalmente en la autopsia. Sin embargo, las placas de Aβ (junto con la angiopatía cerebral de Aβ-amiloide) se pueden detectar en el cerebro de sujetos vivos preparando agentes radiomarcados que se unen selectivamente a los depósitos de Aβ en el cerebro después de ser infundidos en la sangre. Los ligandos cruzan la barrera hematoencefálica y se unen al Aβ agregado, y su retención en el cerebro se evalúa mediante tomografía por emisión de positrones. Además, la presencia de placas y ovillos se puede estimar midiendo las cantidades de proteínas Aβ y tau en el líquido cefalorraquídeo.
Ocurrencia
La probabilidad de tener placas en el cerebro aumenta con la edad. Desde los 60 años (10%) hasta los 80 años (60%), la proporción de personas con placas seniles aumenta linealmente. Las mujeres tienen una probabilidad ligeramente mayor de tener placas que los hombres. Tanto las placas como la enfermedad de Alzheimer también son más comunes en personas mayores con trisomía-21 (síndrome de Down). Se cree que esto se debe a la producción excesiva de Aβ porque el gen APP está en el cromosoma 21, que existe en tres copias en el síndrome de Down.
Las placas amiloides se producen naturalmente en los cerebros envejecidos de especies no humanas, desde aves hasta grandes simios. En primates no humanos, que son los parientes biológicos más cercanos de los humanos, se han encontrado placas en todas las especies examinadas hasta ahora. Sin embargo, los ovillos neurofibrilares son raros y no se ha demostrado que ninguna especie no humana padezca demencia junto con la neuropatología completa de la enfermedad de Alzheimer.
Investigación
La investigación que utiliza muestras humanas y modelos experimentales de la enfermedad de Alzheimer se ha dirigido a comprender las características bioquímicas, citológicas e inflamatorias de las placas, determinar cómo surgen y proliferan las placas en el cerebro, identificar factores de riesgo genéticos y ambientales, descubrir métodos para detectarlos en el cerebro vivo y desarrollar estrategias terapéuticas para prevenirlos o eliminarlos. La formación de placa amiloide puede estar relacionada con la hemorragia de los microvasos cerebrales.
Algunas investigaciones están dirigidas a comprender el efecto potencial de la inflamación asociada con las placas y a identificar factores de riesgo ambientales, fisiológicos o genéticos para la formación de placas en la enfermedad de Alzheimer.
Contenido relacionado
Ley de Fick
Precisión y exactitud
Evidencia empírica