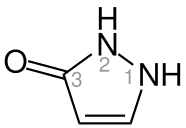Pirazolona
La pirazolona es un heterociclo de cinco miembros que contiene dos átomos de nitrógeno adyacentes. Puede considerarse un derivado del pirazol que posee un grupo carbonilo adicional (C=O). Los compuestos que contienen este grupo funcional son útiles comercialmente en analgésicos y colorantes.
Estructura y síntesis
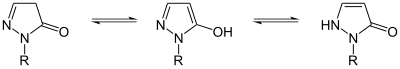
La pirazolona puede existir en dos isómeros: 3-pirazolona y 4-pirazolona.
Estos isómeros pueden interconvertirse mediante tautomería lactama-lactima e imina-enamina; estas conversiones a menudo muestran fotocromismo. En el caso de los derivados de pirazolona, el isómero 3-pirazolona se puede estabilizar con sustituyentes N-alquilo o N-arilo.
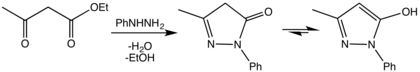
La primera síntesis de pirazolonas fue reportada en 1883 por Ludwig Knorr, mediante una reacción de condensación entre acetoacetato de etilo y fenilhidrazina.
Muchas pirazolonas se producen mediante la funcionalización de pirazolonas preformadas.
Aplicaciones
Productos farmacéuticos
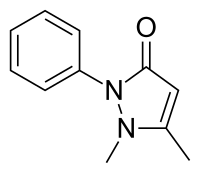
Las pirazolonas se encuentran entre los fármacos sintéticos más antiguos, desde la introducción de la antipirina (fenazona) en la década de 1880. Los compuestos generalmente actúan como analgésicos e incluyen dipirona (metamizol), aminofenazona, ampirona, famprofazona, morazona, nifenazona, piperilona y propifenazona. De estos, la dipirona es quizás el más utilizado.
La estructura básica también se ha utilizado en varios fármacos nuevos con otros efectos. La edaravona es útil para la prevención y/o el tratamiento de lesiones de la pared arterial. El eltrombopag se utiliza para tratar el recuento bajo de plaquetas en sangre.
Dyes
Los grupos pirazolona están presentes en varios colorantes importantes. Se utilizan comúnmente en combinación con grupos azo para formar una subfamilia de colorantes azoicos; a veces denominados azopirazolonas (tartrazina, naranja B, rojo mordiente 19, amarillo 2G). El amarillo ácido 17, el amarillo ácido 23 (tartrazina), el amarillo pigmento 13 y el rojo pigmento 38 se producen a escala de varias toneladas anualmente.
Ligands
Las pirazolonas se han estudiado como ligandos.
Referencias
- ^ a b Kornis, Gabe I. (2000). "Pyrazoles, Pirazolinas y Pirazolones". Kirk-Othmer Encyclopedia of Chemical Technology. doi:10.1002/0471238961.1625180111151814.a01. ISBN 0471238961.
- ^ Knorr, Ludwig (Julio 1883). "Einwirkung von Acetessigester auf Phenylhydrazin". Berichte der Deutschen Chemischen Gesellschaft (en alemán). 16 (2): 2597–2599. doi:10.1002/cber.188301602194.
- ^ a b Brogden, Rex N. (1986). "Pyrazolone Derivatives". Drogas. 32 (Suplemento 4): 60–70. doi:10.2165/00003495-198600324-00006. PMID 3552586. S2CID 2761563.
- ^ Brune, Kay (diciembre de 1997). "La historia temprana de los analgésicos no opioides". Dolor agudo. 1 (1): 33–40. doi:10.1016/S1366-0071(97)80033-2.
- ^ a b Zhao, Zefeng; Dai, Xufen; Li, Chenyang; Wang, Xiao; Tian, Jiale; Feng, Ying; Xie, Jing; Ma, Cong; Nie, Zhuang; Fan, Peinan; Qian, Mingcheng; He, Xirui; Wu, Shaoping; Zhang, Yongmin; Zheng, Xiaohui (2020). "El motivo estructural de Pirazolone en la química medicinal: retrospecto y perspectiva". European Journal of Medicinal Chemistry. 186: 111893. doi:10.1016/j.ejmech.2019.111893. PMC 7115706. PMID 31761383.
- ^ Bailly, Christian; Hecquet, Paul-Emile; Kouach, Mostafa; Thuru, Xavier; Goossens, Jean-François (2020). "Reactividad química y usos de 1-fenil-3-metil-5-pyrazolone (PMP), también conocido como edaravone". Bioorgánico & Medicinal Química. 28 (10): 115463. doi:10.1016/j.bmc.2020.115463. PMID 32241621. S2CID 214766793.
- ^ CASAS, J; GARCIATASENDE, M; SANCHEZ, A; SORDO, J; TOUCEDA, A (junio de 2007). "Modos de coordinación de 5-pirazolones: Una visión general del estado sólido". Análisis de química de coordinación. 251 (11–12): 1561–1589. doi:10.1016/j.ccr.2007.02.010.
Enlaces externos
- Pirazolones en la Biblioteca Nacional de Medicina de EE.UU.
- Pubchem - 3-Pyrazolone
- Pubchem - 4-Pyrazolone