Participación de grupos vecinos
En química orgánica, la participación de grupos vecinos (NGP, también conocida como asistencia anquimérica) ha sido definida por la Unión Internacional de Química Pura y Aplicada (IUPAC) como la interacción de un centro de reacción con un par solitario de electrones en un átomo o los electrones presente en un enlace pi contenido dentro de la molécula original pero no conjugado con el centro de reacción. Cuando NGP está en funcionamiento, es normal que aumente la velocidad de reacción. También es posible que la estereoquímica de la reacción sea anormal (o inesperada) en comparación con una reacción normal. Si bien es posible que los grupos vecinos influyan en muchas reacciones de la química orgánica (por ejemplo,la reacción de un dieno como el 1,3-ciclohexadieno con anhídrido maleico normalmente da el isómero endo debido a un efecto secundario {superposición de los orbitales π del grupo carbonilo con el estado de transición en la reacción de Diels-Alder}) esta página se limita a efectos de grupos vecinos observados con carbocationes y reacciones S N 2.
NGP por pares solitarios de heteroátomos
En este tipo de reacción de sustitución, un grupo del sustrato participa inicialmente en la reacción y por lo tanto afecta la reacción. Debido a NGP, la velocidad de reacción aumenta muchas veces. Un ejemplo clásico de NGP es la reacción de una mostaza de azufre o nitrógeno con un nucleófilo, la velocidad de reacción es mucho mayor para la mostaza de azufre y un nucleófilo que para un cloruro de alquilo primario o secundario sin un heteroátomo.

Ph−S−CH 2 −CH 2 −Cl reacciona con el agua 650 veces más rápido que CH 3 −CH 2 −CH 2 −Cl.
NGP por un alqueno
Los orbitales π de un alqueno pueden estabilizar un estado de transición ayudando a deslocalizar la carga positiva del carbocatión. Por ejemplo, el tosilato insaturado reaccionará más rápidamente (10 veces más rápido para la solvólisis acuosa) con un nucleófilo que el tosilato saturado.
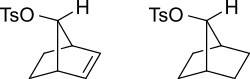
El intermedio carbocatiónico se estabilizará por resonancia donde la carga positiva se distribuye entre varios átomos. En el siguiente diagrama se muestra esto.
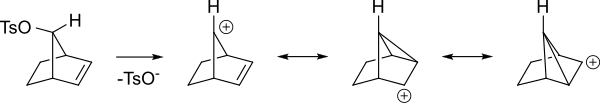
Aquí hay una vista diferente de los mismos intermedios.
Incluso si el alqueno está más alejado del centro de reacción, el alqueno aún puede actuar de esta manera. Por ejemplo, en el siguiente bencenosulfonato de alquilo, el alqueno puede deslocalizar el carbocatión.
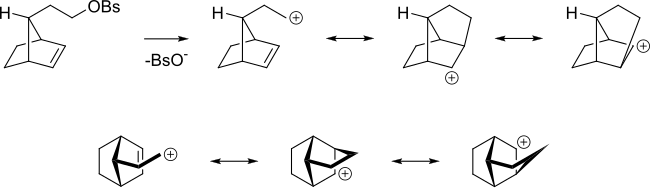
Además, el aumento en la velocidad de la reacción S N 2 del bromuro de alilo con un nucleófilo en comparación con la reacción del bromuro de n-propilo se debe a que los orbitales del enlace π se superponen con los del estado de transición. En el sistema alílico, los orbitales de alqueno se superponen con los orbitales de un estado de transición S N 2.
NGP por un grupo ciclopropano, ciclobutano o homoalilo
Si el cloruro de ciclopropilmetilo se hace reaccionar con etanol y agua, se obtiene una mezcla de alcohol ciclopropilmetílico al 48 %, ciclobutanol al 47 % y alcohol homoalílico al 5 % (but-3-enol). Esto se debe a que el intermedio carbocatiónico se deslocaliza en muchos carbonos diferentes a través de una abertura de anillo reversible.

NGP por un anillo aromático
En el caso de un haluro de bencilo, la reactividad es mayor porque el estado de transición S N 2 disfruta de un efecto de superposición similar al del sistema alílico según la teoría de orbitales moleculares.

Un anillo aromático puede ayudar en la formación de un intermediario carbocatiónico llamado ion fenonio al deslocalizar la carga positiva.
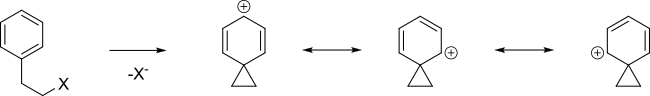
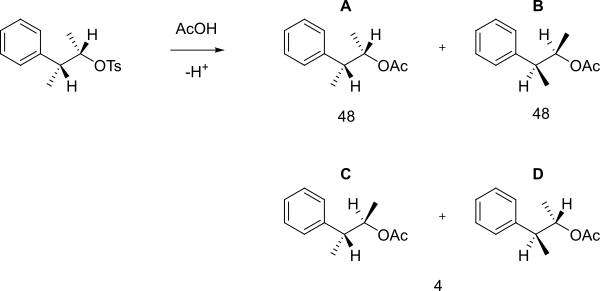
Cuando el siguiente tosilato reacciona con ácido acético en solvólisis, en lugar de una simple reacción S N 2 que forma B, se obtuvo una mezcla 48:48:4 de A, B (que son enantiómeros) y C+D.
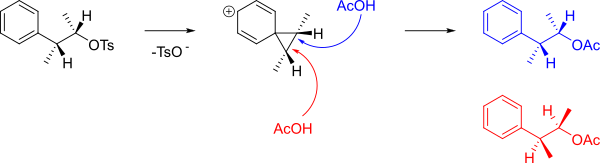
El mecanismo que forma A y B se muestra a continuación.
NGP por enlaces alifáticos CC o CH
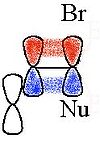
Los enlaces CC o CH alifáticos pueden conducir a la deslocalización de la carga si estos enlaces están cerca y en sentido antiperiplanar al grupo saliente. Los intermedios correspondientes se refieren a iones no clásicos, con el sistema 2-norbornilo como el caso más conocido.
Contenido relacionado
Regla de Clar
Ácido nítrico
Reacción de sustitución