Paraplejía espástica hereditaria
La paraplejia espástica hereditaria (HSP) es un grupo de enfermedades hereditarias cuya característica principal es un trastorno progresivo de la marcha. La enfermedad se presenta con rigidez progresiva (espasticidad) y contracción en las extremidades inferiores. La HSP también se conoce como paraparesia espástica hereditaria, paraplejía espástica familiar, enfermedad del asentamiento francés, enfermedad de Strumpell o enfermedad de Strumpell-Lorrain. Los síntomas son el resultado de la disfunción de los axones largos en la médula espinal. Las células afectadas son las neuronas motoras primarias; por lo tanto, la enfermedad es una enfermedad de la neurona motora superior. HSP no es una forma de parálisis cerebral a pesar de que físicamente puede aparecer y comportarse de manera muy similar a la diplejía espástica. El origen de la HSP es diferente al de la parálisis cerebral. A pesar de esto, algunos de los mismos medicamentos contra la espasticidad que se usan en la parálisis cerebral espástica a veces se usan para tratar los síntomas de la HSP.
La HSP es causada por defectos en el transporte de proteínas, proteínas estructurales, proteínas de mantenimiento celular, lípidos y otras sustancias a través de la célula. Las fibras nerviosas largas (axones) se ven afectadas porque las largas distancias hacen que las células nerviosas sean particularmente sensibles a los defectos en estos mecanismos mencionados.
La enfermedad fue descrita por primera vez en 1880 por el neurólogo alemán Adolph Strümpell. Fue descrito más extensamente en 1888 por Maurice Lorrain, un médico francés. Debido a su contribución en la descripción de la enfermedad, todavía se le llama enfermedad de Strümpell-Lorrain en los países de habla francesa. El término paraplejia espástica hereditaria fue acuñado por Anita Harding en 1983.
Signos y síntomas
Los síntomas dependen del tipo de HSP heredado. La característica principal de la enfermedad es la espasticidad progresiva en los miembros inferiores debido a la disfunción del tracto piramidal. Esto también da como resultado reflejos rápidos, reflejos plantares extensores, debilidad muscular y trastornos vesicales variables. Además, entre los síntomas centrales de la HSP también se incluyen la marcha anormal y la dificultad para caminar, la disminución del sentido vibratorio en los tobillos y las parestesias. Las personas con HSP pueden experimentar fatiga extrema asociada con trastornos del sistema nervioso central y neuromusculares, que pueden ser incapacitantes. Los síntomas iniciales suelen ser dificultad con el equilibrio, golpes en el dedo del pie o tropiezos. Los síntomas de la HSP pueden comenzar a cualquier edad, desde la infancia hasta los 60 años. Si los síntomas comienzan durante la adolescencia o más tarde, el trastorno de la marcha espástica suele progresar durante muchos años. Es posible que eventualmente se requieran bastones, andadores y sillas de ruedas, aunque algunas personas nunca requieren dispositivos de asistencia. Se ha descrito que la discapacidad progresa más rápidamente en las formas de inicio en la edad adulta.
Más específicamente, los pacientes con la forma pura autosómica dominante de HSP muestran un movimiento facial y extraocular normal. Aunque el reflejo mandibular puede ser intenso en sujetos mayores, no hay alteraciones del habla ni dificultad para tragar. El tono y la fuerza de los músculos de las extremidades superiores son normales. En las extremidades inferiores, aumenta el tono muscular en isquiotibiales, cuádriceps y tobillos. La debilidad es más notable en el psoasilíaco, el tibial anterior y, en menor medida, en los músculos isquiotibiales. En la forma compleja del trastorno, se presentan síntomas adicionales. Estos incluyen: neuropatía periférica, amiotrofia, ataxia, discapacidad intelectual, ictiosis, epilepsia, neuropatía óptica, demencia, sordera o problemas con el habla, la deglución o la respiración.
Anita Harding clasificó la HSP en una forma pura y complicada. La HSP pura se presenta con espasticidad en las extremidades inferiores, asociada con alteración de la vejiga neurógena, así como falta de sensibilidad a la vibración (hipoestesia paliativa). Por otro lado, la PSH se clasifica como compleja cuando la espasticidad de miembros inferiores se combina con algún síntoma neurológico adicional.
Esta clasificación es subjetiva y a los pacientes con HSP complejas a veces se les diagnostica ataxia cerebelosa con espasticidad, discapacidad intelectual (con espasticidad) o leucodistrofia. Algunos de los genes enumerados a continuación se han descrito anteriormente en otras enfermedades además de la HSP. Por lo tanto, algunos genes clave se superponen con otros grupos de enfermedades.
Edad de inicio
En el pasado, la HSP se clasificaba como de inicio temprano en la primera infancia o de inicio tardío en la edad adulta. La edad de inicio tiene dos puntos máximos a los 2 años y alrededor de los 40 años. Los nuevos hallazgos proponen que un inicio más temprano conduce a una mayor duración de la enfermedad sin pérdida de la deambulación o la necesidad de usar una silla de ruedas. Esto también se describió anteriormente, que las formas de inicio tardío evolucionan más rápidamente.
Causa
HSP es un grupo de trastornos genéticos. Sigue las reglas generales de herencia y se puede heredar de forma autosómica dominante, autosómica recesiva o recesiva ligada al cromosoma X. El modo de herencia involucrado tiene un impacto directo en las posibilidades de heredar el trastorno. Se han descrito más de 70 genotipos y más de 50 loci genéticos se han relacionado con esta afección. Se han identificado diez genes con herencia autosómica dominante. Uno de estos, SPG4, representa ~50% de todos los casos resueltos genéticamente, o aproximadamente 25% de todos los casos de HSP. Se sabe que doce genes se heredan de forma autosómica recesiva. En conjunto, este último grupo representa ~1/3 de los casos.
La mayoría de los genes alterados tienen una función conocida, pero la función de algunos todavía no se ha identificado. Todos ellos se enumeran en la lista de genes a continuación, incluido su modo de herencia. Algunos ejemplos son la espastina (SPG4) y la paraplegina (SPG7), ambas AAA ATPasas.
Genotipos
Los genes se denominan SPG (gen de la marcha espástica). Las ubicaciones de los genes están en el formato: cromosoma - brazo (corto o p: largo o q) - número de banda. Estas designaciones son solo para los genes humanos. Las ubicaciones pueden (y probablemente lo harán) variar en otros organismos. A pesar de la cantidad de genes que se sabe que están involucrados en esta condición, ~40% de los casos aún no han identificado su causa. En la siguiente tabla, SPG? se usa para indicar un gen que se ha asociado con HSP pero que aún no ha recibido una designación oficial de gen HSP.
| Genotipo | OMIM | Símbolo genético | Locus genético | Herencia | Edad de inicio | Otros nombres y características |
|---|---|---|---|---|---|---|
| SPG1 | 303350 | L1CAM | Xq28 | Resistente en X | Principios | Síndrome de MASA |
| SPG2 | 312920 | PLP1 | Xq22.2 | Resistente en X | Variable | Enfermedad de Pelizaeus-Merzbacher |
| SPG3A | 182600 | ATL1 | 14q22.1 | Autosómica dominante | Principios | Enfermedad de Strumpell (este Wiki) |
| SPG4 | 182601 | SPAST | 2p22.3 | Autosómica dominante | Variable | |
| SPG5A | 270800 | CYP7B1 | 8q12.3 | Receptivo autosómico | Variable | |
| SPG6 | 600363 | NIPA1 | 15q11.2 | Autosómica dominante | Variable | |
| SPG7 | 607259 | SPG7 | 16q24.3 | Autosómica dominante | Variable | |
| SPG8 | 603563 | KIAA0196 | 8q24.13 | Autosómica dominante | Adulto | |
| SPG9A | 601162 | ALDH18A1 | 10q24.1 | Autosómica dominante | Adolescente | Cataratas con neuronopatía motora, estatura corta y anomalías esqueléticas |
| SPG9B | 616586 | ALDH18A1 | 10q24.1 | Receptivo autosómico | Principios | |
| SPG10 | 604187 | KIF5A | 12q13.3 | Autosómica dominante | Principios | |
| SPG11 | 604360 | SPG11 | 15q21.1 | Receptivo autosómico | Variable | |
| SPG12 | 604805 | RTN2 | 19q13.32 | Autosómica dominante | Principios | |
| SPG13 | 605280 | HSP60 | 2q33.1 | Autosómica dominante | Variable | |
| SPG14 | 605229 | ? | 3q27-q28 | Receptivo autosómico | Adulto | |
| SPG15 | 270700 | ZFYVE26 | 14q24.1 | Receptivo autosómico | Principios | |
| SPG16 | 300266 | ? | Xq11.2 | Resistente en X | Principios | |
| SPG17 | 270685 | BSCL2 | 11q12.3 | Autosómica dominante | Adolescente | |
| SPG18 | 611225 | ERLIN2 | 8p11.23 | Receptivo autosómico | Principios | |
| SPG19 | 607152 | ? | 9q | Autosómica dominante | Composición de adultos | |
| SPG20 | 275900 | SPG20 | 13q13.3 | Receptivo autosómico | Inicio temprano | Síndrome de Troyer |
| SPG21 | 248900 | ACP33 | 15q22.31 | Receptivo autosómico | Inicio temprano | Síndrome de MAST |
| SPG22 | 300523 | SLC16A2 | Xq13.2 | Resistente en X | Inicio temprano | Síndrome de Allan-Herndon-Dudley |
| SPG23 | 270750 | RIPK5 | 1q32.1 | Receptivo autosómico | Inicio temprano | Síndrome de Lison |
| SPG24 | 607584 | ? | 13q14 | Receptivo autosómico | Inicio temprano | |
| SPG25 | 608220 | ? | 6q23–q24.1 | Receptivo autosómico | Adulto | |
| SPG26 | 609195 | B4GALNT1 | 12q13.3 | Receptivo autosómico | Inicio temprano | |
| SPG27 | 609041 | ? | 10q22.1–q24.1 | Receptivo autosómico | Variable | |
| SPG28 | 609340 | DDHD1 | 14q22.1 | Receptivo autosómico | Inicio temprano | |
| SPG29 | 609727 | ? | 1p31.1–p21.1 | Autosómica dominante | Adolescente | |
| SPG30 | 610357 | KIF1A | 2q37.3 | Receptivo autosómico | Adolescente | |
| SPG31 | 610250 | REEP1 | 2p11.2 | Autosómica dominante | Inicio temprano | |
| SPG32 | 611252 | ? | 14q12-q21 | Receptivo autosómico | Infancia | |
| SPG33 | 610244 | ZFYVE27 | 10q24.2 | Autosómica dominante | Adulto | |
| SPG34 | 300750 | ? | Xq24-q25 | Resistente en X | Adolescente/Adulto | |
| SPG35 | 612319 | FA2H | 16q23.1 | Receptivo autosómico | Infancia | |
| SPG36 | 613096 | ? | 12q23–q24 | Autosómica dominante | Adolescente/Adulto | |
| SPG37 | 611945 | ? | 8p21.1–q13.3 | Autosómica dominante | Variable | |
| SPG38 | 612335 | ? | 4p16-p15 | Autosómica dominante | Adolescente/Adulto | |
| SPG39 | 612020 | PNPLA6 | 19p13.2 | Receptivo autosómico | Infancia | |
| SPG41 | 613364 | ? | 11p14.1–p11.2 | Autosómica dominante | Adolescencia | |
| SPG42 | 612539 | SLC33A1 | 3q25.31 | Autosómica dominante | Variable | |
| SPG43 | 615043 | C19orf12 | 19q12 | Receptivo autosómico | Infancia | |
| SPG44 | 613206 | GJC2 | 1q42.13 | Receptivo autosómico | Infancia/cuarto | |
| SPG45 | 613162 | NT5C2 | 10q24.32–q24.33 | Receptivo autosómico | Infancy | |
| SPG46 | 614409 | GBA2 | 9p13.3 | Receptivo autosómico | Variable | |
| SPG47 | 614066 | AP4B1 | 1p13.2 | Receptivo autosómico | Infancia | |
| SPG48 | 613647 | AP5Z1 | 7p22.1 | Receptivo autosómico | 6a década | |
| SPG49 | 615041 | TECPR2 | 14q32.31 | Receptivo autosómico | Infancy | |
| SPG50 | 612936 | AP4M1 | 7q22.1 | Receptivo autosómico | Infancy | |
| SPG51 | 613744 | AP4E1 | 15q21.2 | Receptivo autosómico | Infancy | |
| SPG52 | 614067 | AP4S1 | 14q12 | Receptivo autosómico | Infancy | |
| SPG53 | 614898 | VPS37A | 8p22 | Receptivo autosómico | Infancia | |
| SPG54 | 615033 | DDHD2 | 8p11.23 | Receptivo autosómico | Infancia | |
| SPG55 | 615035 | C12orf65 | 12q24.31 | Receptivo autosómico | Infancia | |
| SPG56 | 615030 | CYP2U1 | 4q25 | Receptivo autosómico | Infancia | |
| SPG57 | 615658 | TFG | 3q12.2 | Receptivo autosómico | Principios | |
| SPG58 | 611302 | KIF1C | 17p13.2 | Receptivo autosómico | Dentro de las dos primeras décadas | Ataxia espástica 2 |
| SPG59 | 603158 | USP8 | 15q21.2 | ? Receptivo autosómico | Infancia | |
| SPG60 | 612167 | WDR48 | 3p22.2 | ? Receptivo autosómico | Infancy | |
| SPG61 | 615685 | ARL6IP1 | 16p12.3 | Receptivo autosómico | Infancy | |
| SPG62 | 615681 | ERLIN1 | 10q24.31 | Receptivo autosómico | Infancia | |
| SPG63 | 615686 | AMPD2 | 1p13.3 | Receptivo autosómico | Infancy | |
| SPG64 | 615683 | ENTPD1 | 10q24.1 | Receptivo autosómico | Infancia | |
| SPG66 | 610009 | ARSI | 5q32 | ? Autosómica dominante | Infancy | |
| SPG67 | 615802 | PGAP1 | 2q33.1 | Receptivo autosómico | Infancy | |
| SPG68 | 609541 | KLC2 | 11q13.1 | Receptivo autosómico | Infancia | Síndrome de SPOAN |
| SPG69 | 609275 | RAB3GAP2 | 1q41 | Receptivo autosómico | Infancy | Síndrome de Martsolf, síndrome de Warburg Micro |
| SPG70 | 156560 | MARS | 12q13 | ? Autosómica dominante | Infancy | |
| SPG71 | 615635 | ZFR | 5p13.3 | ? Receptivo autosómico | Infancia | |
| SPG72 | 615625 | REEP2 | 5q31 | Receptivo autosómico; autosómica dominante | Infancy | |
| SPG73 | 616282 | CPT1C | 19q13.33 | Autosómica dominante | Adulto | |
| SPG74 | 616451 | IBA57 | 1q42.13 | Receptivo autosómico | Infancia | |
| SPG75 | 616680 | MAG | 19q13.12 | Receptivo autosómico | Infancia | |
| SPG76 | 616907 | CAPN1 | 11q13 | Receptivo autosómico | Adulto | |
| SPG77 | 617046 | FARS2 | 6p25 | Receptivo autosómico | Infancia | |
| SPG78 | 617225 | ATP13A2 | 1p36 | Receptivo autosómico | Adulto | Síndrome de Kufor-Rakeb |
| SPG79 | 615491 | UCHL1 | 4p13 | Receptivo autosómico | Infancia | |
| HSNSP | 256840 | CCT5 | 5p15.2 | Receptivo autosómico | Infancia | Neuropatía sensorial hereditaria con paraplegia espástica |
| ¿SpG? | SERAC1 | 6q25.3 | Menores | Síndrome de MEGDEL | ||
| ¿SpG? | 605739 | KY | 3q22.2 | Receptivo autosómico | Infancy | |
| ¿SpG? | PLA2G6 | 22q13.1 | Receptivo autosómico | Infancia | ||
| ¿SpG? | ATAD3A | 1p36.33 | Autosómica dominante | Infancia | Síndrome de Harel-Yoon | |
| ¿SpG? | KCNA2 | 1p13.3 | Autosómica dominante | Infancia | ||
| ¿SpG? | Granulin | 17q21.31 | ||||
| ¿SpG? | POLR3A | 10q22.3 | Receptivo autosómico |
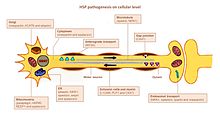
Fisiopatología
La principal característica de la HSP es una degeneración axonal dependiente de la longitud. Estos incluyen los tractos corticoespinales cruzados y no cruzados hacia las piernas y el fascículo gracilis. El tracto espinocerebeloso está involucrado en menor medida. Los cuerpos celulares neuronales de los axones en degeneración se conservan y no hay evidencia de desmielinización primaria. En algunos casos se observa pérdida de células del asta anterior de la médula espinal. Los ganglios de la raíz dorsal, las raíces posteriores y los nervios periféricos no se ven afectados directamente.
HSP afecta varias vías en las neuronas motoras. Muchos genes fueron identificados y vinculados a HSP. Sigue siendo un desafío definir con precisión los actores clave en cada una de las vías afectadas, principalmente porque muchos genes tienen múltiples funciones y están involucrados en más de una vía.
Búsqueda de rutas de axones
La búsqueda de rutas es importante para el crecimiento del axón hacia el destino correcto (por ejemplo, otra célula nerviosa o un músculo). Importante para este mecanismo es el gen L1CAM, una glicoproteína de la superficie celular de la superfamilia de las inmunoglobulinas. Las mutaciones que conducen a una pérdida de función en L1CAM también se encuentran en otros síndromes ligados al cromosoma X. Todos estos trastornos muestran deterioro del tracto corticoespinal (una característica distintiva de la HSP). L1CAM participa en un conjunto de interacciones, uniéndose a otras moléculas de L1CAM, así como a moléculas de adhesión celular extracelular, integrinas y proteoglicanos o proteínas intracelulares como las anquirinas.
El defecto de búsqueda de ruta se produce a través de la asociación de L1CAM con neuropilina-1. La neuropilina-1 interactúa con las proteínas Plexin-A para formar el complejo del receptor Semaphorin-3A. Luego, la semaforina-a3A se libera en la médula espinal ventral para alejar las neuronas corticoespinales de la línea media de la médula espinal/unión medular. Si L1CAM no funciona correctamente debido a una mutación, las neuronas cortiocospinales no se dirigen a la posición correcta y se produce el deterioro.
Metabolismo de los lípidos
Los axones del sistema nervioso central y periférico están recubiertos con un aislamiento, la capa de mielina, para aumentar la velocidad de propagación del potencial de acción. La mielinización anormal en el SNC se detecta en algunas formas de hsp HSP. Varios genes se relacionaron con la malformación de la mielina, a saber, PLP1, GFC2 y FA2H. Las mutaciones alteran la composición, el grosor y la integridad de la mielina.
El retículo endoplásmico (ER) es el orgánulo principal para la síntesis de lípidos. Las mutaciones en los genes que codifican proteínas que tienen un papel en la configuración de la morfología del RE y el metabolismo de los lípidos se vincularon con la HSP. Las mutaciones en ATL1, BSCL2 y ERLIN2 alteran la estructura del RE, específicamente la red tubular y la formación de uniones de tres vías en los túbulos del RE. Muchos genes mutados están relacionados con el metabolismo anormal de los lípidos. El efecto más frecuente es sobre el metabolismo del ácido araquidónico (CYP2U1) y el colesterol (CYP7B1), la actividad de la fosfolipasa (DDHD1 y DDHD2), la formación de gangliósidos (B4GALNT-1) y el equilibrio entre el metabolismo de carbohidratos y grasas (SLV33A1).
Tráfico endosómico
Las neuronas toman sustancias de su entorno por endocitosis. Las vesículas endocíticas se fusionan con los endosomas para liberar su contenido. Hay tres compartimentos principales que tienen tráfico de endosomas: Golgi hacia/desde los endosomas; membrana plasmática a/desde endosomas tempranos (a través de endosomas reciclados) y endosomas tardíos a lisosomas. La disfunción del tráfico endosomal puede tener graves consecuencias en las neuronas motoras con axones largos, como se informó en HSP. Las mutaciones en AP4B1 y KIAA0415 están relacionadas con alteraciones en la formación de vesículas y el tráfico de membranas, incluida la captación selectiva de proteínas en las vesículas. Ambos genes codifican proteínas que interactúan con otras proteínas e interrumpen las vías secretora y endocítica.
Función mitocondrial
Las disfunciones mitocondriales se han relacionado con trastornos neurológicos degenerativos y del desarrollo. Solo unos pocos genes HSP codifican proteínas mitocondriales. Dos proteínas residentes mitocondriales están mutadas en la HSP: la paraplegina y la chaperonina 60. La paraplegina es una metaloproteasa m-AAA de la membrana mitocondrial interna. Funciona en el ensamblaje ribosomal y el control de calidad de las proteínas. La actividad deteriorada de chaperonina 60 conduce a un control de calidad mitocondrial deteriorado. Dos genes DDHD1 y CYP2U1 han mostrado alteración de la arquitectura mitocondrial en fibroblastos de pacientes. Estos genes codifican enzimas implicadas en el metabolismo de los ácidos grasos.
Diagnóstico
El diagnóstico inicial de las HSP se basa en los antecedentes familiares, la presencia o ausencia de signos adicionales y la exclusión de otras causas no genéticas de espasticidad, siendo esta última particularmente importante en casos esporádicos.
La resonancia magnética cerebral y espinal es un procedimiento importante que se realiza para descartar otras afecciones neurológicas frecuentes, como la esclerosis múltiple, pero también para detectar anomalías asociadas, como la atrofia del cerebelo o del cuerpo calloso, así como anomalías de la sustancia blanca. El diagnóstico diferencial de la PSH también debe excluir la diplejía espástica que se presenta con efectos cotidianos casi idénticos e incluso se puede tratar con medicamentos similares, como el baclofeno y la cirugía ortopédica; a veces, estas dos condiciones pueden verse y sentirse tan similares que la única diferencia percibida puede ser la naturaleza hereditaria de la HSP versus la naturaleza explícitamente no hereditaria de la diplejía espástica (sin embargo, a diferencia de la diplejía espástica y otras formas de parálisis cerebral espástica, la HSP no se puede tratar de manera confiable con rizotomía dorsal selectiva).
La confirmación definitiva del diagnóstico de HSP solo puede obtenerse mediante la realización de pruebas genéticas dirigidas a mutaciones genéticas conocidas.
Clasificación
Las paraplejías espásticas hereditarias se pueden clasificar según los síntomas; modo de herencia; la edad del paciente al inicio; los genes afectados; y vías bioquímicas implicadas.
Tratamiento
No se conoce ningún tratamiento específico que pueda prevenir, retrasar o revertir la HSP. Las terapias disponibles consisten principalmente en el manejo médico sintomático y la promoción del bienestar físico y emocional. Las terapias que se ofrecen a los pacientes con HSP incluyen:
- Baclofen: un relajante muscular voluntario para relajar los músculos y reducir el tono. Esto se puede administrar oralmente o intratecalmente. (Estudios en HSP)
- Tizanidina – para tratar espasmos nocturnos o intermitentes (estudios disponibles)
- Diazepam y clonazepam – para disminuir la intensidad de los espasmos
- Cloruro de oxibutinina – un agente relajante muscular involuntario y espasmolítico usado para reducir la espasticidad de la vejiga en pacientes con problemas de control de vejiga
- Tartrato de tolterodina – un agente relajante muscular involuntario y espasmolítico, utilizado para reducir la espasticidad de la vejiga en pacientes con problemas de control de vejiga
- Sistema Cro – para reducir la sobreactividad muscular (existiendo estudios para la espasticidad)
- Toxina botulínica – para reducir la sobreactividad muscular (existiendo estudios para pacientes con HSP)
- Antidepresivos (como inhibidores selectivos de recaptación de serotonina, antidepresivos tricíclicos e inhibidores de la monoamina oxidasa) – para pacientes que experimentan depresión clínica
- Terapia física: restaurar y mantener la capacidad de moverse; reducir el tono muscular; mantener o mejorar el rango de movimiento y movilidad; aumentar la fuerza y la coordinación; prevenir complicaciones, tales como articulaciones congeladas, contracturas o lechosores.
Pronóstico
Aunque la HSP es una afección progresiva, el pronóstico para las personas con HSP varía mucho. Afecta principalmente a las piernas, aunque puede haber alguna afectación de la parte superior del cuerpo en algunos individuos. Algunos casos son gravemente incapacitantes, mientras que otros dejan a las personas capaces de realizar la mayoría de las actividades ordinarias en un grado normal sin necesidad de ajustes. La mayoría de las personas con HSP tienen una expectativa de vida normal.
Epidemiología
A nivel mundial, se estima que la prevalencia de todas las paraplejías espásticas hereditarias combinadas es de 2 a 6 por cada 100 000 personas. Un estudio noruego de más de 2,5 millones de personas publicado en marzo de 2009 encontró una tasa de prevalencia de HSP de 7,4/100.000 habitantes, una tasa más alta, pero en el mismo rango que los estudios anteriores. No se encontraron diferencias de tasa en función del sexo y la edad media de inicio fue de 24 años. En los Estados Unidos, la paraplejia espástica hereditaria figura como una "enfermedad rara". por la Oficina de Enfermedades Raras (ORD) de los Institutos Nacionales de Salud, lo que significa que el trastorno afecta a menos de 200.000 personas en la población estadounidense.
Contenido relacionado
Ambigüedad del código de tiempo
Kuro5hin
Pesadilla