Ozonólisis
En química orgánica, la ozonólisis es una reacción orgánica en la que los enlaces insaturados se escinden con ozono (O 3). Los enlaces múltiples carbono-carbono se reemplazan por grupos carbonilo (C=O), como aldehídos, cetonas y ácidos carboxílicos. La reacción se aplica predominantemente a alquenos, pero los alquinos y los compuestos azo también son susceptibles de escisión. El resultado de la reacción depende del tipo de enlace múltiple que se oxida y de las condiciones de procesamiento.
Se han informado procedimientos detallados.
Ozonólisis de alquenos
Los alquenos se pueden oxidar con ozono para formar alcoholes, aldehídos o cetonas o ácidos carboxílicos. En un procedimiento típico, se burbujea ozono a través de una solución del alqueno en metanol a -78 °C hasta que la solución adquiere un color azul característico, que se debe al ozono que no ha reaccionado. Sin embargo, la industria recomienda temperaturas cercanas a los -20 °C. Este cambio de color indica el consumo completo del alqueno. Alternativamente, se pueden usar varios otros reactivos como indicadores de este criterio de valoración detectando la presencia de ozono. Si la ozonólisis se realiza introduciendo una corriente de oxígeno enriquecido con ozono a través de la mezcla de reacción, el gas efluente se puede dirigir a través de una solución de yoduro de potasio. Cuando la solución ha dejado de absorber ozono, el exceso de ozono oxida el yoduro a yodo, lo que se puede observar fácilmente por su color violeta. Para un control más estricto de la reacción en sí, se puede agregar a la mezcla de reacción un indicador como Sudan Red III. El ozono reacciona con este indicador más lentamente que con el objetivo de ozonólisis previsto. La ozonólisis del indicador, que provoca un cambio de color notable, sólo se produce una vez que se ha consumido el objetivo deseado. Si el sustrato tiene dos alquenos que reaccionan con el ozono a diferentes velocidades, se puede elegir un indicador cuya velocidad de oxidación propia sea intermedia entre ellas, y por tanto detener la reacción cuando sólo haya reaccionado el alqueno más susceptible del sustrato. De lo contrario, la presencia de ozono sin reaccionar en la solución (viendo su color azul) o en las burbujas (mediante detección de yoduro) sólo indica cuando todos los alquenos han reaccionado.
Después de completar la adición, se añade un reactivo para convertir el ozoide intermedio a un derivado de carbono. Las condiciones de trabajo reductivas son mucho más utilizadas que las condiciones oxidativas.
El uso de trifenilfosfina, tiourea, polvo de zinc o sulfuro de dimetilo produce aldehídos o cetonas. Mientras que el uso de borohidruro de sodio produce alcoholes. (El grupo R también puede ser hidrógenos)

El uso de peróxido de hidrógeno puede producir ácidos carboxílicos.

Los N-óxidos de amina producen aldehídos directamente. Otros grupos funcionales, como los éteres bencílicos, también pueden oxidarse con el ozono. Se ha propuesto que se pueden generar pequeñas cantidades de ácido durante la reacción debido a la oxidación del disolvente, por lo que a veces se utiliza piridina para amortiguar la reacción. El diclorometano se utiliza a menudo como codisolvente 1:1 para facilitar la escisión oportuna del ozonuro. El ácido azelaico y los ácidos pelargónicos se producen a partir de la ozonólisis del ácido oleico a escala industrial.
Un ejemplo es la ozonólisis del eugenol que convierte el alqueno terminal en un aldehído:
Al controlar las condiciones de reacción/trabajo, se pueden generar productos asimétricos a partir de alquenos simétricos:
- Utilizando TsOH; bicarbonato de sodio (NaHCO3); sulfuro de dimetil (DMS) da un aldehído y un acetal de dimetil
- Uso de anhídrido acético (Ac2O), trietilelamina (Et3N) da un metil ester y un aldehído
- Uso de TsOH; Ac2O, Et3N, da un ester de metil y un acetal de dimetil.
Mecanismo de reacción

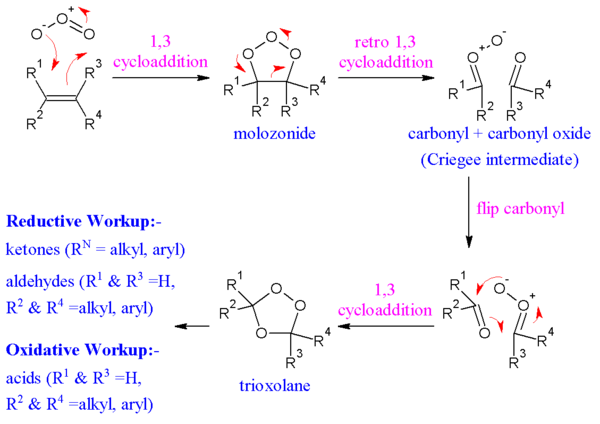
En el mecanismo generalmente aceptado propuesto por Rudolf Criegee en 1953, el alqueno y el ozono forman una molozonida intermedia en una cicloadición 1,3-dipolar. A continuación, la molozonida vuelve a su correspondiente óxido de carbonilo (también llamado intermedio de Criegee o Criegee zwitterion) y aldehído o cetona en una cicloadición retro-1,3-dipolar. El óxido y el aldehído o cetona reaccionan nuevamente en una cicloadición 1,3-dipolar o producen un intermedio de ozónido relativamente estable (un trioxolano).
La evidencia de este mecanismo se encuentra en el etiquetado isotópico. Cuando el benzaldehído marcado con 17O reacciona con óxidos de carbonilo, el marcador termina exclusivamente en el enlace éter del ozonuro. Todavía hay controversia sobre si la molozonida colapsa mediante un proceso concertado o radical; esto también puede presentar una dependencia del sustrato.
Historia
Christian Friedrich Schönbein, que descubrió el ozono en 1840, también realizó la primera ozonólisis: en 1845 informó que el etileno reacciona con el ozono; después de la reacción, no se percibía ni el olor a ozono ni el olor a etileno. La ozonólisis de alquenos a veces se denomina "ozonólisis de Harries", porque algunos atribuyen esta reacción a Carl Dietrich Harries. Antes de la llegada de las técnicas espectroscópicas modernas, la ozonólisis era un método importante para determinar la estructura de las moléculas orgánicas. Los químicos ozonizarían un alqueno desconocido para producir fragmentos más pequeños y más fácilmente identificables.
Ozonólisis de alquinos
La ozonolisis de las alquinas generalmente da un anhídrido ácido o producto diketone, no fragmentación completa como para las alkenes. Un agente de reducción no es necesario para estas reacciones. El mecanismo es desconocido. Si la reacción se realiza en presencia de agua, los hidrolídridos anhídridos dan dos ácidos carboxílicos.
Otros sustratos
Aunque rara vez se examinan, los compuestos azo (N=N) son susceptibles a la ozonólisis. Se producen nitrosaminas (N−N=O).
Aplicaciones
El uso principal de la ozonólisis es la conversión de ácidos grasos insaturados en derivados de valor agregado. La ozonólisis del ácido oleico es una ruta importante hacia el ácido azelaico. El coproducto es ácido nonanoico:
- CH3(CH)2)7CH=CH(CH)2)7CO2H} + 4 O3 HO2C(CH)2)7CO2H' + CH3(CH)2)7CO2H
El ácido erucico es un precursor del ácido latónico, un ácido C13-dicrboxílico que se utiliza para fabricar poliamidas y poliésteres especiales. La conversión implica ozonolisis]], que selectivamente escucha el vínculo C=C en ácido erucico:
- CH3(CH)2)7CH=CH(CH)2)11CO2H + O3 + 0,5 O2 → CH3(CH)2)7CO2H + HO2C(CH)2)11CO2H
Se han producido varios fármacos y sus intermediarios mediante ozonólisis. El uso del ozono en la industria farmacéutica es difícil de discernir debido a consideraciones de confidencialidad.
Ozonólisis como método analítico
La ozonólisis se ha utilizado para caracterizar la estructura de algunas poliolefinas. Los primeros experimentos demostraron que la unidad repetida en el caucho natural era isopreno.
Ocurrencia
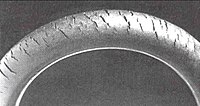
La ozonólisis puede ser un problema grave, conocido como craqueo de ozono, donde los rastros del gas en una atmósfera degradan los elastómeros, como el caucho natural, el polibutadieno, el estireno-butadieno y el caucho de nitrilo. La ozonólisis produce grupos cetonas en la superficie que pueden causar una mayor degradación gradual mediante reacciones de Norrish si el polímero se expone a la luz. Para minimizar este problema, muchos productos a base de poliolefinas se tratan con antiozonantes.
El craqueo por ozono es una forma de craqueo por corrosión bajo tensión en la que especies químicas activas atacan a los productos de un material susceptible. El producto de caucho debe estar bajo tensión para que se produzcan grietas. El agrietamiento del ozono alguna vez se vio comúnmente en las paredes laterales de los neumáticos, donde podría expandirse y causar una explosión peligrosa, pero ahora es raro debido al uso de antiozonantes modernos. Otros medios de prevención incluyen la sustitución de cauchos sensibles por elastómeros resistentes como policloropreno, EPDM o Viton.
Seguridad
El uso de ozono en la industria farmacéutica está limitado por consideraciones de seguridad.