Oxigenación por membrana extracorpórea.
oxigenación por membrana extracorpórea (ECMO), también conocida como soporte vital extracorpóreo (ECLS), es una Técnica extracorpórea para proporcionar apoyo cardíaco y respiratorio prolongado a personas cuyo corazón y pulmones no pueden proporcionar una cantidad adecuada de intercambio de gases o perfusión para sustentar la vida. La tecnología para ECMO se deriva en gran medida del bypass cardiopulmonar, que brinda apoyo a corto plazo con la circulación nativa detenida. El dispositivo utilizado es un oxigenador de membrana, también conocido como pulmón artificial.
La ECMO funciona extrayendo sangre temporalmente del cuerpo para permitir la oxigenación artificial de los glóbulos rojos y la eliminación del dióxido de carbono. Generalmente, se utiliza ya sea después de un bypass cardiopulmonar o en el tratamiento de etapa avanzada de una persona con insuficiencia cardíaca y/o pulmonar profunda, aunque ahora se está utilizando como tratamiento para el paro cardíaco en ciertos centros, lo que permite tratar la causa subyacente. de parada mientras se apoya la circulación y la oxigenación. La ECMO también se utiliza para ayudar a pacientes con neumonía viral aguda asociada con COVID-19 en los casos en que la ventilación artificial por sí sola no es suficiente para mantener los niveles de oxigenación de la sangre.
Usos médicos



La Organización de Soporte Vital Extracorpóreo (ELSO) publica las pautas que describen las indicaciones y la práctica de la ECMO. Los criterios para el inicio de ECMO varían según la institución, pero generalmente incluyen insuficiencia cardíaca o pulmonar aguda grave que es potencialmente reversible y no responde al tratamiento convencional. Ejemplos de situaciones clínicas que pueden impulsar el inicio de ECMO incluyen los siguientes:
- Insuficiencia respiratoria hipoxemática con una relación de tensión arterial de oxígeno a fracción de oxígeno inspirado (PaO2/FiO2) de י100 mmHg a pesar de la optimización de la configuración del ventilador, incluyendo la fracción de oxígeno inspirado (FiO2), presión final positiva (PEEP), y ratio inspiratoria a vencimiento (I:E)
- Insuficiencia respiratoria hipercapánica con pH arterial
- shock cardiogénico refractario
- Cardiac arrest
- Falta de de destete de bypass cardiopulmonar después de la cirugía cardíaca
- Como puente para trasplante cardíaco o colocación de un dispositivo de asistencia ventricular
- Como puente al trasplante pulmonar
- El shock séptico es un uso más controvertido pero cada vez más estudiado de la ECMO
- Hipotermia, con una temperatura central entre 28 y 24 °C y inestabilidad cardíaca, o con una temperatura central inferior a 24 °C.
En personas con paro cardíaco o shock cardiogénico, parece mejorar la supervivencia y los buenos resultados.
Uso en pacientes con COVID-19
A partir de principios de febrero de 2020, los médicos en China han estado utilizando cada vez más la ECMO como apoyo complementario para pacientes que presentan neumonía viral aguda asociada con la infección por SARS-CoV-2 (COVID-19) cuando, solo con ventilación, la oxigenación de la sangre Los niveles siguen siendo demasiado bajos para sostener al paciente. Los informes iniciales indican que está ayudando a restaurar la salud de los pacientes. saturación de oxígeno en la sangre y reducir las muertes entre aproximadamente el 3% de los casos graves en los que se ha utilizado. Para los pacientes críticamente enfermos, la tasa de mortalidad se reduce de alrededor del 59% al 71% con la terapia convencional a aproximadamente el 46% con la oxigenación por membrana extracorpórea. Un artículo de portada de Los Angeles Times de marzo de 2021 ilustró la eficacia de la ECMO en un paciente con COVID extremadamente desafiante. En febrero de 2021, tres mujeres israelíes embarazadas que padecían enfermedades "muy graves" Los casos de COVID-19 recibieron tratamiento ECMO y parecía que esta opción de tratamiento continuaría.
Resultados
Los primeros estudios habían demostrado un beneficio en la supervivencia con el uso de ECMO en personas con insuficiencia respiratoria aguda, especialmente en el contexto del síndrome de dificultad respiratoria aguda. Un registro mantenido por ELSO de casi 51 000 personas que recibieron ECMO ha informado resultados con un 75 % de supervivencia para la insuficiencia respiratoria neonatal, un 56 % de supervivencia para la insuficiencia respiratoria pediátrica y un 55 % de supervivencia para la insuficiencia respiratoria en adultos. Otros ensayos clínicos observacionales y no controlados han informado tasas de supervivencia del 50 al 70%. Estas tasas de supervivencia informadas son mejores que las tasas de supervivencia históricas. Aunque la ECMO se utiliza para una variedad de afecciones con diferentes tasas de mortalidad, la detección temprana es clave para prevenir la progresión del deterioro y aumentar los resultados de supervivencia.
En el Reino Unido, la implementación de ECMO veno-venosa se concentra en centros de ECMO designados para mejorar potencialmente la atención y promover mejores resultados.
Contraindicaciones
La mayoría de las contraindicaciones son relativas y equilibran los riesgos del procedimiento con los beneficios potenciales. Las contraindicaciones relativas son:
- Condiciones incompatibles con la vida normal si la persona se recupera
- Condiciones preexistentes que afectan la calidad de vida (estatus del SNC, malignidad en el estadio final, riesgo de sangrado sistémico con anticoagulación)
- Edad y tamaño
- Futilidad: aquellos que están demasiado enfermos, han estado en terapia convencional demasiado tiempo, o tienen un diagnóstico fatal.
Efectos secundarios y complicaciones
Neurológico
Una consecuencia común en los adultos tratados con ECMO es la lesión neurológica, que puede incluir hemorragia intracerebral, hemorragia subaracnoidea, infartos isquémicos en áreas susceptibles del cerebro, encefalopatía hipóxico-isquémica, coma inexplicable y muerte cerebral. El sangrado ocurre en 30 a 40% de los que reciben ECMO y puede poner en peligro la vida. Se debe tanto a la necesaria infusión continua de heparina como a la disfunción plaquetaria. Una técnica quirúrgica meticulosa, el mantenimiento de recuentos de plaquetas superiores a 100.000/mm3 y el mantenimiento del tiempo de coagulación activado objetivo reducen la probabilidad de hemorragia.
Sangre
La trombocitopenia inducida por heparina (TIH) es cada vez más común entre las personas que reciben ECMO. Cuando se sospecha TIH, la infusión de heparina generalmente se reemplaza por un anticoagulante sin heparina.
Hay un flujo sanguíneo retrógrado en la aorta descendente siempre que se utilizan la arteria y la vena femorales para la ECMO VA (venoarterial). La estasis de la sangre puede ocurrir si no se mantiene el gasto ventricular izquierdo, lo que puede resultar en trombosis.
Dispositivo de puente a asistencia
En VA ECMO, aquellos cuya función cardíaca no se recupera lo suficiente como para ser retirados de la ECMO pueden ser conectados a un dispositivo de asistencia ventricular (VAD) o a un trasplante. Durante la canulación pueden ocurrir diversas complicaciones, incluida la perforación del vaso con sangrado, disección arterial, isquemia distal y ubicación incorrecta.
Niños
Los bebés prematuros tienen un riesgo inaceptablemente alto de sufrir hemorragia intraventricular (HIV) si se les administra ECMO en una edad gestacional inferior a 32 semanas.
Infecciones
La prevalencia de infecciones adquiridas en el hospital durante la ECMO es del 10 al 12 % (más alta en comparación con otros pacientes críticamente enfermos). Los estafilococos coagulasa negativos, Candida spp., Enterobacteriaceae y Pseudomonas aeruginosa son los patógenos implicados con mayor frecuencia. Los pacientes con ECMO presentan una alta incidencia de neumonía asociada a la ventilación mecánica (24,4 casos/1.000 días de ECMO), en la que las enterobacterias desempeñan un papel importante. Se demostró que el riesgo infeccioso aumenta a lo largo de la duración de la ECMO, que es el factor de riesgo más importante para el desarrollo de infecciones. Otros factores específicos de ECMO que predisponen a las infecciones incluyen la gravedad de la enfermedad en los pacientes con ECMO, el alto riesgo de translocación bacteriana desde el intestino y el deterioro del sistema inmunológico relacionado con ECMO. Otro tema importante es la colonización microbiana de los catéteres, las cánulas de ECMO y el oxigenador.
Tipos
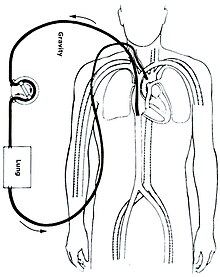

Existen varias formas de ECMO; los dos más comunes son la ECMO venoarterial (VA) y la ECMO venovenosa (VV). En ambas modalidades, la sangre drenada del sistema venoso se oxigena fuera del cuerpo. En ECMO VA, esta sangre regresa al sistema arterial y en ECMO VV la sangre regresa al sistema venoso. En VV ECMO, no se proporciona soporte cardíaco.
Venoarterial
En la ECMO venoarterial (VA), generalmente se coloca una cánula venosa en la vena femoral común derecha o izquierda para la extracción, y una cánula arterial generalmente se coloca en la arteria femoral derecha o izquierda para la infusión. La punta de la cánula venosa femoral debe mantenerse cerca de la unión de la vena cava inferior y la aurícula derecha, mientras que la punta de la cánula arterial femoral se mantiene en la arteria ilíaca. En adultos se prefiere el acceso a la arteria femoral porque la inserción es más sencilla. Se puede utilizar ECMO VA central si ya se ha establecido una derivación cardiopulmonar o se ha realizado una reesternotomía de emergencia (con cánulas en la aurícula derecha (o SVC/IVC para reparación tricúspide) y aorta ascendente).
La ECMO VA generalmente se reserva cuando la función cardíaca nativa es mínima para mitigar el aumento del trabajo del ictus cardíaco asociado con el bombeo contra el flujo retrógrado administrado por la cánula aórtica.
Veno-venoso
En la ECMO veno-venosa (VV), las cánulas generalmente se colocan en la vena femoral común derecha para drenaje y en la vena yugular interna derecha para infusión. Alternativamente, se inserta un catéter de doble luz en la vena yugular interna derecha, drenando sangre de las venas cavas superior e inferior y devolviéndola a la aurícula derecha.
Iniciación
La ECMO debe ser realizada únicamente por médicos con formación y experiencia en su inicio, mantenimiento y discontinuación. La inserción de ECMO generalmente la realiza un cirujano cardiotorácico en el quirófano. El manejo de ECMO comúnmente lo realiza una enfermera titulada, un terapeuta respiratorio o un perfusionista. Una vez que se ha decidido iniciar ECMO, se anticoagula al paciente con heparina intravenosa para evitar la formación de trombos que coagulen el oxigenador. Antes del inicio, se administra y mide un bolo intravenoso de heparina para garantizar que el tiempo de coagulación activada (ACT) esté entre 300 y 350 segundos. Una vez que el ACT esté entre este rango, se puede iniciar ECMO y luego se iniciará un goteo de heparina como dosis de mantenimiento.
Canulación
Las cánulas se pueden colocar por vía percutánea mediante la técnica de Seldinger, un método relativamente sencillo y común para obtener acceso a los vasos sanguíneos, o mediante incisión quirúrgica. Se utilizan las cánulas más grandes que se pueden colocar en los vasos para maximizar el flujo y minimizar el esfuerzo cortante. Sin embargo, la isquemia de las extremidades es una de las complicaciones notorias de la ECMO, pero puede evitarse utilizando un método adecuado de perfusión distal de las extremidades. Además, la ECMO se puede utilizar intraoperatoriamente durante el trasplante de pulmón para estabilizar al paciente con excelentes resultados.
La ECMO necesaria para las complicaciones posteriores a una cirugía cardíaca se puede colocar directamente en las cámaras apropiadas del corazón o en los grandes vasos. La canulación periférica (femoral o yugular) puede permitir que los pacientes que esperan un trasplante de pulmón permanezcan despiertos y ambulatorios con mejores resultados postrasplante.
Valoración
Después de la canulación y conexión al circuito ECMO, se determina la cantidad adecuada de flujo sanguíneo a través del circuito ECMO mediante parámetros hemodinámicos y un examen físico. Los objetivos de mantener la perfusión de los órganos terminales a través del circuito ECMO se equilibran con un flujo sanguíneo fisiológico suficiente a través del corazón para prevenir la estasis y la posterior formación de coágulos sanguíneos.
Mantenimiento
Una vez que se han alcanzado los objetivos respiratorios y hemodinámicos iniciales, el flujo sanguíneo se mantiene a ese ritmo. La oximetría venosa continua, que mide directamente la saturación de oxihemoglobina de la sangre en la rama venosa del circuito ECMO, facilita la evaluación y los ajustes frecuentes.
Consideraciones especiales
La ECMO VV se utiliza normalmente para la insuficiencia respiratoria, mientras que la ECMO VA se utiliza para la insuficiencia cardíaca. Existen consideraciones únicas para cada tipo de ECMO, que influyen en el manejo.
Flujo sanguíneo
Por lo general, se desean tasas de flujo altas durante la ECMO VV para optimizar el suministro de oxígeno. Por el contrario, el caudal utilizado durante la ECMO VA debe ser lo suficientemente alto para proporcionar una presión de perfusión y una saturación de oxihemoglobina venosa (medida en la sangre de drenaje) adecuadas, pero lo suficientemente bajo como para proporcionar una precarga suficiente para mantener el gasto ventricular izquierdo.
Diuresis
Dado que la mayoría de las personas tienen una sobrecarga de líquidos cuando se inicia la ECMO, se justifica una diuresis agresiva una vez que el paciente está estable con la ECMO. La ultrafiltración se puede agregar fácilmente al circuito ECMO si el paciente tiene una producción de orina inadecuada. El "charloteo" de ECMO, o inestabilidad de las formas de onda de ECMO, representa una reanimación insuficiente y respaldaría el cese de la diuresis agresiva o la ultrafiltración. Existe un mayor riesgo de lesión renal aguda relacionada con el uso de ECMO y la respuesta inflamatoria sistémica.
Monitorización ventricular izquierda
El gasto ventricular izquierdo se controla rigurosamente durante la ECMO VA porque la función ventricular izquierda puede verse afectada por el aumento de la poscarga, lo que a su vez puede conducir a la formación de trombos dentro del corazón.
Destete y discontinuación
Para aquellos con insuficiencia respiratoria, las mejoras en la apariencia radiográfica, la distensibilidad pulmonar y la saturación arterial de oxihemoglobina indican que la persona puede estar lista para retirarle el soporte ECMO. Para aquellos con insuficiencia cardíaca, el aumento de la pulsatilidad aórtica se correlaciona con un mejor gasto ventricular izquierdo e indica que pueden estar listos para retirarles el soporte ECMO. Si todos los marcadores están en buen estado, los flujos sanguíneos en la ECMO disminuirán lentamente y se observarán los parámetros del paciente durante este tiempo para garantizar que el paciente pueda tolerar los cambios. Cuando los flujos son inferiores a 2 litros por minuto, se intenta la extracción permanente y se continúa monitorizando al paciente durante este tiempo hasta que se puedan retirar las cánulas.
Ensayo de liberación de ECMO venovenoso
Las pruebas de ECMO VV se realizan eliminando todo el gas de barrido en contracorriente a través del oxigenador. El flujo sanguíneo extracorpóreo permanece constante, pero no se produce transferencia de gas. Luego se los observa durante varias horas, durante las cuales se determinan los ajustes del ventilador necesarios para mantener una oxigenación y ventilación adecuadas fuera de ECMO, según lo indicado por los resultados de gases en sangre arterial y venosa.
Ensayo de liberación de ECMO venoarterial
Las pruebas de ECMO VA requieren la sujeción temporal de las líneas de drenaje y de infusión, mientras se permite que el circuito de ECMO circule a través de un puente entre las ramas arterial y venosa. Esto previene la trombosis de sangre estancada dentro del circuito ECMO. Además, las líneas arterial y venosa deben lavarse continuamente con solución salina heparinizada o de forma intermitente con sangre heparinizada del circuito. En general, los ensayos de ECMO VA tienen una duración más corta que los ensayos de ECMO VV debido al mayor riesgo de formación de trombos.
Historia
La ECMO fue desarrollada en la década de 1950 por John Gibbon y luego por C. Walton Lillehei. El primer uso para recién nacidos fue en 1965.
Banning Gray Lary demostró por primera vez que el oxígeno intravenoso podía mantener la vida. Sus resultados se publicaron en Surgical Forum en noviembre de 1951. Lary comentó su trabajo inicial en una presentación de 2007 en la que escribe: "Nuestra investigación comenzó ensamblando un aparato que, por primera vez, mantuvo vivos a los animales mientras respiraban nitrógeno puro. Esto se logró inyectando burbujas muy pequeñas de oxígeno en el torrente sanguíneo. Estas burbujas se formaron añadiendo un 'agente humectante' al oxígeno que pasa a través de un filtro de porcelana hacia el torrente sanguíneo venoso. Poco después de su presentación inicial en el Colegio Americano de Cirujanos, Walton Lillehei revisó este aparato y, junto con DeWall, creó la primera máquina práctica de circulación extracorpórea que empleaba un oxigenador de burbujas. Con variaciones, estas máquinas se utilizaron durante los siguientes veinte años."
Fabricantes
- Medtronic
- Maquet (Getinge Group)
- Xenios AG (Fresenius Medical Care)
- Sorin Group
- Terumo
- Nipro
- MicroPort
Disponibilidad por país
| País/territorio | Continente | Hospitales equipados | Unidades |
|---|---|---|---|
| Estados Unidos | América del Norte | 361 (en 2022) | |
| Canadá | América del Norte | 23 (en 2022) | |
| Australia | Oceanía | 146 (en 2020) | |
| Brasil | América del Sur | 21 (en 2021) | |
| Inglaterra y Gales | Europa | 5 (en 2020) | 15 (en 2020) |
| Irlanda del Norte | Europa | 0 (en 2020) | 0 (en 2020) |
| Escocia | Europa | 1 (en 2020) | 6 (en 2020) |
| Alemania | Europa | 214 (en 2020) | 779 (en 2021) |
| Polonia | Europa | 47 (en 2020) | |
| Suecia | Europa | 7 o más (en 2020) | |
| Albania | Europa | 0 (en 2020) | 0 (en 2020) |
| Rusia | Europa | 124 + 17 (en 2020) | |
| Moscú | Europa | 16 (en 2020) | |
| San Petersburgo, Rusia | Europa | 7 | 19 (en 2020) |
| Japón | Asia | 2208 (en 2020) | |
| China continental | Asia | 400 (aprox. en 2020)
2.857 (en 2023) | |
| Taiwán | Asia | 51 (en 2016) | 105 (en 2016)
129 (incluidas las unidades de alquiler, en 2016) |
| Sri Lanka | Asia meridional | 2 (en 2021) | 2 (en 2021) |
Investigación
Ensayos controlados aleatorios (ECA)
Se han realizado cuatro ensayos controlados aleatorios (ECA) para evaluar la eficacia de la ECMO en pacientes con insuficiencia respiratoria. Los primeros ensayos realizados por Zapol et al. y Morris et al. estuvieron plagados de desafíos técnicos relacionados con la tecnología ECMO disponible en las décadas de 1970 y 1990. Los ensayos CESAR y EOLIA utilizaron sistemas ECMO modernos y se consideran los ECA centrales de ECMO.
Juicio CESAR (2009)
El ensayo CESAR (soporte ventilatorio convencional frente a oxigenación por membrana extracorpórea para pacientes con insuficiencia respiratoria grave en adultos) fue un ECA multicéntrico realizado en el Reino Unido cuyo objetivo era evaluar la seguridad, eficacia y rentabilidad de la ECMO en comparación con la ventilación mecánica convencional en adultos con enfermedades graves pero insuficiencia respiratoria reversible. El resultado primario fue la muerte o discapacidad grave a los 6 meses o antes del alta hospitalaria. El resultado primario se analizó únicamente por intención de tratar. El análisis económico incluyó años de vida ajustados por calidad (AVAC), análisis de eventos generadores de costos, costo-utilidad 6 meses después de la aleatorización y modelado del costo-utilidad a lo largo de la vida. El ensayo tenía previsto inscribir a 180 pacientes; 90 a cada brazo.
El ensayo cumplió su objetivo de inscripción de 180 pacientes. 68 de los 90 (75%) de los pacientes que iban a ser tratados con ECMO en realidad fueron tratados con ECMO. La supervivencia de los pacientes asignados al grupo de ECMO (es decir, remitidos para consideración para tratamiento con ECMO) fue significativamente mayor que la de los pacientes asignados al grupo de ventilación convencional (63 % frente a 47 %, p = 0,03). El grupo remitido a ECMO ganó 0,03 AVAC en comparación con el grupo de ventilación convencional en el seguimiento de 6 meses. La derivación al grupo ECMO tuvo estancias más prolongadas y mayores costos.
La falta de un protocolo de tratamiento estandarizado para el grupo de ventilación convencional es la principal limitación del estudio CESAR. Los autores del ensayo señalan que esto ocurrió debido a la incapacidad de los sitios de inscripción para acordar un protocolo. Esto dio lugar a que los pacientes de control no recibieran ventilación protectora pulmonar, lo que se sabe que mejora la mortalidad en pacientes con SDRA.
Los autores concluyen que la derivación de pacientes con insuficiencia respiratoria grave y potencialmente reversible a un centro de ECMO puede mejorar significativamente la supervivencia libre de discapacidad grave a los 6 meses. Los resultados del ensayo CESAR proporcionan una comparación directa de supervivencia para el tratamiento con ECMO versus ventilación mecánica convencional sola, ya que sólo el 75% del grupo de ECMO fue realmente tratado con ECMO.
Juicio EOLIA (2018)
El ensayo ECMO para rescatar la lesión pulmonar en el SDRA grave (EOLIA) se diseñó para evaluar los efectos del inicio temprano de la ECMO en comparación con la atención estándar continua (ventilación mecánica convencional) en pacientes con SDRA grave. La mortalidad a los 60 días fue el criterio de valoración principal. El tamaño de muestra calculado fue de 331 pacientes con la intención de mostrar una reducción del 20 % en la mortalidad absoluta en el grupo de ECMO. El criterio de valoración secundario principal fue el fracaso del tratamiento: cruce a ECMO debido a hipoxemia refractaria o muerte en el grupo de control y muerte en el grupo de ECMO.
Tras el cuarto análisis intermedio planificado, el juicio se dio por finalizado por inutilidad. Se inscribieron un total de 249 pacientes al finalizar el estudio. Treinta y cinco pacientes del grupo de control (28%) requirieron un cruce de emergencia a ECMO. Los resultados de EOLIA no demostraron diferencias significativas en la mortalidad a los 60 días entre el grupo de ECMO y el grupo de control (35 % frente a 46 %, respectivamente). Sin embargo, la interpretación de este resultado se complica por los pacientes cruzados. El criterio de valoración secundario, fracaso del tratamiento, demostró un riesgo relativo de 0,62 (p<0,001) a favor del grupo ECMO. Los resultados del criterio de valoración secundario deben interpretarse con cautela debido a los resultados del criterio de valoración principal. Con respecto a la seguridad, el grupo de ECMO tuvo tasas significativamente más altas de trombocitopenia grave y hemorragia que requirieron transfusión, pero tasas más bajas de accidente cerebrovascular isquémico.
La principal limitación del ensayo EOLIA fue que no tenía suficiente potencia. Para que EOLIA hubiera tenido el poder estadístico adecuado para detectar la importancia de una reducción del 11% en la mortalidad, sería necesario haber inscrito a un total de 624 pacientes. Una prueba de este tipo tardaría nueve años según las tasas de reclutamiento de EOLIA y probablemente no sea factible.
La principal conclusión que los autores del estudio sacaron de estos resultados es que el inicio temprano de ECMO en pacientes con SDRA grave no proporciona un beneficio de mortalidad en comparación con el tratamiento estándar continuo. Editoriales posteriores de líderes de opinión clave sugieren que la implicación práctica es que la ECMO puede mejorar la mortalidad si se utiliza como terapia de rescate para pacientes que fracasan con las terapias convencionales del SDRA.