Óxido nitroso
Óxido nitroso (óxido de dinitrógeno o monóxido de dinitrógeno), comúnmente conocido como gas hilarante, nitroso o nos, es un compuesto químico, un óxido de nitrógeno con la fórmula N
2O. A temperatura ambiente, es un gas incoloro, no inflamable y tiene un olor y sabor ligeramente dulces. A temperaturas elevadas, el óxido nitroso es un poderoso oxidante similar al oxígeno molecular.
El óxido nitroso tiene importantes usos médicos, especialmente en cirugía y odontología, por sus efectos anestésicos y analgésicos. Su nombre coloquial, "gas de la risa", acuñado por Humphry Davy, se debe a los efectos eufóricos al inhalarlo, propiedad que ha llevado a su uso recreativo como anestésico disociativo. Está en la Lista de Medicamentos Esenciales de la Organización Mundial de la Salud. También se utiliza como oxidante en los propulsores de cohetes y en las carreras automovilísticas para aumentar la potencia de salida de los motores.
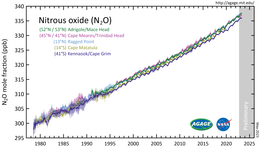
La concentración atmosférica de óxido nitroso alcanzó las 333 partes por mil millones (ppb) en 2020, aumentando a un ritmo de aproximadamente 1 ppb al año. Es un importante eliminador de ozono estratosférico, con un impacto comparable al de los CFC. Contabilidad global de N
2O fuentes y sumideros durante la década que terminó en 2016 indica que alrededor del 40 % del promedio de 17 TgN/año (teragramos, o millones de toneladas métricas, de nitrógeno por año) de emisiones originadas por la actividad humana, y muestra que el crecimiento de las emisiones provino principalmente de la expansión de las fuentes agrícolas e industriales dentro de las economías emergentes. Siendo el tercer gas de efecto invernadero de larga duración más importante, el óxido nitroso también contribuye sustancialmente al calentamiento global.
El óxido nitroso se usa como propulsor y tiene una variedad de aplicaciones, desde cohetes hasta hacer crema batida. Se utiliza como droga recreativa por su potencial para inducir un breve "subidón"; la mayoría de los usuarios recreativos desconocen su neurotoxicidad y su potencial para causar daño neurológico.
Usos
Motores cohete
El óxido nitroso se puede utilizar como oxidante en un motor de cohete. Tiene ventajas sobre otros oxidantes en que es mucho menos tóxico y, debido a su estabilidad a temperatura ambiente, también es más fácil de almacenar y relativamente seguro para llevar en un vuelo. Como beneficio secundario, puede descomponerse fácilmente para formar aire respirable. Su alta densidad y baja presión de almacenamiento (cuando se mantiene a baja temperatura) le permiten ser altamente competitivo con los sistemas de almacenamiento de gas a alta presión.
En una patente de 1914, el pionero de los cohetes estadounidense, Robert Goddard, sugirió el óxido nitroso y la gasolina como posibles propulsores para un cohete de combustible líquido. El óxido nitroso ha sido el oxidante elegido en varios diseños de cohetes híbridos (que utilizan combustible sólido con un oxidante líquido o gaseoso). SpaceShipOne y otros han utilizado la combinación de óxido nitroso con combustible de polibutadieno terminado en hidroxilo. También se usa notablemente en cohetes de aficionados y de alta potencia con varios plásticos como combustible.
El óxido nitroso también se puede usar en un cohete monopropulsor. En presencia de un catalizador calentado, N
2O se descompondrá exotérmicamente en nitrógeno y oxígeno, a una temperatura de aproximadamente 1070 ° F (577 °C). Debido a la gran liberación de calor, la acción catalítica rápidamente se vuelve secundaria, ya que la autodescomposición térmica se vuelve dominante. En un propulsor de vacío, esto puede proporcionar un impulso específico monopropulsor (Isp) de hasta 180 s. Si bien es notablemente menor que el Isp disponible de los propulsores de hidracina (monopropulsor o bipropulsor con tetróxido de dinitrógeno), la menor toxicidad hace que el óxido nitroso sea una opción que vale la pena investigando
Se dice que el óxido nitroso se deflagra a aproximadamente 600 °C (1112 °F) a una presión de 309 psi (21 atmósferas). A 600 psi, por ejemplo, la energía de encendido requerida es de solo 6 julios, mientras que N
2 O a 130 psi, una entrada de energía de encendido de 2500 julios es insuficiente.
Motor de combustión interna
En las carreras de vehículos, el óxido nitroso (a menudo denominado simplemente "nitroso") permite que el motor queme más combustible al proporcionar más oxígeno durante la combustión. El aumento de oxígeno permite un aumento en la inyección de combustible, lo que permite que el motor produzca más potencia del motor. El gas no es inflamable a baja presión/temperatura, pero libera más oxígeno que el aire atmosférico al descomponerse a temperaturas elevadas, alrededor de 570 grados F (~300 C). Por lo tanto, a menudo se mezcla con otro combustible más fácil de deflagrar. El óxido nitroso es un agente oxidante fuerte, aproximadamente equivalente al peróxido de hidrógeno y mucho más fuerte que el oxígeno gaseoso.
El óxido nitroso se almacena como líquido comprimido; la evaporación y expansión del óxido nitroso líquido en el múltiple de admisión provoca una gran caída en la temperatura de la carga de admisión, lo que da como resultado una carga más densa, lo que permite que entre más mezcla de aire/combustible en el cilindro. A veces, el óxido nitroso se inyecta en (o antes) del colector de admisión, mientras que otros sistemas inyectan directamente, justo antes del cilindro (inyección de puerto directo) para aumentar la potencia.
La técnica fue utilizada durante la Segunda Guerra Mundial por los aviones de la Luftwaffe con el sistema GM-1 para aumentar la potencia de salida de los motores de los aviones. Originalmente destinado a proporcionar a la aeronave estándar de la Luftwaffe un rendimiento superior a gran altitud, las consideraciones tecnológicas limitaron su uso a altitudes extremadamente altas. En consecuencia, solo fue utilizado por aviones especializados, como aviones de reconocimiento de gran altitud, bombarderos de alta velocidad y aviones interceptores de gran altitud. A veces se podía encontrar en aviones de la Luftwaffe también equipados con otro sistema de refuerzo de motor, MW 50, una forma de inyección de agua para motores de aviación que usaba metanol para sus capacidades de impulso.
Uno de los principales problemas del uso de óxido nitroso en un motor alternativo es que puede producir suficiente energía para dañar o destruir el motor. Son posibles aumentos de potencia muy grandes, y si la estructura mecánica del motor no se refuerza adecuadamente, el motor puede dañarse gravemente o destruirse durante este tipo de operación. Es muy importante con el aumento de óxido nitroso de los motores de gasolina para mantener las temperaturas de funcionamiento y los niveles de combustible adecuados para evitar la "preignición" o la "detonación" (a veces denominado "toc"). La mayoría de los problemas asociados con el óxido nitroso no provienen de fallas mecánicas debido a los aumentos de potencia. Dado que el óxido nitroso permite una carga mucho más densa en el cilindro, aumenta drásticamente la presión del cilindro. El aumento de la presión y la temperatura puede causar problemas como el derretimiento del pistón o las válvulas. También puede agrietar o deformar el pistón o la cabeza y provocar un preencendido debido a un calentamiento desigual.
El óxido nitroso líquido de grado automotriz difiere ligeramente del óxido nitroso de grado médico. Una pequeña cantidad de dióxido de azufre (SO
2) se agrega para prevenir el abuso de sustancias.
Propulsor de aerosoles
El gas está aprobado para su uso como aditivo alimentario (número E: E942), específicamente como propulsor de aerosoles. Sus usos más comunes en este contexto son los botes de crema batida en aerosol y los aerosoles para cocinar.
El gas es extremadamente soluble en compuestos grasos. En la nata montada en aerosol, se disuelve en la nata grasa hasta que sale de la lata, momento en el que se vuelve gaseosa y crea así espuma. Usado de esta manera, produce crema batida que es cuatro veces el volumen del líquido, mientras que batir aire en crema solo produce el doble del volumen. Si se utilizara aire como propulsor, el oxígeno aceleraría el enranciamiento de la grasa butírica, pero el óxido nitroso inhibe dicha degradación. El dióxido de carbono no se puede usar para la crema batida porque es ácido en el agua, lo que cuajaría la crema y le daría un "espumoso" similar al agua mineral. sensación.
La crema batida producida con óxido nitroso es inestable y volverá a un estado más líquido en media hora o una hora. Por tanto, el método no es adecuado para decorar alimentos que no se van a servir inmediatamente.
Durante diciembre de 2016, algunos fabricantes informaron sobre la escasez de cremas batidas en aerosol en los Estados Unidos debido a una explosión en las instalaciones de óxido nitroso de Air Liquide en Florida a fines de agosto. Con una instalación importante fuera de servicio, la interrupción provocó una escasez que provocó que la empresa desviara el suministro de óxido nitroso a clientes médicos en lugar de a la fabricación de alimentos. La escasez se produjo durante la temporada navideña y festiva, cuando el uso de crema batida enlatada normalmente es más alto.
Del mismo modo, el aerosol para cocinar, que está hecho de varios tipos de aceites combinados con lecitina (un emulsionante), puede usar óxido nitroso como propulsor. Otros propulsores utilizados en el aerosol para cocinar incluyen el alcohol y el propano de calidad alimentaria.
Medicina
El óxido nitroso se ha utilizado en odontología y cirugía, como anestésico y analgésico, desde 1844. En los primeros días, el gas se administraba a través de inhaladores simples que consistían en una bolsa de respiración hecha de tela de goma. Hoy en día, el gas se administra en los hospitales por medio de una máquina automática de analgesia relativa, con un vaporizador anestésico y un ventilador médico, que administra un flujo de óxido nitroso mezclado con oxígeno dosificado con precisión y activado por la respiración en una proporción de 2:1.
El óxido nitroso es un anestésico general débil y, por lo tanto, generalmente no se usa solo en anestesia general, sino que se usa como gas portador (mezclado con oxígeno) para fármacos anestésicos generales más potentes, como el sevoflurano o el desflurano. Tiene una concentración alveolar mínima de 105% y un coeficiente de partición sangre/gas de 0,46. Sin embargo, el uso de óxido nitroso en anestesia puede aumentar el riesgo de náuseas y vómitos postoperatorios.
Los dentistas usan una máquina más simple que solo ofrece una N
2O/O
2 mezcla para que el paciente inhale mientras está consciente. El paciente se mantiene consciente durante todo el procedimiento y conserva las facultades mentales adecuadas para responder a las preguntas e instrucciones del dentista.
La inhalación de óxido nitroso se usa con frecuencia para aliviar el dolor asociado con el parto, trauma, cirugía oral y síndrome coronario agudo (incluye ataques cardíacos). Se ha demostrado que su uso durante el parto es una ayuda segura y eficaz para las mujeres que dan a luz. Se desconoce el beneficio de su uso para el síndrome coronario agudo.
En Gran Bretaña y Canadá, los equipos de ambulancias (incluidos los médicos no registrados) suelen utilizar Entonox y Nitronox como gas analgésico rápido y muy eficaz.
Se puede considerar el uso de óxido nitroso al cincuenta por ciento por socorristas no profesionales capacitados en entornos prehospitalarios, dada la relativa facilidad y seguridad de administrar óxido nitroso al 50 % como analgésico. La rápida reversibilidad de su efecto también le impediría descartar el diagnóstico.
Uso recreativo
La inhalación recreativa de óxido nitroso, con el fin de provocar euforia y/o ligeras alucinaciones, comenzó como un fenómeno para la clase alta británica en 1799, conocido como "fiestas del gas de la risa".
A partir del siglo XIX, la disponibilidad generalizada del gas para fines médicos y culinarios permitió que el uso recreativo se expandiera enormemente en todo el mundo. En el Reino Unido, a partir de 2014, se estimó que casi medio millón de jóvenes usaban óxido nitroso en locales nocturnos, festivales y fiestas.
El uso recreativo generalizado de la droga en todo el Reino Unido se presentó en el documental de Vice de 2017 Inside The Laughing Gas Black Market, en el que el periodista Matt Shea se reunió con traficantes de la droga que la robaron de los hospitales.
Un problema importante mencionado en la prensa de Londres es el efecto de tirar basura con botes de óxido nitroso, que es muy visible y provoca quejas importantes en las comunidades.
Los usuarios recreativos a menudo perciben erróneamente el óxido nitroso como una ruta hacia un "subidón seguro" y no son conscientes de su potencial para causar daños neurológicos. En Australia, el uso recreativo se convirtió en un problema de salud pública luego de un aumento en los casos informados de neurotoxicidad y un aumento en las admisiones a la sala de emergencias, y en (el estado de) Australia del Sur se aprobó una legislación en 2020 para restringir las ventas de botes.
Seguridad
El óxido nitroso es un riesgo laboral significativo para cirujanos, dentistas y enfermeras. Debido a que el óxido nitroso se metaboliza mínimamente en humanos (con una tasa de 0,004%), conserva su potencia cuando el paciente lo exhala en la habitación y puede representar un peligro de intoxicación y exposición prolongada para el personal de la clínica si la habitación está mal ventilada. Cuando se administre óxido nitroso, un sistema de ventilación de aire fresco de flujo continuo o N
2O El sistema de eliminación se utiliza para evitar una acumulación de gases residuales.
El Instituto Nacional de Seguridad y Salud Ocupacional recomienda que los trabajadores' La exposición al óxido nitroso debe ser controlada durante la administración de gas anestésico en operadores médicos, dentales y veterinarios. Estableció un límite de exposición recomendado (REL) de 25 ppm (46 mg/m3) al anestésico escapado.
Deterioro mental y manual
La exposición al óxido nitroso provoca disminuciones a corto plazo en el rendimiento mental, la capacidad audiovisual y la destreza manual. Estos efectos, junto con la desorientación espacial y temporal inducida, podrían provocar daños físicos al usuario debido a peligros ambientales.
Neurotoxicidad y neuroprotección
El óxido nitroso es neurotóxico y su uso prolongado o habitual puede causar daños neurológicos graves.
Al igual que otros antagonistas del receptor NMDA, se ha sugerido que N
2O produce neurotoxicidad en forma de Olney's lesiones en roedores tras exposición prolongada (varias horas). Sin embargo, ha surgido una nueva investigación que sugiere que las lesiones de Olney no ocurren en humanos, y ahora se cree que medicamentos similares como la ketamina no son neurotóxicos agudos. Se ha argumentado que, debido a que N
2O se expulsa rápidamente del cuerpo en circunstancias normales, es menos probable que sea neurotóxico que otros antagonistas de NMDAR. De hecho, en roedores, la exposición a corto plazo produce solo una lesión leve que es rápidamente reversible, y la muerte neuronal ocurre solo después de una exposición constante y sostenida. El óxido nitroso también puede causar neurotoxicidad después de una exposición prolongada debido a la hipoxia. Esto es especialmente cierto en el caso de las formulaciones no médicas, como los cargadores de crema batida (también conocidos como "whippets" o "nangs"), que nunca contienen oxígeno, ya que el oxígeno hace que la crema se vuelva rancia.
En gas pesado (≥400 g o ≥200 L de N2O en una sesión) o usuarios frecuentes (regulares, p. ej., diarios o semanales) notificados a los centros de toxicología, se han observado signos de neuropatía periférica: presencia de ataxia (anomalías en la marcha) o parestesia (percepción de sensaciones anormales, p. ej., hormigueo, entumecimiento, picor, principalmente en las extremidades). Estos se consideran un signo temprano de daño neurológico e indican toxicidad crónica.
El óxido nitroso al 75 % por volumen reduce la muerte neuronal inducida por isquemia inducida por la oclusión de la arteria cerebral media en roedores, y disminuye la entrada de Ca2+ inducida por NMDA en cultivos de células neuronales, un factor crítico evento implicado en la excitotoxicidad.
Daño al ADN
La exposición ocupacional al óxido nitroso ambiental se ha asociado con daños en el ADN, debido a interrupciones en la síntesis de ADN. Esta correlación depende de la dosis y no parece extenderse al uso recreativo ocasional; sin embargo, se necesita más investigación para confirmar la duración y la cantidad de exposición necesaria para causar daño.
Privación de oxígeno
Si se inhala óxido nitroso puro sin oxígeno, puede producirse una privación de oxígeno, lo que puede provocar presión arterial baja, desmayos e incluso ataques cardíacos. Esto puede ocurrir si el usuario inhala grandes cantidades continuamente, como con una máscara con correa conectada a un bote de gas. También puede ocurrir si el usuario aguanta la respiración de forma excesiva o utiliza cualquier otro sistema de inhalación que corte el suministro de aire fresco. Otro riesgo es que se pueden producir síntomas de congelación en los labios, la laringe y los bronquios si el gas se inhala directamente del recipiente de gas. Por lo tanto, el óxido nitroso a menudo se inhala a través de condones o globos.
Deficiencia de vitamina B12
La exposición a largo plazo al óxido nitroso puede causar deficiencia de vitamina B12. Esto puede causar neurotoxicidad grave si el usuario tiene una deficiencia preexistente de vitamina B12. Inactiva la forma de cobalamina de la vitamina B12 por oxidación. Los síntomas de la deficiencia de vitamina B12, incluida la neuropatía sensorial, la mielopatía y la encefalopatía, pueden ocurrir días o semanas después de la exposición a la anestesia con óxido nitroso en personas con vitamina B subclínica Deficiencia de 12.
Los síntomas se tratan con altas dosis de vitamina B12, pero la recuperación puede ser lenta e incompleta.
Las personas con niveles normales de vitamina B12 tienen reservas para hacer que los efectos del óxido nitroso sean insignificantes, a menos que la exposición sea repetida y prolongada (abuso de óxido nitroso). Los niveles de vitamina B12 deben controlarse en personas con factores de riesgo de deficiencia de vitamina B12 antes de usar óxido nitroso anestesia.
Desarrollo prenatal
Varios estudios experimentales en ratas indican que la exposición crónica de hembras preñadas al óxido nitroso puede tener efectos adversos en el feto en desarrollo.
Riesgos químicos/físicos
A temperatura ambiente (20 °C [68 °F]), la presión de vapor saturado es de 50,525 bar, y sube hasta 72,45 bar a 36,4 °C (97,5 °F), la temperatura crítica. La curva de presión es, por lo tanto, inusualmente sensible a la temperatura.
Al igual que con muchos oxidantes fuertes, la contaminación de las piezas con combustibles se ha implicado en accidentes con cohetes, en los que pequeñas cantidades de mezclas de nitroso/combustible explotan debido a efectos similares a los de un "golpe de ariete" (a veces llamado "golpe de ariete").;dieseling"—el calentamiento debido a la compresión adiabática de los gases puede alcanzar temperaturas de descomposición). Algunos materiales de construcción comunes, como el acero inoxidable y el aluminio, pueden actuar como combustibles con oxidantes fuertes como el óxido nitroso, al igual que los contaminantes que pueden encenderse debido a la compresión adiabática.
También ha habido incidentes en los que la descomposición del óxido nitroso en las tuberías ha provocado la explosión de grandes tanques.
Mecanismo de acción
El mecanismo de acción farmacológico de N
2O en medicina no se conoce por completo. Sin embargo, se ha demostrado que modula directamente una amplia gama de canales iónicos controlados por ligandos, y esto probablemente juega un papel importante en muchos de sus efectos. Bloquea moderadamente los canales nACh que contienen subunidades β2 y NMDAR, inhibe débilmente los receptores AMPA, kainato, GABAC y 5-HT3, y potencia ligeramente los receptores GABAA y de glicina. También se ha demostrado que activa los canales de K+ de dominio de dos poros. Mientras que N
2O afecta a bastantes canales iónicos, sus efectos anestésicos, alucinógenos y euforizantes probablemente se deban predominante o totalmente a a través de la inhibición de las corrientes mediadas por el receptor NMDA. Además de sus efectos sobre los canales iónicos, N
2O puede actuar para imitar el óxido nítrico (NO) en el sistema nervioso central, y esto puede estar relacionado con sus propiedades analgésicas y ansiolíticas. El óxido nitroso es de 30 a 40 veces más soluble que el nitrógeno.
Se sabe que los efectos de inhalar dosis subanestésicas de óxido nitroso varían en función de varios factores, incluidos los entornos y las diferencias individuales; sin embargo, a partir de su discusión, Jay (2008) sugiere que se sabe de manera confiable que induce los siguientes estados y sensaciones:
- Intoxicación
- Euforia/diforia
- Desorientación espacial
- Desorientación temporal
- Reducir la sensibilidad del dolor
Una minoría de usuarios también presentará vocalizaciones descontroladas y espasmos musculares. Estos efectos generalmente desaparecen minutos después de la eliminación de la fuente de óxido nitroso.
Efecto ansiolítico
En pruebas conductuales de ansiedad, una dosis baja de N
2O es un ansiolítico eficaz, y este ansiolítico El efecto está asociado con una mayor actividad de los receptores GABAA, ya que es parcialmente revertida por los antagonistas de los receptores de benzodiazepinas. Reflejando esto, los animales que han desarrollado tolerancia a los efectos ansiolíticos de las benzodiazepinas son parcialmente tolerantes a N
2O. De hecho, en humanos, al recibir 30% N
2O, los antagonistas de los receptores de benzodiacepinas redujeron los informes subjetivos de sentirse 'colocados' 34;, pero no alteró el rendimiento psicomotor, en estudios clínicos en humanos.
Efecto analgésico
Los efectos analgésicos de N
2O están vinculados a la interacción entre el sistema opioide endógeno y el sistema noradrenérgico descendente. Cuando los animales reciben morfina de forma crónica, desarrollan tolerancia a sus efectos analgésicos y esto también hace que los animales sean tolerantes a los efectos analgésicos de N
2O. La administración de anticuerpos que se unen y bloquean la actividad de algunos opioides endógenos (no la β-endorfina) también bloquean los efectos antinociceptivos de N
2O. Los fármacos que inhiben la descomposición de los opioides endógenos también potencian los efectos antinociceptivos de N
2O. Varios experimentos han demostrado que los antagonistas de los receptores opioides aplicados directamente al cerebro bloquean los efectos antinociceptivos de N
2O, pero estos medicamentos tienen ningún efecto cuando se inyecta en la médula espinal.
Además de una acción indirecta, el óxido nitroso, como la morfina, también interactúa directamente con el sistema opioide endógeno al unirse a los sitios de unión del receptor opioide.
Por el contrario, los antagonistas de los receptores adrenérgicos α2 bloquean los efectos reductores del dolor de N
2O cuando se administra directamente a la médula espinal, pero no cuando se aplica directamente al cerebro. De hecho, los ratones inactivados para los receptores adrenérgicos α2B o los animales sin noradrenalina son casi completamente resistentes a los efectos antinociceptivos de N
2O. Aparentemente N
2Ola liberación de opioides endógenos provoca la desinhibición de las neuronas noradrenérgicas del tronco encefálico, que liberan norepinefrina en la médula espinal e inhiben señalización del dolor. Exactamente cómo N
2O provoca que la liberación de péptidos opioides endógenos siga siendo incierta.
Propiedades y reacciones
El óxido nitroso es un gas incoloro con un olor suave y dulce.
El óxido nitroso favorece la combustión al liberar el radical de oxígeno unido dipolar y, por lo tanto, puede volver a encender una férula incandescente.
N
2O es inerte a temperatura ambiente y tiene pocas reacciones. A temperaturas elevadas, su reactividad aumenta. Por ejemplo, el óxido nitroso reacciona con NaNH
2 a 460 K (187 °C) para dar NaN
3:
- 2 NaNH
2 + N
2O → Nan
3 + NaOH + NH
3
La reacción anterior es la ruta adoptada por la industria química comercial para producir sales de azida, que se utilizan como detonadores.
Historia
El gas fue sintetizado por primera vez en 1772 por el filósofo natural y químico inglés Joseph Priestley, quien lo llamó aire nitroso desflogistizado (ver teoría del flogisto) o aire nitroso inflamable. Priestley publicó su descubrimiento en el libro Experiments and Observations on Different Kinds of Air (1775), donde describía cómo producir la preparación de "aire nitroso disminuido", calentando limaduras de hierro humedecidas con ácido nítrico.
Uso temprano
El primer uso importante del óxido nitroso fue posible gracias a Thomas Beddoes y James Watt, quienes trabajaron juntos para publicar el libro Consideraciones sobre el uso médico y sobre la producción de aires facticios (1794). Este libro fue importante por dos razones. Primero, James Watt había inventado una nueva máquina para producir "aires ficticios" (incluido el óxido nitroso) y un nuevo "aparato de respiración" para inhalar el gas. En segundo lugar, el libro también presentó las nuevas teorías médicas de Thomas Beddoes, que la tuberculosis y otras enfermedades pulmonares podrían tratarse mediante la inhalación de 'Factitious Airs'.
La máquina para producir "Aires facticios" tenía tres partes: un horno para quemar el material necesario, un recipiente con agua por donde pasaba el gas producido en un tubo en espiral (para que las impurezas se "lavaran"), y finalmente el cilindro de gas con un gasómetro donde el gas producido, el 'aire', podría introducirse en bolsas de aire portátiles (hechas de seda aceitosa hermética). El aparato de respiración consistía en una de las bolsas de aire portátiles conectadas con un tubo a una boquilla. Con la ingeniería y producción de este nuevo equipo en 1794, se allanó el camino para los ensayos clínicos, que comenzaron en 1798 cuando Thomas Beddoes estableció la "Institución neumática para el alivio de enfermedades por Medical Airs" en Hotwells (Brístol). En el sótano del edificio, una máquina a gran escala producía los gases bajo la supervisión de un joven Humphry Davy, a quien se animó a experimentar con nuevos gases para que los pacientes los inhalaran. El primer trabajo importante de Davy fue el examen del óxido nitroso y la publicación de sus resultados en el libro: Researches, Chemical and Philosophical (1800). En esa publicación, Davy señala el efecto analgésico del óxido nitroso en la página 465 y su potencial para ser utilizado en operaciones quirúrgicas en la página 556. Davy acuñó el nombre "gas hilarante" por óxido nitroso.
A pesar del descubrimiento de Davy de que la inhalación de óxido nitroso podía aliviar el dolor de una persona consciente, pasaron otros 44 años antes de que los médicos intentaran utilizarlo para la anestesia. El uso de óxido nitroso como droga recreativa en las "fiestas del gas de la risa", organizadas principalmente para la clase alta británica, se convirtió en un éxito inmediato a partir de 1799. Si bien los efectos del gas generalmente hacen que el usuario parezca estupor, soñadores y sedados, algunas personas también "se ríen" en un estado de euforia, y frecuentemente estalla en carcajadas.
Uno de los primeros productores comerciales en los EE. UU. fue George Poe, primo del poeta Edgar Allan Poe, quien también fue el primero en licuar el gas.
Uso de anestesia
La primera vez que se utilizó el óxido nitroso como fármaco anestésico en el tratamiento de un paciente fue cuando el dentista Horace Wells, con la asistencia de Gardner Quincy Colton y John Mankey Riggs, demostró insensibilidad al dolor por una extracción dental el 11 de diciembre de 1844. En las siguientes semanas, Wells trató a los primeros 12 a 15 pacientes con óxido nitroso en Hartford, Connecticut y, según su propio registro, solo fracasó en dos casos. A pesar de que Wells informó estos resultados convincentes a la sociedad médica de Boston en diciembre de 1844, este nuevo método no fue adoptado de inmediato por otros dentistas. La razón de esto probablemente fue que Wells, en enero de 1845 en su primera demostración pública ante la facultad de medicina en Boston, había fracasado en parte, dejando a sus colegas con dudas sobre su eficacia y seguridad. El método no empezó a generalizarse hasta 1863, cuando Gardner Quincy Colton comenzó a utilizarlo con éxito en toda su "Colton Dental Association" clínicas, que acababa de establecer en New Haven y la ciudad de Nueva York. Durante los tres años siguientes, Colton y sus asociados administraron con éxito óxido nitroso a más de 25 000 pacientes. Hoy en día, el óxido nitroso se utiliza en odontología como ansiolítico, como complemento de la anestesia local.
Sin embargo, no se encontró que el óxido nitroso fuera un anestésico lo suficientemente fuerte para su uso en cirugía mayor en entornos hospitalarios. En cambio, el éter dietílico, al ser un anestésico más fuerte y potente, se demostró y se aceptó para su uso en octubre de 1846, junto con el cloroformo en 1847. Cuando Joseph Thomas Clover inventó el "inhalador de gas-éter" en 1876, sin embargo, se convirtió en una práctica común en los hospitales iniciar todos los tratamientos anestésicos con un flujo suave de óxido nitroso y luego aumentar gradualmente la anestesia con éter o cloroformo más fuerte. El inhalador de gas-éter de Clover fue diseñado para suministrar al paciente óxido nitroso y éter al mismo tiempo, y el operador del dispositivo controla la mezcla exacta. Se mantuvo en uso por muchos hospitales hasta la década de 1930. Aunque los hospitales hoy en día usan una máquina anestésica más avanzada, estas máquinas todavía usan el mismo principio lanzado con el inhalador de gas-éter de Clover, para iniciar la anestesia con óxido nitroso, antes de la administración de un anestésico más potente.
Como medicamento de patente
La popularización del óxido nitroso por parte de Colton condujo a su adopción por parte de un número de charlatanes de mala reputación, quienes lo promocionaron como una cura para la tuberculosis, la escrófula, el catarro y otras enfermedades de la sangre, la garganta y los pulmones. El tratamiento con óxido nitroso fue administrado y autorizado como medicamento patentado por C. L. Blood y Jerome Harris en Boston y Charles E. Barney de Chicago.
Producción
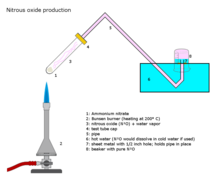
Se publica una revisión de varios métodos para producir óxido nitroso.
Métodos industriales
El óxido nitroso se prepara a escala industrial calentando cuidadosamente el nitrato de amonio a unos 250 °C, que se descompone en óxido nitroso y vapor de agua.
- NH
4NO
3 → 2 H
2O + N
2O
La adición de varias sales de fosfato favorece la formación de un gas más puro a temperaturas ligeramente más bajas. Esta reacción puede ser difícil de controlar y provocar una detonación.
Métodos de laboratorio
La descomposición del nitrato de amonio también es un método de laboratorio común para preparar el gas. De manera equivalente, se puede obtener calentando una mezcla de nitrato de sodio y sulfato de amonio:
- 2 Nano
3 +NH
4)2SO
4 → Na
2SO
4 + 2 N
2O + 4 H
2O
Otro método involucra la reacción de urea, ácido nítrico y ácido sulfúrico:
- 2 (NH2)2CO + 2 HNO
3 + H
2SO
4 → 2 N
2O + 2 CO
2 + (NH4)2SO4 + 2 H
2O
Se ha informado sobre la oxidación directa de amoníaco con un catalizador de dióxido de manganeso-óxido de bismuto: cf. Proceso de Ostwald.
- 2 NH
3 + 2 O
2 → N
2O + 3 H
2O
El cloruro de hidroxilamonio reacciona con el nitrito de sodio para dar óxido nitroso. Si se agrega el nitrito a la solución de hidroxilamina, el único subproducto que queda es agua salada. Sin embargo, si la solución de hidroxilamina se agrega a la solución de nitrito (el nitrito está en exceso), también se forman óxidos de nitrógeno superiores tóxicos:
- NH
3Oh.Cl + Nano
2 → N
2O + NaCl + 2 H
2O
Tratamiento de HNO
3 with SnCl
2 y HCl también se ha demostrado:
- 2 HNO
3 + 8 HCl + 4 SnCl
2 → 5 H
2O + 4 SnCl
4 + N
2O
El ácido hiponitroso se descompone en N2O y agua con una vida media de 16 días a 25 °C a un pH de 1 a 3.
- H2N2O2→ H2O + N2O
Ocurrencia atmosférica
El óxido nitroso es un componente menor de la atmósfera terrestre y es una parte activa del ciclo del nitrógeno planetario. Según el análisis de muestras de aire recolectadas en sitios de todo el mundo, su concentración superó los 330 ppb en 2017. La tasa de crecimiento de aproximadamente 1 ppb por año también se ha acelerado durante las últimas décadas. La abundancia de óxido nitroso en la atmósfera ha aumentado más del 20 % desde un nivel base de alrededor de 270 ppb en el año 1750.
Propiedades atmosféricas importantes de N
2O se resumen en la siguiente tabla:
| Propiedad | Valor |
|---|---|
| Ozono potencial de agotamiento | 0.17 (CCl3F = 1) |
| Global warming potential (GWP: 100-year) | 265 (CO2 = 1) |
| Vida atmosférica | 121 años |
En octubre de 2020, los científicos publicaron una cuantificación completa de N
2O fuentes y sumideros. Informan que las emisiones inducidas por el hombre aumentaron un 30% en las últimas cuatro décadas y son la principal causa del aumento de la concentración atmosférica. El crecimiento reciente ha superado algunos de los escenarios de emisiones más altos proyectados.
Emisiones por fuente
A partir de 2010, se estimó que alrededor de 29,5 millones de toneladas de N
2O (que contiene 18,8 millones de toneladas de nitrógeno) entraban en la atmósfera cada año; de los cuales el 64% fueron naturales y el 36% debido a la actividad humana.
La mayoría de las N
2O emitido a la atmósfera, de fuentes naturales y antropogénicas, es producido por microorganismos como bacterias y hongos desnitrificantes en suelos y océanos. Los suelos bajo vegetación natural son una fuente importante de óxido nitroso, que representa el 60% de todas las emisiones producidas de forma natural. Otras fuentes naturales incluyen los océanos (35%) y las reacciones químicas atmosféricas (5%). Los humedales también pueden ser emisores de óxido nitroso.
Un estudio de 2019 mostró que las emisiones de la descongelación del permafrost son 12 veces más altas de lo que se suponía anteriormente.
Los principales componentes de las emisiones antropogénicas son suelos agrícolas fertilizados y estiércol de ganado (42 %), escorrentía y lixiviación de fertilizantes (25 %), quema de biomasa (10 %), quema de combustibles fósiles y procesos industriales (10 %), degradación de otras emisiones atmosféricas que contienen nitrógeno (9%) y aguas residuales humanas (5%). La agricultura mejora la producción de óxido nitroso a través del cultivo del suelo, el uso de fertilizantes nitrogenados y el manejo de desechos animales. Estas actividades estimulan a las bacterias naturales a producir más óxido nitroso. Las emisiones de óxido nitroso del suelo pueden ser difíciles de medir, ya que varían considerablemente en el tiempo y el espacio, y la mayoría de las emisiones de un año pueden ocurrir cuando las condiciones son favorables durante los "momentos cálidos". y/o en ubicaciones favorables conocidas como "puntos de acceso".
Entre las emisiones industriales, la producción de ácido nítrico y ácido adípico son las mayores fuentes de emisiones de óxido nitroso. Las emisiones de ácido adípico surgen específicamente de la degradación del ácido nítrico intermedio derivado de la nitración de la ciclohexanona.
Procesos biológicos
Los procesos naturales que generan óxido nitroso pueden clasificarse como nitrificación y desnitrificación. Específicamente, incluyen:
- nitrificación autotrófica aeróbica, la oxidación gradual de amoníaco (NH
3Para nitritoNO−
2) y al nitrato (NO−
3) - denitrificación heterotrófica anaeróbica, la reducción gradual NO−
3 a NO−
2, óxido nítrico (NO), N
2O y en última instancia N
2, donde las bacterias de anaerobe facultativas utilizan NO−
3 como receptor de electrones en la respiración de material orgánico en la condición de oxígeno insuficiente (O
2) - denitrificación nitrificadora, que se lleva a cabo por autotrófico NH
3- bacterias oxidantes y la vía por la que amoníaco (amoníaco)NH
3) es oxidado al nitrito (NO−
2), seguido de la reducción de NO−
2 óxido nítrico (NO), N
2O nitrógeno molecularN
2) - nitrificación heterotrófica
- denitrificación aeróbica por los mismos nitrifiers heterotróficos
- fungal denitrification
- química no biológica
Estos procesos se ven afectados por las propiedades químicas y físicas del suelo, como la disponibilidad de nitrógeno mineral y materia orgánica, la acidez y el tipo de suelo, así como por factores relacionados con el clima, como la temperatura del suelo y el contenido de agua.
La emisión del gas a la atmósfera está muy limitada por su consumo en el interior de las células, por un proceso catalizado por la enzima óxido nitroso reductasa.
Impacto ambiental
Efecto invernadero
El óxido nitroso tiene un importante potencial de calentamiento global como gas de efecto invernadero. Por molécula, considerando un período de 100 años, el óxido nitroso tiene 265 veces más capacidad de atrapar calor atmosférico que el dióxido de carbono (CO
2). Sin embargo, debido a su baja concentración (menos de 1/1000 de la de CO
2), su contribución al efecto invernadero es menos de un tercio que el dióxido de carbono, y también menos que el vapor de agua y el metano. Por otro lado, dado que el 38% o más de la N
2O que ingresa a la atmósfera es el resultado de la actividad humana, el control de óxido nitroso se considera parte de los esfuerzos para reducir las emisiones de gases de efecto invernadero.
Un estudio de 2008 realizado por el premio Nobel Paul Crutzen sugiere que la cantidad de liberación de óxido nitroso atribuible a los fertilizantes de nitrato agrícola se ha subestimado seriamente, la mayoría de los cuales, presumiblemente, estarían bajo la liberación al suelo y al océano en los datos de la Agencia de Protección Ambiental. El óxido nitroso se libera a la atmósfera a través de la agricultura, cuando los agricultores agregan fertilizantes a base de nitrógeno en los campos y mediante la descomposición del estiércol animal. Aproximadamente el 79 por ciento de todo el óxido nitroso liberado en los Estados Unidos provino de la fertilización con nitrógeno. La reducción de emisiones puede ser un tema candente en la política del cambio climático.
El óxido nitroso también se libera como subproducto de la quema de combustibles fósiles, aunque la cantidad liberada depende del combustible utilizado. También se emite a través de la fabricación de ácido nítrico, que se utiliza en la síntesis de fertilizantes nitrogenados. La producción de ácido adípico, un precursor del nailon y otras fibras sintéticas para prendas de vestir, también libera óxido nitroso. La cantidad total de óxido nitroso liberado que es de origen humano es de alrededor del 40 por ciento.
Agotamiento de la capa de ozono
El óxido nitroso también se ha implicado en el adelgazamiento de la capa de ozono. Un estudio de 2009 sugirió que N
2O fue la emisión más importante que agotó la capa de ozono y se esperaba que siguiera siendo la mayor a lo largo del siglo XXI.
Legalidad
En los Estados Unidos, la posesión de óxido nitroso es legal según la ley federal y no está sujeta a la competencia de la DEA. Sin embargo, está regulado por la Administración de Alimentos y Medicamentos en virtud de la Ley de Alimentos, Medicamentos y Cosméticos; el enjuiciamiento es posible bajo su "etiquetado erróneo" cláusulas que prohíban la venta o distribución de óxido nitroso con fines de consumo humano. Muchos estados tienen leyes que regulan la posesión, venta y distribución de óxido nitroso. Tales leyes generalmente prohíben la distribución a menores o limitan la cantidad de óxido nitroso que se puede vender sin una licencia especial. Por ejemplo, en el estado de California, la posesión para uso recreativo está prohibida y califica como un delito menor.
En agosto de 2015, el Consejo del distrito londinense de Lambeth (Reino Unido) prohibió el uso de la droga con fines recreativos y exigió a los infractores una multa inmediata de hasta 1000 libras esterlinas.
En Nueva Zelanda, el Ministerio de Salud ha advertido que el óxido nitroso es un medicamento recetado, y su venta o posesión sin receta es un delito según la Ley de Medicamentos. Aparentemente, esta declaración prohibiría todos los usos no medicinales del óxido nitroso, aunque se da a entender que solo el uso recreativo será el objetivo legal.
En India, la transferencia de óxido nitroso de cilindros a granel a tanques tipo E más pequeños y transportables de 1590 litros de capacidad es legal cuando el uso previsto del gas es para anestesia médica.
Contenido relacionado
Hidroxitolueno butilado
Etano
Secado por aspersión