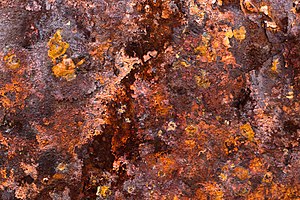Óxido
El óxido es un óxido de hierro, un óxido generalmente de color marrón rojizo formado por la reacción del hierro y el oxígeno en la presencia catalítica de agua o humedad del aire. La herrumbre consiste en óxidos de hierro (III) hidratados (Fe2O3·nH2O) y óxido-hidróxido de hierro (III) (FeO (OH), Fe(OH)3), y normalmente se asocia con la corrosión del hierro refinado.
Dado el tiempo suficiente, cualquier masa de hierro, en presencia de agua y oxígeno, podría eventualmente convertirse por completo en óxido. El óxido de la superficie suele ser escamoso y friable, y no brinda protección de pasivación al hierro subyacente, a diferencia de la formación de pátina en las superficies de cobre. La oxidación es el término común para la corrosión del hierro elemental y sus aleaciones, como el acero. Muchos otros metales experimentan una corrosión similar, pero los óxidos resultantes no se denominan comúnmente "óxido".
Varias formas de óxido se distinguen tanto visualmente como por espectroscopia, y se forman en diferentes circunstancias. Otras formas de óxido incluyen el resultado de reacciones entre el hierro y el cloruro en un ambiente privado de oxígeno. La barra de refuerzo utilizada en pilares de hormigón bajo el agua, que genera óxido verde, es un ejemplo. Aunque la oxidación es generalmente un aspecto negativo del hierro, una forma particular de oxidación, conocida como óxido estable, hace que el objeto tenga una fina capa de óxido en la parte superior. Si se mantiene en una humedad relativa baja, hace que el "estable" capa protectora para el hierro que se encuentra debajo, pero no en la medida de otros óxidos como el óxido de aluminio sobre aluminio.
Reacciones químicas
El óxido es un nombre general para un complejo de óxidos e hidróxidos de hierro, que se produce cuando el hierro o algunas aleaciones que contienen hierro se exponen al oxígeno y la humedad durante un largo período de tiempo. Con el tiempo, el oxígeno se combina con el metal formando nuevos compuestos llamados colectivamente óxido. Aunque el óxido generalmente puede denominarse "oxidación", ese término es mucho más general y describe una gran cantidad de procesos que implican la pérdida de electrones o el aumento del estado de oxidación, como parte de una reacción. La más conocida de estas reacciones involucra oxígeno, de ahí el nombre de "oxidación". Los términos "óxido" y "oxidándose" sólo significa oxidación del hierro y sus productos resultantes. Existen muchas otras reacciones de oxidación que no involucran hierro ni producen herrumbre. Pero solo el hierro o las aleaciones que contienen hierro pueden oxidarse. Sin embargo, otros metales pueden corroerse de manera similar.
El principal catalizador del proceso de oxidación es el agua. Las estructuras de hierro o acero pueden parecer sólidas, pero las moléculas de agua pueden penetrar las picaduras y grietas microscópicas en cualquier metal expuesto. Los átomos de hidrógeno presentes en las moléculas de agua pueden combinarse con otros elementos para formar ácidos, lo que eventualmente hará que se exponga más metal. Si los iones de cloruro están presentes, como es el caso del agua salada, es probable que la corrosión ocurra más rápidamente. Mientras tanto, los átomos de oxígeno se combinan con átomos metálicos para formar el compuesto de óxido destructivo. A medida que los átomos se combinan, debilitan el metal, haciendo que la estructura se vuelva quebradiza y quebradiza.
Oxidación de hierro
Cuando el hierro está en contacto con el agua y el oxígeno, se oxida. Si la sal está presente, por ejemplo en agua de mar o niebla salina, el hierro tiende a oxidarse más rápidamente, como resultado de reacciones químicas. El hierro metálico es relativamente poco afectado por el agua pura o por el oxígeno seco. Al igual que con otros metales, como el aluminio, una capa de óxido fuertemente adherida, una capa de pasivación, protege el hierro a granel de una mayor oxidación. La conversión de la capa pasivante de óxido ferroso en herrumbre resulta de la acción combinada de dos agentes, generalmente oxígeno y agua.
Otras soluciones degradantes son el dióxido de azufre en el agua y el dióxido de carbono en el agua. Bajo estas condiciones corrosivas, se forman especies de hidróxido de hierro. A diferencia de los óxidos ferrosos, los hidróxidos no se adhieren al metal a granel. A medida que se forman y se desprenden de la superficie, el hierro fresco queda expuesto y el proceso de corrosión continúa hasta que se consume todo el hierro o se elimina o consume todo el oxígeno, el agua, el dióxido de carbono o el dióxido de azufre del sistema.
Cuando el hierro se oxida, los óxidos toman más volumen que el metal original; esta expansión puede generar enormes fuerzas, dañando las estructuras hechas con hierro. Ver efecto económico para más detalles.
Reacciones asociadas
La oxidación del hierro es un proceso electroquímico que comienza con la transferencia de electrones del hierro al oxígeno. El hierro es el agente reductor (cede electrones) mientras que el oxígeno es el agente oxidante (gana electrones). La tasa de corrosión se ve afectada por el agua y acelerada por los electrolitos, como lo ilustran los efectos de la sal de las carreteras en la corrosión de los automóviles. La reacción clave es la reducción de oxígeno:
- O2 + 4e− + 2H2O → 4Oh-
Debido a que forma iones de hidróxido, este proceso se ve fuertemente afectado por la presencia de ácido. Asimismo, la corrosión de la mayoría de los metales por el oxígeno se acelera a pH bajo. Proporcionar los electrones para la reacción anterior es la oxidación del hierro que se puede describir de la siguiente manera:
- Fe → Fe2+ + 2e−
La siguiente reacción redox también ocurre en presencia de agua y es crucial para la formación de óxido:
- 4 Fe2+ + O2 → 4 Fe3+ + 2 O2 - 2
Además, las siguientes reacciones ácido-base de múltiples pasos afectan el curso de la formación de óxido:
- Fe2+ + 2 H2O ⇌ Fe(OH)2 + 2H+
- Fe3+ + 3 H2O ⇌ Fe(OH)3 + 3H+
al igual que los siguientes equilibrios de deshidratación:
- Fe(OH)2 ⇌ FeO + H2O
- Fe(OH)3 ⇌ FeO(OH) + H2O
- 2 FeO(OH) ⇌ Fe2O3 + H2O
De las ecuaciones anteriores, también se ve que los productos de corrosión están dictados por la disponibilidad de agua y oxígeno. Con oxígeno disuelto limitado, se prefieren los materiales que contienen hierro (II), incluidos FeO y magnetita negra o magnetita (Fe3O4). Las altas concentraciones de oxígeno favorecen los materiales férricos con las fórmulas nominales Fe(OH)3−xOx⁄2. La naturaleza del óxido cambia con el tiempo, lo que refleja las bajas velocidades de las reacciones de los sólidos.
Además, estos procesos complejos se ven afectados por la presencia de otros iones, como Ca2+, que sirven como electrolitos que aceleran la formación de óxido, o se combinan con los hidróxidos y óxidos de hierro para precipitar una variedad de Ca, Fe, O, especies OH.
El inicio de la oxidación también se puede detectar en el laboratorio con el uso de solución indicadora de ferroxilo. La solución detecta tanto iones Fe2+ como iones hidroxilo. La formación de iones Fe2+ e iones hidroxilo se indica mediante parches azules y rosas respectivamente.
Prevención
Debido al uso generalizado y la importancia de los productos de hierro y acero, la prevención o ralentización de la oxidación es la base de las principales actividades económicas en una serie de tecnologías especializadas. Aquí se presenta una breve descripción general de los métodos; para una cobertura detallada, consulte los artículos con referencias cruzadas.
El óxido es permeable al aire y al agua, por lo que el hierro metálico interior debajo de una capa de óxido continúa corroyéndose. Por lo tanto, la prevención del óxido requiere recubrimientos que impidan la formación de óxido.
Aleaciones resistentes al óxido
El acero inoxidable forma una capa de pasivación de óxido de cromo (III). Un comportamiento de pasivación similar ocurre con magnesio, titanio, zinc, óxidos de zinc, aluminio, polianilina y otros polímeros conductores electroactivos.
Especial "acero resistente a la intemperie" Las aleaciones como Cor-Ten se oxidan a un ritmo mucho más lento de lo normal, porque el óxido se adhiere a la superficie del metal en una capa protectora. Los diseños que utilizan este material deben incluir medidas que eviten las exposiciones en el peor de los casos, ya que el material continúa oxidándose lentamente incluso en condiciones casi ideales.
Galvanización
La galvanización consiste en la aplicación sobre el objeto a proteger de una capa de zinc metálico ya sea por galvanización en caliente o galvanoplastia. El zinc se usa tradicionalmente porque es barato, se adhiere bien al acero y brinda protección catódica a la superficie del acero en caso de daño de la capa de zinc. En ambientes más corrosivos (como el agua salada), se prefiere el revestimiento de cadmio. La galvanización a menudo falla en las costuras, agujeros y juntas donde hay espacios en el revestimiento. En estos casos, el recubrimiento aún brinda cierta protección catódica parcial al hierro, al actuar como un ánodo galvánico y corroerse a sí mismo en lugar del metal protegido subyacente. La capa protectora de zinc se consume por esta acción y, por lo tanto, la galvanización brinda protección solo por un período de tiempo limitado.
Los revestimientos más modernos añaden aluminio al revestimiento como zinc-alume; el aluminio migrará para cubrir los rasguños y, por lo tanto, brindará protección por un período más prolongado. Estos enfoques se basan en los óxidos de aluminio y zinc que protegen una superficie que alguna vez se rayó, en lugar de oxidarse como un ánodo de sacrificio como en los recubrimientos galvanizados tradicionales. En algunos casos, como en ambientes muy agresivos o una vida útil prolongada, se aplican zinc y un revestimiento para brindar una mayor protección contra la corrosión.
La galvanización típica de los productos de acero que se van a someter a la intemperie normal del día a día en un ambiente exterior consiste en un recubrimiento de zinc de 85 µm por inmersión en caliente. En condiciones climáticas normales, esto se deteriorará a un ritmo de 1 µm por año, lo que brinda aproximadamente 85 años de protección.
Protección catódica
La protección catódica es una técnica utilizada para inhibir la corrosión en estructuras enterradas o sumergidas mediante el suministro de una carga eléctrica que suprime la reacción electroquímica. Si se aplica correctamente, la corrosión se puede detener por completo. En su forma más simple, se logra adjuntando un ánodo de sacrificio, lo que hace que el hierro o el acero sean el cátodo en la celda formada. El ánodo de sacrificio debe estar hecho de algo con un potencial de electrodo más negativo que el hierro o el acero, comúnmente zinc, aluminio o magnesio. El ánodo de sacrificio eventualmente se corroerá, cesando su acción protectora a menos que se reemplace de manera oportuna.
También se puede proporcionar protección catódica mediante el uso de una corriente eléctrica aplicada. Esto se conocería entonces como protección catódica de corriente impresa ICCP.
Recubrimientos y pintura
La formación de óxido se puede controlar con revestimientos, como pintura, laca, barniz o cintas de cera que aíslan el hierro del medio ambiente. Las estructuras grandes con secciones en caja cerradas, como los barcos y los automóviles modernos, a menudo tienen un producto a base de cera (técnicamente, un "aceite para aguanieve") inyectado en estas secciones. Estos tratamientos suelen contener también inhibidores de la oxidación. Recubrir el acero con concreto puede brindar cierta protección al acero debido al entorno de pH alcalino en la interfaz acero-concreto. Sin embargo, la oxidación del acero en el hormigón puede seguir siendo un problema, ya que la expansión del óxido puede fracturar el hormigón desde dentro.
Como ejemplo estrechamente relacionado, se usaron abrazaderas de hierro para unir bloques de mármol durante un intento de restauración del Partenón en Atenas, Grecia, en 1898, pero causaron grandes daños al mármol debido a la oxidación e hinchazón del hierro sin protección. Los antiguos constructores griegos habían utilizado un sistema de sujeción similar para los bloques de mármol durante la construcción, sin embargo, también vertieron plomo fundido sobre las juntas de hierro para protegerlos de los golpes sísmicos y de la corrosión. Este método fue exitoso para la estructura de 2500 años de antigüedad, pero en menos de un siglo las reparaciones rudimentarias estaban en peligro inminente de colapso.
Cuando solo se necesita una protección temporal para el almacenamiento o el transporte, se puede aplicar una capa delgada de aceite, grasa o una mezcla especial como Cosmoline a una superficie de hierro. Dichos tratamientos se utilizan ampliamente cuando se "suspende la naftalina" un barco de acero, automóvil u otro equipo para almacenamiento a largo plazo.
Hay disponibles mezclas especiales de lubricantes antiagarrotamiento que se aplican a roscas metálicas y otras superficies maquinadas con precisión para protegerlas del óxido. Estos compuestos generalmente contienen grasa mezclada con polvo de cobre, zinc o aluminio y otros ingredientes patentados.
Blanqueado
El pavonado es una técnica que puede proporcionar una resistencia limitada a la oxidación de artículos de acero pequeños, como armas de fuego; para que tenga éxito, se frota un aceite que desplaza el agua sobre el acero pavonado y otro acero.
Inhibidores
Los inhibidores de la corrosión, como los inhibidores volátiles o de fase gaseosa, se pueden usar para prevenir la corrosión dentro de los sistemas sellados. No son efectivos cuando la circulación del aire los dispersa y trae oxígeno fresco y humedad.
Control de humedad
La oxidación se puede evitar controlando la humedad en la atmósfera. Un ejemplo de esto es el uso de paquetes de gel de sílice para controlar la humedad en equipos enviados por mar.
Tratamiento
La eliminación de óxido de pequeños objetos de hierro o acero mediante electrólisis se puede realizar en un taller doméstico utilizando materiales simples, como un balde de plástico lleno de un electrolito que consiste en soda de lavado disuelta en agua del grifo, una barra de refuerzo suspendida verticalmente en la solución para actuar como un ánodo, otro colocado en la parte superior de la cubeta para actuar como soporte para suspender el objeto, alambre para empacar para suspender el objeto en la solución de la barra de refuerzo horizontal, y un cargador de batería como fuente de energía en la que el positivo El terminal se sujeta al ánodo y el terminal negativo se sujeta al objeto a tratar, que se convierte en el cátodo.
El óxido se puede tratar con productos comerciales conocidos como convertidores de óxido que contienen ácido tánico o ácido fosfórico que se combina con el óxido; eliminado con ácidos orgánicos como ácido cítrico y vinagre o el ácido clorhídrico más fuerte; o eliminado con agentes quelantes como en algunas formulaciones comerciales o incluso una solución de melaza.
Efecto económico
El óxido está asociado con la degradación de herramientas y estructuras a base de hierro. Dado que el óxido tiene un volumen mucho mayor que la masa original de hierro, su acumulación también puede causar fallas al forzar la separación de las piezas adyacentes, un fenómeno que a veces se conoce como "empaquetamiento de óxido". Fue la causa del colapso del puente sobre el río Mianus en 1983, cuando los cojinetes se oxidaron internamente y empujaron una esquina de la losa de la carretera fuera de su soporte.
El óxido fue un factor importante en el desastre de Silver Bridge de 1967 en Virginia Occidental, cuando un puente colgante de acero se derrumbó en menos de un minuto, matando a 46 conductores y pasajeros en el puente en ese momento. El puente Kinzua en Pensilvania fue derribado por un tornado en 2003, en gran parte porque los pernos de la base central que sujetaban la estructura al suelo se habían oxidado, dejando el puente anclado únicamente por la gravedad.
El hormigón armado también es vulnerable al daño por oxidación. La presión interna causada por la corrosión expansiva del acero y el hierro recubiertos de hormigón puede hacer que el hormigón se astille, creando graves problemas estructurales. Es uno de los modos de falla más comunes de los puentes y edificios de hormigón armado.
- Fallos estructurales causados por el óxido
Simbolismo cultural
El óxido es una metáfora comúnmente utilizada para la descomposición lenta debido a la negligencia, ya que convierte gradualmente el metal de hierro y acero robusto en un polvo suave que se desmorona. Una amplia sección del Medio Oeste y el Noreste de los Estados Unidos industrializados, una vez dominada por las fundiciones de acero, la industria automotriz y otros fabricantes, ha experimentado severos recortes económicos que han causado que la región sea apodada el 'Rust Belt'.
En la música, la literatura y el arte, el óxido se asocia con imágenes de gloria marchita, abandono, decadencia y ruina.
Contenido relacionado
Cera parafina
Base
Éter