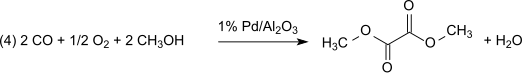Oxalato de dimetilo
El oxalato de dimetilo es un compuesto orgánico con la fórmula (CO2CH3)2 o (CH3)2C2O4. Es el éster dimetílico del ácido oxálico. El oxalato de dimetilo es un sólido incoloro o blanco que es soluble en agua.
Producción
El oxalato de dimetilo se puede obtener mediante la esterificación del ácido oxálico con metanol utilizando ácido sulfúrico como catalizador:
Ruta de carbonización oxidativa
La preparación por carbonilación oxidativa ha despertado interés porque sólo requiere precursores C1:
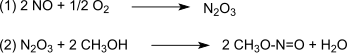
La reacción es catalizada por Pd2+. El gas de síntesis se obtiene principalmente a partir de carbón o biomasa. La oxidación se lleva a cabo a través del trióxido de dinitrógeno, que se forma según (1) a partir de monóxido de nitrógeno y oxígeno y luego reacciona según (2) con metanol formando nitrito de metilo:
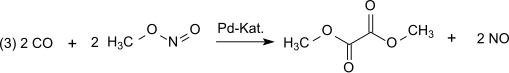
En el siguiente paso de la dicarbonilación (3), el monóxido de carbono reacciona con el nitrito de metilo para formar oxalato de dimetilo en fase de vapor a presión atmosférica y temperaturas de 80-120 °C sobre un catalizador de paladio:
La ecuación de la suma:
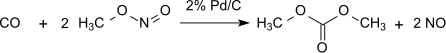
Este método no tiene pérdidas con respecto al nitrito de metilo, que actúa prácticamente como portador de equivalentes de oxidación. Sin embargo, el agua formada debe eliminarse para evitar la hidrólisis del producto oxalato de dimetilo. Con 1% Pd/α-Al2O3 se produce oxalato de dimetilo selectivamente en una reacción de dicarbonilación, en las mismas condiciones con 2% Pd/C se produce carbonato de dimetilo por monocarbonilación:
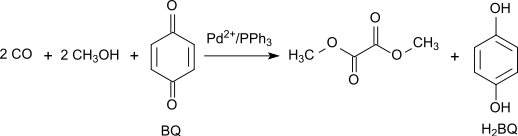
Alternativamente, la carbonilación oxidativa del metanol se puede llevar a cabo con alto rendimiento y selectividad con 1,4-benzoquinona como oxidante en el sistema Pd(OAc)2/PPh3/benzoquinona con relación de masas 1/3/100 a 65 °C y 70 atm de CO:
Reacciones
El oxalato de dimetilo (y el éster dietílico relacionado) se utiliza en diversas reacciones de condensación. Por ejemplo, el oxalato de dietilo se condensa con ciclohexanona para dar el dicetoéster, un precursor del ácido pimélico. Con las diaminas, los diésteres del ácido oxálico se condensan para dar diamidas cíclicas. La quinoxalinediona se produce por condensación de oxalato de dimetilo y o-fenilendiamina:
- C2O2(OMe)2 + C6H4(NH)2)2 → C6H4(NHCO)2 + 2 MeOH
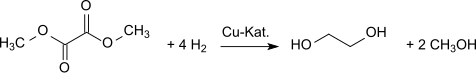
La hidrogenación produce etilenglicol. El oxalato de dimetilo se puede convertir en etilenglicol con altos rendimientos (94,7 %)
El metanol formado se recicla en el proceso de carbonilación oxidativa. Se prevé la construcción de otras plantas con una capacidad anual total de más de 1 millón de toneladas de etilenglicol al año.
La descarbonilación produce carbonato de dimetilo.
El oxalato de difenilo se obtiene por transesterificación con fenol en presencia de catalizadores de titanio, que se descarbonila a su vez a carbonato de difenilo en fase líquida o gaseosa.
El oxalato de dimetilo también se puede utilizar como agente metilante. Es notablemente menos tóxico que otros agentes metilantes como el yoduro de metilo o el sulfato de dimetilo.
Referencias
- ^ a b P. T. Sah and S-L. Chien, Journal of the American Chemical Society, 1931, 53, 3901-3903.
- ^ Everett Bowden (1930). "Metil Oxalato". Sintetías orgánicas. 10: 78. doi:10.15227/orgsyn.010.0078.
- ^ Hans-Jürgen Arpe: Industria orgánica Chemie: Bedeutende Vor- und Zwischenprodukte, S. 168; ISBN 978-3-527-31540-6.
- ^ US 4467109, Susumu Tahara et al., "Process for Continuous preparation of diester of oxalic acid", publicado 1983-05-19, asignado a Ube Industries y EP 108359, K. Masunaga et al., "Proceso para la preparación de un diester de ácido oxálico", asignado a Industrias UbeEP 425197, K. Nishihira & K. Mizutare, "Proceso para la preparación del diester de ácido carbónico", publicado 1991-05-2, asignado a Ube IndustriesUS 4451666, J.A. Sofranko, A.M. Gaffney, "Synthesis of oxalate esters by the oxidative carbonylation of alcohols", publicado 1984-05-29, asignado a Atlantic Richfield Co.
- ^ a b E. Amadio: Carbonilación oxidativa de Alkanols Catalyzed by Pd(II)-Phosphine Complexes, PhD Thesis, Ca'Foscari University Venice, 2009
- ^ X.-Z. Jiang, Palladium apoyó catalizadores en CO + RONO Reacciones, Platinum Metals Rev., 1990, 1990, 34, (4), 178–180
- ^ Bergman, Jan; Norrby, Per-Ola; Sand, Peter (1990). "Alquilamiento con Esteres Oxálicos. Ámbito y mecanismo". Tetraedro. 46 (17): 6113 –6124. doi:10.1016/S0040-4020(01)87933-3. S2CID 94945519.
- ^ H. R. Snyder; L. A. Brooks; S. H. Shapiro; A. Müller (1931). "Ácido piólico". Sintetías orgánicas. 11: 42. doi:10.15227/orgsyn.011.0042.
- ^ Nexant/Chemsystems, "Coal to MEG, Changing the Rules of the Game" (PDF). Archivado desde el original el 14 de julio de 2011. Retrieved 2016-08-08.
{{cite web}}: CS1 maint: bot: original URL status unknown (link) (PDF; 5,4 MB), 2011 Prospectus - ^ 983 EP 046 983, S. Tahara et al., "Proceso para la preparación continua de etileno glycol", asignado a Industrias Ube H. T. Teunissen y C. J. Elsevier, Ruthenium catalyzed hidrógenoation of dimethyl oxalate to etilelene glycol, J. Chem. Soc., Chem. Commun., 1997, 667-668), DOI:10.1039/A700862G.
- ^ S. Zhang et al., Catalysts con base de cobre de alta dispersión de Cu–Zn–Precursor de doble hidroxido con capas para la hidrogenación con gas de dosis oxalato a Etileno Glycol, Cartas de Catalisis, Sept. 2012, 142 (9), 1121–1127, DOI:10.1007/s10562-012-0871-8
- ^ "Noticias individuales".
- ^ US 4544507, P. Foley, "Production of carbonate diesters from oxalate diesters", assigned to Celanese Corp
- ^ US 5834614, K. Nishihira et al., "Process for producing diaryl carbonate", asignado a Ube Industries, Ltd. y X.B. Ma et al., Preparación de oxalato de difenilo de transesterificación de dimetil oxalato con fenol sobre TS-1 CatalystLett. 14 (5), 461–464 (2003), DOI:10.1016/s0378-3820(03)00075-4.
- ^ Bergman, Jan; Norrby, Per-Ola; Sand, Peter (1990-01-01). "Alquilamiento con Esteres Oxálicos. Ámbito y mecanismo". Tetraedro. 46 (17): 6113 –6124. doi:10.1016/S0040-4020(01)87933-3. ISSN 0040-4020. S2CID 94945519.