Oxalato de calcio
El oxalato de calcio (en terminología arcaica, oxalato de cal) es una sal de calcio del ácido oxálico con la fórmula química CaC2O4. Forma hidratos CaC2O4·nH2O, donde n varía de 1 a 3. Anhidro y todo hidratado las formas son incoloras o blancas. El monohidrato CaC2O4·H2O se presenta naturalmente como el mineral whewellita, formando cristales en forma de sobre, conocidos en las plantas como rafidios. Los dos hidratos más raros son el dihidrato CaC2O4·2H2O, que se presenta naturalmente como el mineral weddellita y trihidrato CaC2 O4·3H2O, que se presenta naturalmente como el mineral caoxita, también son reconocidos. Algunos alimentos tienen altas cantidades de oxalatos de calcio y pueden producir llagas y adormecimiento al ingerirlos e incluso pueden ser fatales. Los grupos culturales con dietas que dependen en gran medida de frutas y verduras con alto contenido de oxalato de calcio, como los de Micronesia, reducen el nivel hirviéndolos y cocinándolos. Son un componente en el 76% de los cálculos renales humanos. El oxalato de calcio también se encuentra en la piedra de cerveza, una incrustación que se forma en los recipientes que se usan en las cervecerías.
Ocurrencia
Muchas plantas acumulan oxalato de calcio como se ha informado en más de 1000 géneros diferentes de plantas. La acumulación de oxalato de calcio está relacionada con la detoxificación del calcio (Ca2+) en la planta. Tras la descomposición, el oxalato de calcio es oxidado por bacterias, hongos o incendios forestales para producir el carbonato de calcio, un nutriente para el suelo.
La planta venenosa caña muda (Dieffenbachia) contiene la sustancia y al ingerirla puede impedir el habla y ser asfixiante. También se encuentra en acedera, ruibarbo (en grandes cantidades en las hojas), canela, cúrcuma y en especies de Oxalis, Araceae, Arum italicum, malanga, kiwi, té hojas, agaves, enredadera de Virginia (Parthenocissus quinquefolia), y Alocasia y en espinacas en cantidades variables. Las plantas del género Philodendron contienen suficiente oxalato de calcio que el consumo de partes de la planta puede provocar síntomas incómodos. Los cristales de oxalato de calcio insolubles se encuentran en los tallos, raíces y hojas de las plantas y se producen en los idioblastos. Las plantas de vainilla exudan oxalatos de calcio al cosechar las vainas de las semillas de orquídeas y pueden causar dermatitis de contacto.
El oxalato de calcio, como "piedra de cerveza", es un precipitado de color marrón que tiende a acumularse dentro de las cubas, barriles y otros recipientes utilizados en la elaboración de cerveza. Si no se elimina en un proceso de limpieza, la piedra de cerveza dejará una superficie insalubre que puede albergar microorganismos. Beerstone se compone de sales de calcio y magnesio y varios compuestos orgánicos sobrantes del proceso de elaboración de la cerveza; promueve el crecimiento de microorganismos no deseados que pueden afectar negativamente o incluso arruinar el sabor de un lote de cerveza.
Los cristales de oxalato de calcio en la orina son el componente más común de los cálculos renales humanos, y la formación de cristales de oxalato de calcio también es uno de los efectos tóxicos del envenenamiento con etilenglicol.
Propiedades químicas
El oxalato de calcio es una combinación de iones de calcio y la base conjugada del ácido oxálico, el anión oxalato. Sus soluciones acuosas son ligeramente básicas debido a la basicidad del ion oxalato. La basicidad del oxalato de calcio es más débil que la del oxalato de sodio, debido a su menor solubilidad en agua. El hidrato de oxalato de calcio sólido se ha caracterizado por cristalografía de rayos X. Es un polímero de coordinación que presenta aniones de oxalato planos unidos al calcio, que también tiene ligandos de agua.
Importancia médica
El oxalato de calcio puede producir llagas y adormecimiento al ingerirlo e incluso puede ser fatal.
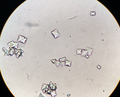
Morfología y diagnóstico
El monohidrato y el dihidrato se pueden distinguir por la forma de los respectivos cristales.
- Calcio oxalato dihydrate los cristales son octaedral. Una gran parte de los cristales en un sedimento de orina tendrá este tipo de morfología, ya que pueden crecer en cualquier pH y ocurren naturalmente en la orina normal.
- Calcio oxalato monohidratos Los cristales varían en forma, y pueden ser moldeados como muñecos, husillos, ovalados o cercas de piquete, el último de los cuales se ve más comúnmente debido a la intoxicación por etileno.
Piedras renales
Alrededor del 76 % de los cálculos renales son parcial o totalmente del tipo de oxalato de calcio. Se forman cuando la orina está persistentemente saturada de calcio y oxalato. Entre el 1% y el 15% de las personas en todo el mundo se ven afectadas por cálculos renales en algún momento. En 2015 causaron unas 16.000 muertes en todo el mundo.
Parte del oxalato en la orina es producido por el cuerpo. El calcio y el oxalato en la dieta juegan un papel, pero no son los únicos factores que afectan la formación de cálculos de oxalato de calcio. El oxalato dietético es un ion orgánico que se encuentra en muchas verduras, frutas y nueces. El calcio de los huesos también puede desempeñar un papel en la formación de cálculos renales.
En un estudio de moduladores de la cristalización de oxalato de calcio en la orina, se demostró que el citrato de magnesio y álcali inhibe la cristalización de CaOx (oxalato de calcio), "probablemente a través de las acciones del citrato, pero no del Mg". Esto fue en comparación con el magnesio, el citrato y el citrato de magnesio. Actualmente, la preparación de citrato de magnesio y potasio que se usó en un estudio positivo no está disponible en los Estados Unidos.
Aplicaciones industriales
El oxalato de calcio se utiliza en la fabricación de esmaltes cerámicos.
Contenido relacionado
Benjamín Silliman
Punto de inflamabilidad
Yen Chia-kan