Nitrosobenceno
El nitrosobenceno es un compuesto orgánico con la fórmula C6H5NO. Es uno de los compuestos nitrosos orgánicos prototípicos. Característico de su grupo funcional, es una especie verde oscura que existe en equilibrio con su dímero amarillo pálido. Tanto el monómero como el dímero son diamagnéticos.
Equilibrio Monomer-dimer
El nitrosobenceno y otros nitrosoarenos suelen participar en un equilibrio monómero-dímero. Los dímeros suelen ser los preferidos en estado sólido, mientras que los monómeros de colores intensos son los preferidos en solución diluida o a temperaturas más altas. Los dímeros pueden formularse como Ar(O−)N+=N+(O−)Ar. Existen como isómeros cis y trans debido a la presencia del doble enlace N–N. Los dímeros a veces se denominan azobencenodióxidos. La isomerización cis-trans se produce a través de la intermediación del monómero.
En el caso del propio nitrosobenceno, la forma monomérica metaestable podría prepararse por sublimación sobre un dedo frío. El material monomérico se sublima selectivamente debido a su menor peso molecular y se recoge sobre un dedo frío en forma de cristales brillantes de color verde oscuro. Con el tiempo, el material monomérico se dimeriza para dar lugar al dióxido de azobenceno original en forma de un sólido de color amarillo pálido. Como dicta el principio de Le Chatelier, el nitrosobenceno existe en la fase de solución como una mezcla de monómero y dímero en equilibrio dinámico cuya composición depende de la temperatura (el monómero se ve favorecido a mayor temperatura) y la concentración (el monómero se ve favorecido a baja concentración), así como de la identidad del medio (fase gaseosa o disolvente).

Preparación
El nitrosobenzeno fue preparado por primera vez por Adolf von Baeyer mediante la reacción de difenilmercurio y bromuro de nitrosilo:
- (C)6H5)2Hg + BrNO → C6H5NO + C6H5HgBr
Una síntesis moderna implica la reducción del nitrobenceno a fenilhidroxilamina (C6H5NHOH) que luego se oxida con dicromato de sodio (Na2Cr2O7).
El nitrosobenzeno también se puede preparar por oxidación de anilina utilizando ácido peroximonosulfúrico (ácido de Caro) o peroximonosulfato de potasio en condiciones bifásicas. Generalmente se purifica por sublimación o por destilación al vapor, donde se presenta como un líquido verde que se solidifica hasta convertirse en un sólido incoloro.
Reacciones características
El nitrosobenceno experimenta reacciones de Diels-Alder con dienos. La condensación con anilinas produce derivados de azobenceno en una reacción conocida como reacción de Mills o reacción de Baeyer-Mills. La reducción del nitrosobenceno produce anilina.
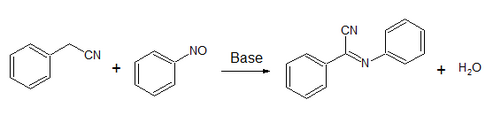
Lo más característico es que el nitrosobenceno se condensa con grupos metileno activos, como los de los ésteres malónicos y el fenilacetonitrilo. El fenilacetonitrilo (PhCH2CN) da la imina (PhC(CN)=NPh) en una reacción conocida como la reacción de Ehrlich-Sachs:
A veces, la condensación con compuestos de metileno activos da lugar a productos de la reacción O-nitroso-aldólica:
- R-CH2-CHO + Ph–NO → R–CH(CHO)–O–NHPhaminoxylation adduct)
Referencias
- ^ Beaudoin, D.; Wuest, J. D. (2016). "Dimerization of Aromatic C-Nitroso Compounds". Reseñas químicas. 116 (1): 258–286. doi:10.1021/cr500520s. PMID 26730505.
- ^ Varga, Katarina; Biljan, Ivana; Tomišić, Vladislav; Mihalić, Zlatko; Vančik, Hrvoj (8 de marzo de 2018). "Cálculos Quantum Quantum Chemical de Monomer-Dimer Equilibria of Aromatic C -Nitroso Compounds". El Diario de Química Física A. 122 (9): 2542–2549. código:2018JPCA..122.2542V. doi:10.1021/acs.jpca.7b12179. ISSN 1089-5639. PMID 29381362.
- ^ E.Bosch (2014). "Análisis estructural de los nitrosobencenos sustituidos por metil y de los nitrosoanisoles". J. Chem. Cryst. 98 (2): 44. doi:10.1007/s10870-013-0489-8. S2CID 95291018.
- ^ Baeyer, A. (1874). "Nitrosobenzol und Nitrosonaphtalin". Chemische Berichte. 7 (2): 1638-1640. doi:10.1002/cber.187400702214.
- ^ G. H. Coleman, C. M. McCloskey, F. A. Stuart (1945). "Nitrosobenzene". Org. Synth. 25: 80. doi:10.15227/orgsyn.025.0080.
{{cite journal}}: CS1 maint: múltiples nombres: lista de autores (link) - ^ Caro, Heinrich (1898). "Hauptversammlung des Vereins deutscher Chemiker am 1. bis 4. Juni 1898 zu Darmstadt". Zeitschrift für Angewandte Chemie. 11 (36): 845ff. Bibcode:1898AngCh..11..815.. doi:10.1002/ange.18980113602.
- ^ Priewisch, Beate; Rück-Braun, Karola (marzo de 2005). "Eficiente Preparación de Nitrosoarenes para la Síntesis de Azobencenos†". The Journal of Organic Chemistry. 70 (6): 2350–2352. doi:10.1021/jo048544x. ISSN 0022-3263. PMID 15760229.
- ^ Yamamoto, Hisashi; Momiyama, Norie (2005). "La química de los compuestos de nitroso". Comunicaciones químicas (28): 3514–3525. doi:10.1039/b503212c. PMID 16010311.
- ^ H. D. Anspon (1955). "p-Phenylazobenzoic Acid". Sintetías orgánicas; Volumenes recogidos, vol. 3, pág. 711.
- ^ H. Feuer. S. Patai (ed.). La química de los grupos Nitro y Nitroso Parte 1. Nueva York: Wiley. págs. 278 a 283.
- ^ "Asymmetric O y N− Nitroso Aldol Reaction – un acceso eficiente a un compuesto de carbono aoxi y amino" (PDF).