Nitrito
El ion nitrito tiene la fórmula química NO−
2. El nitrito (principalmente nitrito de sodio) se usa ampliamente en las industrias química y farmacéutica. El anión nitrito es un intermediario omnipresente en el ciclo del nitrógeno en la naturaleza. El nombre nitrito también se refiere a compuestos orgánicos que tienen el grupo –ONO, que son ésteres de ácido nitroso.
Producción
El nitrito de sodio se produce industrialmente pasando una mezcla de óxidos de nitrógeno a una solución acuosa de hidróxido de sodio o carbonato de sodio:
- NO + NO2 + 2 NaOH → 2 NaNO2 + H2O
- NO + NO2 + Na2CO3 → 2 NaNO2 + CO2
El producto se purifica mediante recristalización. Los nitritos de metales alcalinos son térmicamente estables hasta su punto de fusión y más allá (441 °C para KNO2). El nitrito de amonio se puede obtener a partir de trióxido de dinitrógeno, N2O3, que formalmente es el anhídrido del ácido nitroso:
- 2 NH3 + H2O + N2O3 → 2 NH4NO2
Estructura

2, que contribuyen al híbrido de resonancia para el iión nitrito
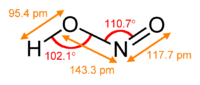
El ion nitrito tiene una estructura simétrica (simetría C2v), y ambos enlaces N–O tienen la misma longitud y un ángulo de enlace de aproximadamente 115°. En la teoría del enlace de valencia, se describe como un híbrido de resonancia con contribuciones iguales de dos formas canónicas que son imágenes especulares entre sí. En la teoría de los orbitales moleculares, existe un enlace sigma entre cada átomo de oxígeno y el átomo de nitrógeno, y un enlace pi deslocalizado formado a partir de los orbitales p de los átomos de nitrógeno y oxígeno que es perpendicular al plano de la molécula. La carga negativa del ion se distribuye uniformemente entre los dos átomos de oxígeno. Tanto los átomos de nitrógeno como los de oxígeno llevan un par de electrones solitarios. Por tanto, el ion nitrito es una base de Lewis.
En la fase gaseosa existe predominantemente como una molécula transplanar.
Reacciones
Propiedades ácido-base
El nitrito es la base conjugada del ácido débil nitroso:
- HNO2 ⇌ H+ + NO−
2; pKa Ω 3.3 a 18 °C
El ácido nitroso también es muy volátil y tiende a desproporcionarse:
- 3 HNO2 (aq) ⇌ H3O+ + NO−
3 + 2 NO
Esta reacción es lenta a 0 °C. La adición de ácido a una solución de nitrito en presencia de un agente reductor, como el hierro (II), es una forma de producir óxido nítrico (NO) en el laboratorio.
Oxidación y reducción
El estado de oxidación formal del átomo de nitrógeno en el nitrito es +3. Esto significa que puede oxidarse a estados de oxidación +4 y +5, o reducirse a estados de oxidación tan bajos como -3. Los potenciales de reducción estándar para reacciones que involucran directamente al ácido nitroso se muestran en la siguiente tabla:
Media reacción E0 (V) NO−
3 + 3 H+ + 2 e− NO HNO2 + H2O+0.94 2 HNO2 + 4 H+ + 4 e− ⇌ H2N2O2 + 2 H2O +0.86 N2O4 + 2 H+ + 2 e− ⇌ 2 HNO2 +1.065 2 HNO2+ 4 H+ + 4 e− ⇌ N2O + 3 H2O +1.29
Los datos se pueden ampliar para incluir productos en estados de oxidación más bajos. Por ejemplo:
- H2N2O2 + 2 H+ + 2 e− ⇌ N2 + 2 H2O; E0 = +2,65 V
Las reacciones de oxidación generalmente resultan en la formación del ion nitrato, con nitrógeno en estado de oxidación +5. Por ejemplo, la oxidación con ion permanganato se puede utilizar para el análisis cuantitativo de nitrito (mediante titulación):
- 5 NO−
2 + 2 MnO−
4 + 6 H+ → 5 NO−
3 + 2 Mn2+ + 3 H2O
El producto de las reacciones de reducción con iones nitrito varía dependiendo del agente reductor utilizado y su fuerza. Con dióxido de azufre, los productos son NO y N2O; con estaño(II) (Sn2+) el producto es ácido hiponitroso (H2N2O2); La reducción hasta llegar a amoníaco (NH3) se produce con sulfuro de hidrógeno. Con el catión hidrazinio (N
2H+
5) el producto del nitrito La reducción es el ácido hidrazoico (HN3), un compuesto inestable y explosivo:
- HNO2 + N
2H+
5 → HN3 + H2O + H3O+
que también puede reaccionar aún más con el nitrito:
- HNO2 + HN3 → N2O + N2 + H2O
Esta reacción es inusual porque involucra compuestos con nitrógeno en cuatro estados de oxidación diferentes.
Análisis de nitrito
El nitrito se detecta y analiza mediante la reacción de Griess, que implica la formación de un colorante azoico de color rojo intenso tras el tratamiento de un NO−
>2</span -muestra que contiene ácido sulfanílico y naftil-1-amina en presencia de ácido.
Complejos de coordinación
El nitrito es un ligando ambidentado y puede formar una amplia variedad de complejos de coordinación uniéndose a iones metálicos de varias maneras. Dos ejemplos son el complejo de nitrito rojo [Co(NH3)5(ONO)]2+ es metaestable y se isomeriza al complejo nitro amarillo. [Co(NH3)5(NO2)]2+. El nitrito es procesado por varias enzimas, todas las cuales utilizan complejos de coordinación.
Bioquímica

En la nitrificación, el amonio se convierte en nitrito. Las especies importantes incluyen Nitrosomonas. Otras especies bacterianas como Nitrobacter, son responsables de la oxidación del nitrito a nitrato.
Muchas especies de bacterias pueden reducir el nitrito a óxido nítrico o amoníaco. En condiciones hipóxicas, el nitrito puede liberar óxido nítrico, lo que provoca una potente vasodilatación. Se han descrito varios mecanismos para la conversión de nitrito a NO, incluida la reducción enzimática por xantina oxidorreductasa, nitrito reductasa y NO sintasa (NOS), así como reacciones de desproporción ácida no enzimáticas.
Usos
Precursor químico
Los tintes azoicos y otros colorantes se preparan mediante el proceso llamado diazotización, que requiere nitrito.
Nitrito en conservación de alimentos y bioquímica
El nitrito de sodio se utiliza para acelerar el curado de la carne y también para impartir un color atractivo. Un estudio de 2018 realizado por la Asociación Británica de Productores de Carne determinó que los niveles de nitrito legalmente permitidos no tienen ningún efecto sobre el crecimiento de la bacteria Clostridium botulinum que causa el botulismo, de acuerdo con el Comité Asesor del Reino Unido sobre La Seguridad Microbiológica de los Alimentos opina que los nitritos no son necesarios para prevenir el crecimiento de Clostridium botulinum y prolongar la vida útil. En EE. UU., la carne no puede etiquetarse como "curada"; sin adición de nitrito. En algunos países, los productos cárnicos curados se fabrican sin nitrato ni nitrito, y sin nitrito de origen vegetal. En 2018 se informó que el jamón de Parma, producido sin nitrito desde 1993, no había causado ningún caso de botulismo.
En ratones, los alimentos ricos en nitritos junto con grasas insaturadas pueden prevenir la hipertensión, lo que es una explicación del aparente efecto de la dieta mediterránea sobre la salud. Sin embargo, se ha demostrado que agregar nitritos a la carne genera carcinógenos conocidos; La Organización Mundial de la Salud (OMS) advierte que comer 50 g (1,8 oz) de carne procesada con nitrito al día aumentaría el riesgo de contraer cáncer de intestino en un 18 % a lo largo de la vida. Los límites máximos recomendados por la Organización Mundial de la Salud en el agua potable son 3 mg L−1 y 50 mg L−1 para los iones nitrito y nitrato, respectivamente.
Curado de carne
En una reacción con la mioglobina de la carne, el nitrito le da al producto un deseable color rosado-rojo "fresco" color, como con la carne en conserva. En Estados Unidos, el nitrito se utiliza formalmente desde 1925. Según los científicos que trabajan para el grupo industrial American Meat Institute, este uso del nitrito comenzó en la Edad Media. Historiadores y epidemiólogos sostienen que el uso generalizado de nitritos en el curado de carne está estrechamente relacionado con el desarrollo del procesamiento industrial de carne. El periodista de investigación francés Guillaume Coudray afirma que la industria cárnica opta por curar sus carnes con nitrito, aunque está demostrado que esta sustancia química genera compuestos nitrosos cancerígenos. El nitrito se añade comúnmente a la carne fermentada para acelerar el curado y también impartir un color atractivo sin tener ningún efecto sobre el crecimiento de la bacteria Clostridium botulinum que causa el botulismo. Algunos productores tradicionales y artesanales evitan los nitritos.
Antídoto para el envenenamiento por cianuro
Los nitritos en forma de nitrito de sodio y nitrito de amilo son componentes de muchos kits de antídotos contra el cianuro. Ambos compuestos se unen a la hemoglobina y oxidan los iones Fe2+ a iones Fe3+ formando metahemoglobina. La metahemoglobina, a su vez, se une al cianuro (CN) creando cianmetahemoglobina, eliminando eficazmente el cianuro del complejo IV de la cadena de transporte de electrones (ETC) en las mitocondrias, que es el principal sitio de alteración causada por el cianuro. Otro mecanismo por el cual los nitritos son útiles en el tratamiento de la toxicidad del cianuro es la generación de óxido nítrico (NO). El NO desplaza el CN de la citocromo c oxidasa (complejo IV de ETC), dejándolo disponible para que se una a la metahemoglobina.
Nitritos orgánicos

En química orgánica, los nitritos de alquilo son ésteres de ácido nitroso y contienen el grupo funcional nitrosoxi. Los compuestos nitro contienen el grupo C –NO2. Los nitritos tienen la fórmula general RONO, donde R es un grupo arilo o alquilo. El nitrito de amilo y otros nitritos de alquilo tienen una acción vasodilatadora y deben manipularse en el laboratorio con precaución. A veces se utilizan en medicina para el tratamiento de enfermedades del corazón. Una reacción clásica con nombre para la síntesis de nitritos de alquilo es la síntesis de Meyer, en la que los haluros de alquilo reaccionan con nitritos metálicos formando una mezcla de nitroalcanos y nitritos.
Seguridad
Las sales de nitritos pueden reaccionar con aminas secundarias para producir N-nitrosaminas, que se sospecha que causan cáncer de estómago. La Organización Mundial de la Salud (OMS) advierte que cada 50 g (1,8 oz) de carne procesada consumida al día aumentaría el riesgo de contraer cáncer de intestino en un 18 % a lo largo de la vida; La carne procesada se refiere a la carne que ha sido transformada mediante fermentación, curado con nitrito, salazón, ahumado u otros procesos para realzar el sabor o mejorar la conservación. La revisión de más de 400 estudios realizada por la Organización Mundial de la Salud en 2015 concluyó que había evidencia suficiente de que las carnes procesadas causaban cáncer, particularmente cáncer de colon; La Agencia Internacional para la Investigación del Cáncer (IARC) de la OMS clasificó las carnes procesadas como cancerígenas para los seres humanos (Grupo 1).
El nitrito (ingerido) en condiciones que resultan en nitrosación endógena, específicamente la producción de nitrosamina, ha sido clasificado como Probablemente cancerígeno para los humanos (Grupo 2A) por la IARC.
Contenido relacionado
Quimioluminiscencia
Control de concurrencia basado en marcas de tiempo
Muestreo (procesamiento de señales)