Nicotinamida adenina dinucleótida
Nicotinamida adenina dinucleótido (NAD) es una coenzima fundamental para el metabolismo. El NAD, que se encuentra en todas las células vivas, se llama dinucleótido porque consta de dos nucleótidos unidos a través de sus grupos fosfato. Un nucleótido contiene una nucleobase de adenina y el otro, nicotinamida. El NAD existe en dos formas: una forma oxidada y una reducida, abreviadas como NAD+ y NADH (H para hidrógeno), respectivamente.
En el metabolismo celular, el NAD participa en reacciones redox, transportando electrones de una reacción a otra, por lo que se encuentra en dos formas: NAD+ es un agente oxidante, acepta electrones de otras moléculas y volverse reducido; con H+, esta reacción forma NADH, que puede usarse como agente reductor para donar electrones. Estas reacciones de transferencia de electrones son la función principal del NAD. También se utiliza en otros procesos celulares, sobre todo como sustrato de enzimas al agregar o eliminar grupos químicos hacia o desde proteínas, en modificaciones postraduccionales. Debido a la importancia de estas funciones, las enzimas implicadas en el metabolismo del NAD son objetivos para el descubrimiento de fármacos.
En los organismos, el NAD se puede sintetizar a partir de componentes básicos simples (de novo) a partir de triptófano o ácido aspártico, cada uno de los cuales es una caja de un aminoácido. Alternativamente, los componentes más complejos de las coenzimas se absorben a partir de compuestos nutritivos como la niacina; compuestos similares se producen mediante reacciones que descomponen la estructura del NAD, proporcionando una vía de recuperación que los recicla nuevamente a su forma activa respectiva.
Parte del NAD se convierte en la coenzima nicotinamida adenina dinucleótido fosfato (NADP), cuya química es en gran medida paralela a la del NAD, aunque su función predominante es la de coenzima en el metabolismo anabólico.
Did you mean:In the name NAD+, the superscript plus sign indicates the positive formal charge on one of its nitrogen atoms.
Propiedades físicas y químicas
La nicotinamida adenina dinucleótido consta de dos nucleósidos unidos por pirofosfato. Cada uno de los nucleósidos contiene un anillo de ribosa, uno con adenina unida al primer átomo de carbono (la posición 1') (adenosina difosfato ribosa) y el otro con nicotinamida en esta posición.

El compuesto acepta o dona el equivalente de H-. Dichas reacciones (resumidas en la fórmula siguiente) implican la eliminación de dos átomos de hidrógeno del reactivo (R), en forma de un ion hidruro (H-), y un protón (H+ ). El protón se libera en la solución, mientras que el reductor RH2 se oxida y el NAD+ se reduce a NADH mediante la transferencia del hidruro al anillo de nicotinamida.
- RH2 + NAD+ → NADH + H+ + R;
Del par de electrones del hidruro, un electrón se transfiere al átomo de nitrógeno cargado positivamente del anillo de nicotinamida de NAD+, y el segundo átomo de hidrógeno se transfiere al átomo de carbono C4 opuesto a este átomo de N. El potencial del punto medio del par redox NAD+/NADH es −0,32 voltios, lo que convierte al NADH en un agente reductor moderadamente fuerte. La reacción es fácilmente reversible cuando el NADH reduce otra molécula y se reoxida a NAD+. Esto significa que la coenzima puede circular continuamente entre las formas NAD+ y NADH sin consumirse.
En apariencia, todas las formas de esta coenzima son polvos blancos amorfos que son higroscópicos y altamente solubles en agua. Los sólidos son estables si se almacenan secos y en la oscuridad. Las soluciones de NAD+ son incoloras y estables durante aproximadamente una semana a 4 °C y pH neutro, pero se descomponen rápidamente en soluciones ácidas o alcalinas. Al descomponerse, forman productos que son inhibidores de enzimas.

Tanto el NAD+ como el NADH absorben fuertemente la luz ultravioleta debido a la adenina. Por ejemplo, la absorción máxima de NAD+ se produce a una longitud de onda de 259 nanómetros (nm), con un coeficiente de extinción de 16.900 M−1cm−1. El NADH también absorbe en longitudes de onda más altas, con un segundo pico en la absorción de rayos UV a 339 nm con un coeficiente de extinción de 6220 M−1cm−1. Esta diferencia en los espectros de absorción ultravioleta entre las formas oxidadas y reducidas de las coenzimas en longitudes de onda más altas hace que sea sencillo medir la conversión de una a otra en ensayos enzimáticos, midiendo la cantidad de absorción de UV a 340 nm usando un espectrofotómetro.
NAD+ y NADH también se diferencian en su fluorescencia. El NADH que se difunde libremente en una solución acuosa, cuando se excita con una absorbancia de nicotinamida de ~335 nm (casi-UV), emite fluorescencia a 445-460 nm (de violeta a azul) con una vida útil de fluorescencia de 0,4 nanosegundos, mientras que el NAD+ no emite fluorescencia. Las propiedades de la señal de fluorescencia cambian cuando el NADH se une a las proteínas, por lo que estos cambios pueden usarse para medir las constantes de disociación, que son útiles en el estudio de la cinética enzimática. Estos cambios en la fluorescencia también se utilizan para medir cambios en el estado redox de las células vivas, mediante microscopía de fluorescencia.
NADH se puede convertir en NAD+ en una reacción catalizada por cobre, que requiere peróxido de hidrógeno. Por tanto, el suministro de NAD+ en las células requiere cobre (II) mitocondrial.
Concentración y estado en celdas
En el hígado de rata, la cantidad total de NAD+ y NADH es aproximadamente 1 μmol por gramo de peso húmedo, aproximadamente 10 veces la concentración de NADP+ en las mismas células. La concentración real de NAD+ en el citosol celular es más difícil de medir; estimaciones recientes en células animales oscilan alrededor de 0,3 mM y aproximadamente de 1,0 a 2,0 mM en levadura. Sin embargo, más del 80% de la fluorescencia del NADH en las mitocondrias proviene de su forma unida, por lo que la concentración en solución es mucho menor.
Las concentraciones deNAD+ son más altas en las mitocondrias, y constituyen del 40% al 70% del NAD+ celular total. El NAD+ del citosol es transportado a la mitocondria mediante una proteína transportadora de membrana específica, ya que la coenzima no puede difundir a través de las membranas. Una revisión afirmó que la vida media intracelular de NAD+ era de entre 1 y 2 horas, mientras que otra revisión proporcionó estimaciones variables según el compartimento: intracelular de 1 a 4 horas, citoplasmática de 2 horas y mitocondrial. 4 a 6 horas.
El equilibrio entre las formas oxidada y reducida de nicotinamida adenina dinucleótido se denomina relación NAD+/NADH. Esta relación es un componente importante de lo que se llama el estado redox de una célula, una medida que refleja tanto las actividades metabólicas como la salud de las células. Los efectos de la relación NAD+/NADH son complejos y controlan la actividad de varias enzimas clave, incluidas la gliceraldehído 3-fosfato deshidrogenasa y la piruvato deshidrogenasa. En tejidos sanos de mamíferos, las estimaciones de la proporción entre NAD+ libre y NADH en el citoplasma suelen ser de alrededor de 700:1; la relación es, por tanto, favorable para las reacciones oxidativas. La proporción de NAD+/NADH total es mucho menor, con estimaciones que oscilan entre 3 y 10 en los mamíferos. Por el contrario, la relación NADP+/NADPH es normalmente de aproximadamente 0,005, por lo que NADPH es la forma dominante de esta coenzima. Estas diferentes proporciones son clave para las diferentes funciones metabólicas de NADH y NADPH.
Biosíntesis
NAD+ se sintetiza a través de dos vías metabólicas. Se produce en una vía de novo a partir de aminoácidos o en vías de recuperación reciclando componentes preformados como la nicotinamida a NAD+. Aunque la mayoría de los tejidos sintetizan NAD+ mediante la vía de rescate en los mamíferos, se produce mucha más síntesis de novo en el hígado a partir del triptófano y en los riñones y los macrófagos a partir del ácido nicotínico.
Producción de novo
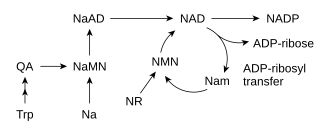
La mayoría de los organismos sintetizan NAD+ a partir de componentes simples. El conjunto específico de reacciones difiere entre organismos, pero una característica común es la generación de ácido quinolínico (QA) a partir de un aminoácido, ya sea triptófano (Trp) en animales y algunas bacterias, o ácido aspártico (Asp) en algunas bacterias y plantas. El ácido quinolínico se convierte en mononucleótido de ácido nicotínico (NaMN) mediante la transferencia de un resto fosforribosa. Luego se transfiere un resto de adenilato para formar dinucleótido de adenina del ácido nicotínico (NaAD). Finalmente, la fracción de ácido nicotínico en NaAD se amida a una fracción de nicotinamida (Nam), formando dinucleótido de nicotinamida y adenina.
En un paso posterior, algo de NAD+ se convierte en NADP+ mediante la NAD+ quinasa, que fosforila el NAD+. En la mayoría de los organismos, esta enzima utiliza trifosfato de adenosina (ATP) como fuente del grupo fosfato, aunque varias bacterias, como Mycobacterium tuberculosis y una arqueona hipertermófila Pyrococcus horikoshii, utilizan sustancias inorgánicas. polifosfato como donante alternativo de fosforilo.
Vías de rescate
A pesar de la presencia de la vía de novo, las reacciones de rescate son esenciales en los humanos; la falta de niacina en la dieta provoca la enfermedad por deficiencia de vitaminas, la pelagra. Este alto requerimiento de NAD+ resulta del consumo constante de la coenzima en reacciones como las modificaciones postraduccionales, ya que el ciclo de NAD+ entre formas oxidadas y reducidas en reacciones redox no no cambia los niveles generales de la coenzima. La principal fuente de NAD+ en los mamíferos es la vía de rescate que recicla la nicotinamida producida por enzimas que utilizan NAD+. El primer paso, y la enzima limitante de la velocidad en la vía de rescate, es la nicotinamida fosforribosiltransferasa (NAMPT), que produce mononucleótido de nicotinamida (NMN). NMN es el precursor inmediato de NAD+ en la vía de rescate.
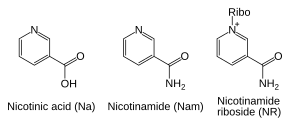
Además de ensamblar NAD+ de novo a partir de precursores de aminoácidos simples, las células también recuperan compuestos preformados que contienen una base de piridina. Los tres precursores de vitaminas utilizados en estas vías metabólicas de rescate son el ácido nicotínico (NA), la nicotinamida (Nam) y el ribósido de nicotinamida (NR). Estos compuestos se pueden absorber de la dieta y se denominan vitamina B3 o niacina. Sin embargo, estos compuestos también se producen dentro de las células y mediante la digestión del NAD+ celular. Algunas de las enzimas implicadas en estas vías de recuperación parecen estar concentradas en el núcleo celular, lo que puede compensar el alto nivel de reacciones que consumen NAD+ en este orgánulo. Hay algunos informes de que las células de los mamíferos pueden absorber NAD+ extracelular de su entorno, y tanto la nicotinamida como el ribósido de nicotinamida pueden absorberse desde el intestino.
Las vías de recuperación utilizadas en los microorganismos difieren de las de los mamíferos. Algunos patógenos, como la levadura Candida glabrata y la bacteria Haemophilus influenzae son auxótrofos de NAD+: no pueden sintetizar NAD+ – pero poseen vías de recuperación y, por lo tanto, dependen de fuentes externas de NAD+ o sus precursores. Aún más sorprendente es el patógeno intracelular Chlamydia trachomatis, que carece de candidatos reconocibles para cualquier gen implicado en la biosíntesis o recuperación tanto de NAD+ como de NADP+, y debe adquirir estas coenzimas de su huésped.
Funciones

La nicotinamida adenina dinucleótido tiene varias funciones esenciales en el metabolismo. Actúa como coenzima en reacciones redox, como donante de restos de ADP-ribosa en reacciones de ADP-ribosilación, como precursor de la molécula del segundo mensajero ADP-ribosa cíclica, además de actuar como sustrato para ADN ligasas bacterianas y un grupo de enzimas llamadas sirtuinas que utilizan NAD+ para eliminar los grupos acetilo de las proteínas. Además de estas funciones metabólicas, NAD+ surge como un nucleótido de adenina que puede liberarse de las células de forma espontánea y mediante mecanismos regulados y, por lo tanto, puede tener importantes funciones extracelulares.
Unión de oxidorreductasa de NAD
La función principal del NAD+ en el metabolismo es la transferencia de electrones de una molécula a otra. Las reacciones de este tipo son catalizadas por un gran grupo de enzimas llamadas oxidorreductasas. Los nombres correctos de estas enzimas contienen los nombres de ambos sustratos: por ejemplo, la NADH-ubiquinona oxidorreductasa cataliza la oxidación de NADH por la coenzima Q. Sin embargo, estas enzimas también se denominan deshidrogenasas o . reductasas, y la NADH-ubiquinona oxidorreductasa comúnmente se denomina NADH deshidrogenasa o, a veces, coenzima Q reductasa.
Hay muchas superfamilias diferentes de enzimas que se unen a NAD+/NADH. Una de las superfamilias más comunes incluye un motivo estructural conocido como pliegue de Rossmann. El motivo lleva el nombre de Michael Rossmann, quien fue el primer científico en notar cuán común es esta estructura dentro de las proteínas de unión a nucleótidos.
Un ejemplo de una enzima bacteriana de unión a NAD implicada en el metabolismo de los aminoácidos que no tiene el pliegue de Rossmann se encuentra en Pseudomonas syringae pv. tomate (PDB: 2CWH; InterPro: IPR003767).

Cuando se une al sitio activo de una oxidorreductasa, el anillo de nicotinamida de la coenzima se coloca de manera que pueda aceptar un hidruro del otro sustrato. Dependiendo de la enzima, el donante de hidruro se coloca "arriba" o "abajo" el plano del carbono C4 plano, como se define en la figura. Las oxidorreductasas de clase A transfieren el átomo desde arriba; las enzimas de clase B lo transfieren desde abajo. Dado que el carbono C4 que acepta el hidrógeno es proquiral, esto puede explotarse en la cinética enzimática para brindar información sobre el mecanismo de la enzima. Esto se hace mezclando una enzima con un sustrato que tiene átomos de deuterio sustituidos por los hidrógenos, de modo que la enzima reducirá el NAD+ transfiriendo deuterio en lugar de hidrógeno. En este caso, una enzima puede producir uno de los dos estereoisómeros de NADH.
A pesar de la similitud en la forma en que las proteínas se unen a las dos coenzimas, las enzimas casi siempre muestran un alto nivel de especificidad para NAD+ o NADP+. Esta especificidad refleja las distintas funciones metabólicas de las respectivas coenzimas y es el resultado de distintos conjuntos de residuos de aminoácidos en los dos tipos de bolsas de unión a coenzimas. Por ejemplo, en el sitio activo de las enzimas dependientes de NADP, se forma un enlace iónico entre una cadena lateral de un aminoácido básico y el grupo fosfato ácido de NADP+. Por el contrario, en las enzimas dependientes de NAD, la carga en este bolsillo se invierte, impidiendo que NADP+ se una. Sin embargo, existen algunas excepciones a esta regla general, y enzimas como la aldosa reductasa, la glucosa-6-fosfato deshidrogenasa y la metilenetetrahidrofolato reductasa pueden utilizar ambas coenzimas en algunas especies.
Papel en el metabolismo redox

Las reacciones redox catalizadas por oxidorreductasas son vitales en todas las partes del metabolismo, pero un área particularmente importante donde ocurren estas reacciones es en la liberación de energía de los nutrientes. Aquí se oxidan compuestos reducidos como la glucosa y los ácidos grasos, liberando así energía. Esta energía se transfiere a NAD+ mediante reducción a NADH, como parte de la beta oxidación, la glucólisis y el ciclo del ácido cítrico. En los eucariotas, los electrones transportados por el NADH que se produce en el citoplasma se transfieren a la mitocondria (para reducir el NAD+ mitocondrial) mediante lanzaderas mitocondriales, como la lanzadera de malato-aspartato. Luego, el NADH mitocondrial se oxida a su vez mediante la cadena de transporte de electrones, que bombea protones a través de una membrana y genera ATP mediante fosforilación oxidativa. Estos sistemas de lanzadera también tienen la misma función de transporte en los cloroplastos.
Dado que en estos conjuntos de reacciones vinculadas se utilizan tanto la forma oxidada como la reducida de nicotinamida adenina dinucleótido, la célula mantiene concentraciones significativas tanto de NAD+ como de NADH, siendo el NAD+ alto. /NADH que permite que esta coenzima actúe como agente oxidante y reductor. Por el contrario, la función principal del NADPH es la de agente reductor en el anabolismo, estando esta coenzima implicada en vías como la síntesis de ácidos grasos y la fotosíntesis. Dado que se necesita NADPH para impulsar reacciones redox como un fuerte agente reductor, la relación NADP+/NADPH se mantiene muy baja.
Aunque es importante en el catabolismo, el NADH también se utiliza en reacciones anabólicas, como la gluconeogénesis. Esta necesidad de NADH en el anabolismo plantea un problema para los procariotas que crecen con nutrientes que liberan sólo una pequeña cantidad de energía. Por ejemplo, las bacterias nitrificantes como Nitrobacter oxidan el nitrito a nitrato, lo que libera suficiente energía para bombear protones y generar ATP, pero no la suficiente para producir NADH directamente. Como el NADH todavía es necesario para las reacciones anabólicas, estas bacterias usan una nitrito oxidorreductasa para producir suficiente fuerza motriz de protones para hacer funcionar parte de la cadena de transporte de electrones en reversa, generando NADH.
Roles no redox
La coenzima NAD+ también se consume en las reacciones de transferencia de ADP-ribosa. Por ejemplo, las enzimas llamadas ADP-ribosiltransferasas añaden el resto ADP-ribosa de esta molécula a las proteínas, en una modificación postraduccional llamada ADP-ribosilación. La ADP-ribosilación implica la adición de un único resto de ADP-ribosa, en la mono-ADP-ribosilación, o la transferencia de ADP-ribosa a proteínas en largas cadenas ramificadas, lo que se denomina poli. (ADP-ribosil)ación. La mono-ADP-ribosilación se identificó por primera vez como el mecanismo de un grupo de toxinas bacterianas, en particular la toxina del cólera, pero también participa en la señalización celular normal. La poli(ADP-ribosil)ación se lleva a cabo mediante las poli(ADP-ribosa) polimerasas. La estructura poli(ADP-ribosa) participa en la regulación de varios eventos celulares y es más importante en el núcleo celular, en procesos como la reparación del ADN y el mantenimiento de los telómeros. Además de estas funciones dentro de la célula, recientemente se ha descubierto un grupo de ADP-ribosiltransferasas extracelulares, pero sus funciones siguen sin estar claras. También se puede añadir NAD+ al ARN celular como una modificación del terminal 5'.

Otra función de esta coenzima en la señalización celular es como precursora de la ADP-ribosa cíclica, que es producida a partir de NAD+ por las ADP-ribosil ciclasas, como parte de un sistema de segundo mensajero. Esta molécula actúa en la señalización del calcio liberando calcio de las reservas intracelulares. Para ello, se une y abre una clase de canales de calcio llamados receptores de rianodina, que se encuentran en las membranas de los orgánulos, como el retículo endoplásmico, e induce la activación del factor de transcripción NAFC3.
NAD+ también es consumido por diferentes enzimas consumidoras de NAD+, como CD38, CD157, PARP y las desacetilasas dependientes de NAD (sirtuinas, como Sir2). Estas enzimas actúan transfiriendo un grupo acetilo de su proteína sustrato al resto ADP-ribosa de NAD+; esto escinde la coenzima y libera nicotinamida y O-acetil-ADP-ribosa. Las sirtuinas parecen estar implicadas principalmente en la regulación de la transcripción mediante la desacetilación de histonas y la alteración de la estructura de los nucleosomas. Sin embargo, las sirtuinas también pueden desacetilar las proteínas distintas de las histonas. Estas actividades de las sirtuinas son particularmente interesantes por su importancia en la regulación del envejecimiento.
Otras enzimas dependientes de NAD incluyen las ADN ligasas bacterianas, que unen dos extremos del ADN mediante el uso de NAD+ como sustrato para donar un resto de monofosfato de adenosina (AMP) al núcleo 5' fosfato de un extremo del ADN. Este intermedio es luego atacado por el 3' grupo hidroxilo del otro extremo del ADN, formando un nuevo enlace fosfodiéster. Esto contrasta con las ADN ligasas eucariotas, que utilizan ATP para formar el intermediario ADN-AMP.
Li y cols. han descubierto que NAD+ regula directamente las interacciones proteína-proteína. También muestran que una de las causas de la disminución de la reparación del ADN relacionada con la edad puede ser una mayor unión de la proteína DBC1 (eliminada en el cáncer de mama 1) a PARP1 (poli[ADP-ribosa] polimerasa 1) como NAD+ disminuyen durante el envejecimiento. Por tanto, la modulación de NAD+ puede proteger contra el cáncer, la radiación y el envejecimiento.
Acciones extracelulares de NAD+
En los últimos años, NAD+ también ha sido reconocida como una molécula de señalización extracelular implicada en la comunicación entre células. El NAD+ se libera de las neuronas de los vasos sanguíneos, la vejiga urinaria, el intestino grueso, las células neurosecretoras y los sinaptosomas cerebrales, y se propone que sea un nuevo neurotransmisor que transmite información de los nervios a las células efectoras en forma suave. órganos musculares. En las plantas, el dinucleótido extracelular de nicotinamida y adenina induce resistencia a la infección por patógenos y se ha identificado el primer receptor NAD extracelular. Se necesitan más estudios para determinar los mecanismos subyacentes de sus acciones extracelulares y su importancia para la salud humana y los procesos vitales en otros organismos.
Importancia clínica
Las enzimas que producen y utilizan NAD+ y NADH son importantes tanto en farmacología como en la investigación de futuros tratamientos para enfermedades. El diseño y desarrollo de fármacos aprovecha el NAD+ de tres maneras: como objetivo directo de los fármacos, diseñando inhibidores o activadores enzimáticos basados en su estructura que cambian la actividad de las enzimas dependientes de NAD, y tratando de inhibe la biosíntesis de NAD+.
Debido a que las células cancerosas utilizan una mayor glucólisis y a que el NAD mejora la glucólisis, la nicotinamida fosforribosiltransferasa (vía de recuperación de NAD) a menudo se amplifica en las células cancerosas.
Se ha estudiado su uso potencial en la terapia de enfermedades neurodegenerativas como la enfermedad de Alzheimer y Parkinson, así como la esclerosis múltiple. Un ensayo clínico controlado con placebo de NADH (que excluyó a los precursores de NADH) en personas con Parkinson no logró mostrar ningún efecto.
NAD+ también es un objetivo directo del fármaco isoniazida, que se utiliza en el tratamiento de la tuberculosis, una infección causada por Mycobacterium tuberculosis. La isoniazida es un profármaco y una vez que ha entrado en la bacteria, es activada por una enzima peroxidasa, que oxida el compuesto en forma de radical libre. Este radical luego reacciona con NADH para producir aductos que son inhibidores muy potentes de las enzimas proteína transportadora de enoil-acil reductasa y dihidrofolato reductasa.
Dado que muchas oxidorreductasas utilizan NAD+ y NADH como sustratos y se unen mediante un motivo estructural altamente conservado, la idea de que los inhibidores basados en NAD+ podrían ser específicos de Una enzima es sorprendente. Sin embargo, esto puede ser posible: por ejemplo, los inhibidores basados en los compuestos ácido micofenólico y tiazofurina inhiben la IMP deshidrogenasa en el sitio de unión NAD+. Debido a la importancia de esta enzima en el metabolismo de las purinas, estos compuestos pueden ser útiles como fármacos anticancerígenos, antivirales o inmunosupresores. Otros fármacos no son inhibidores de enzimas, sino que activan enzimas implicadas en el metabolismo de NAD+. Las sirtuinas son un objetivo particularmente interesante para estos fármacos, ya que la activación de estas desacetilasas dependientes de NAD prolonga la vida útil en algunos modelos animales. Compuestos como el resveratrol aumentan la actividad de estas enzimas, lo que puede ser importante por su capacidad para retrasar el envejecimiento en organismos modelo tanto vertebrados como invertebrados. En un experimento, los ratones que recibieron NAD durante una semana mejoraron la comunicación nuclear-mitocondrial.
Debido a las diferencias en las vías metabólicas de la biosíntesis de NAD+ entre organismos, como entre bacterias y humanos, esta área del metabolismo es un área prometedora para el desarrollo de nuevos antibióticos. Por ejemplo, la enzima nicotinamidasa, que convierte la nicotinamida en ácido nicotínico, es un objetivo para el diseño de fármacos, ya que esta enzima está ausente en los humanos pero está presente en levaduras y bacterias.
Did you mean:In bacteriology, AND, sometimes referred to factor V, is used as a supplement to culture media for some fastidious bacteria.
Historia

La coenzima NAD+ fue descubierta por primera vez por los bioquímicos británicos Arthur Harden y William John Young en 1906. Observaron que la adición de extracto de levadura hervido y filtrado aceleraba enormemente la fermentación alcohólica en extractos de levadura sin hervir. Llamaron al factor no identificado responsable de este efecto cofermento. Tras una larga y difícil purificación a partir de extractos de levadura, Hans von Euler-Chelpin identificó este factor termoestable como un nucleótido de azúcar fosfato. En 1936, el científico alemán Otto Heinrich Warburg demostró la función de la coenzima de nucleótidos en la transferencia de hidruro e identificó la porción de nicotinamida como el sitio de las reacciones redox.
Las vitaminas precursoras de NAD+ se identificaron por primera vez en 1938, cuando Conrad Elvehjem demostró que el hígado tiene una "lengua anti-negra" actividad en forma de nicotinamida. Luego, en 1939, proporcionó la primera evidencia sólida de que la niacina se utiliza para sintetizar NAD+. A principios de la década de 1940, Arthur Kornberg fue el primero en detectar una enzima en la vía biosintética. En 1949, los bioquímicos estadounidenses Morris Friedkin y Albert L. Lehninger demostraron que el NADH vinculaba vías metabólicas como el ciclo del ácido cítrico con la síntesis de ATP en la fosforilación oxidativa. En 1958, Jack Preiss y Philip Handler descubrieron los intermediarios y enzimas implicados en la biosíntesis de NAD+; La síntesis de rescate a partir del ácido nicotínico se denomina vía de Preiss-Handler. En 2004, Charles Brenner y sus colaboradores descubrieron la vía de la nicotinamida ribósido quinasa hacia NAD+.
Las funciones no redox del NAD(P) se descubrieron más tarde. El primero en identificarse fue el uso de NAD+ como donante de ADP-ribosa en reacciones de ribosilación de ADP, observado a principios de los años 1960. Los estudios realizados en las décadas de 1980 y 1990 revelaron las actividades de los metabolitos NAD+ y NADP+ en la señalización celular, como la acción de la ADP-ribosa cíclica, que se descubrió en 1987.
El metabolismo de NAD+ siguió siendo un área de intensa investigación en el siglo XXI, con un interés mayor después del descubrimiento de las proteínas desacetilasas dependientes de NAD+ llamadas sirtuinas en 2000, por Shin-ichiro Imai y compañeros de trabajo en el laboratorio de Leonard P. Guarente. En 2009, Imai propuso el "NAD World" hipótesis de que los reguladores clave del envejecimiento y la longevidad en los mamíferos son la sirtuina 1 y la principal enzima sintetizadora de NAD+, nicotinamida fosforribosiltransferasa (NAMPT). En 2016, Imai amplió su hipótesis a "NAD World 2.0", que postula que la NAMPT extracelular del tejido adiposo mantiene NAD+ en el hipotálamo (el centro de control) junto con miocinas de células del músculo esquelético.
Contenido relacionado
Prosper Menière
Locura
Supresor de reflujo