Neuroesteroide

neuroesteroides, también conocidos como esteroides neuroactivos, son esteroides endógenos o exógenos que alteran rápidamente la excitabilidad neuronal mediante la interacción con canales iónicos activados por ligandos y otros receptores de la superficie celular. El término neuroesteroide fue acuñado por el fisiólogo francés Étienne-Émile Baulieu y se refiere a los esteroides sintetizados en el cerebro. El término esteroide neuroactivo se refiere a esteroides que pueden sintetizarse en el cerebro o son sintetizados por una glándula endocrina, que luego llegan al cerebro a través del torrente sanguíneo y tienen efectos sobre la función cerebral. El término esteroides neuroactivos fue acuñado por primera vez en 1992 por Steven Paul y Robert Purdy. Además de sus acciones sobre los receptores de la membrana neuronal, algunos de estos esteroides también pueden ejercer efectos sobre la expresión genética a través de los receptores nucleares de hormonas esteroides. Los neuroesteroides tienen una amplia gama de aplicaciones clínicas potenciales, desde la sedación hasta el tratamiento de la epilepsia y la lesión cerebral traumática. La ganaxolona, un análogo sintético del neuroesteroide endógeno alopregnanolona, está bajo investigación para el tratamiento de la epilepsia.
Clasificación
Según las diferencias en actividad y estructura, los neuroesteroides se pueden clasificar en términos generales en varios grupos principales diferentes.
Neuroesteroides inhibidores
Estos neuroesteroides ejercen acciones inhibidoras sobre la neurotransmisión. Actúan como moduladores alostéricos positivos del receptor GABAA (especialmente las isoformas que contienen la subunidad δ) y poseen, sin ningún orden en particular, propiedades antidepresivas, ansiolíticas, reductoras del estrés, gratificantes, prosociales, antiagresivas, prosexuales, sedantes, pro-sueño, cognitivas. y efectos que alteran la memoria, analgésicos, anestésicos, anticonvulsivos, neuroprotectores y neurogénicos.
Los principales ejemplos incluyen la tetrahidrodesoxicorticosterona (THDOC), el androstano 3α-androstanodiol, el colestano colesterol y los pregnanos pregnanolona (eltanolona), alopregnanolona (3α,5α-THP).
Neuroesteroides excitadores
Estos neuroesteroides tienen efectos excitadores sobre la neurotransmisión. Actúan como potentes moduladores alostéricos negativos del receptor GABAA, moduladores alostéricos positivos débiles del receptor NMDA y/o agonistas del receptor σ1, y en su mayoría tienen efectos antidepresivos, ansiogénicos, cognitivos y mejoradores de la memoria. , efectos convulsivos, neuroprotectores y neurogénicos.
Los ejemplos principales incluyen los pregnanos sulfato de pregnenolona (PS), epipregnanolona e isopregnanolona (sepranolona), los androstanos dehidroepiandrosterona (DHEA; prasterona) y sulfato de dehidroepiandrosterona (DHEA-S; sulfato de prasterona) y el colestano 24(S). -hidroxicolesterol (selectivo para el receptor NMDA; muy potente).
Feromonas
Las feromonas son neuroesteroides que influyen en la actividad cerebral, en particular en la función hipotalámica, mediante la activación de las células receptoras vomeronasales.
Las posibles feromonas humanas incluyen los androstanos androstadienol, androstadienona, androstenol y androstenona y el estrano estratetraenol.
Otros neuroesteroides
Ciertos otros esteroides endógenos, como la pregnenolona, la progesterona, el estradiol y la corticosterona, también son neuroesteroides. Sin embargo, a diferencia de los enumerados anteriormente, estos neuroesteroides no modulan los receptores GABAA o NMDA, sino que afectan a otros receptores de la superficie celular y objetivos no genómicos. Además, muchos esteroides endógenos, incluidas la pregnenolona, la progesterona, la corticosterona, la desoxicorticosterona, la DHEA y la testosterona, se metabolizan en (otros) neuroesteroides, funcionando eficazmente como los llamados proneurosteroides.
Biosíntesis
Los neuroesteroides se sintetizan a partir del colesterol, que se convierte en pregnenolona y luego en todos los demás esteroides endógenos. Los neuroesteroides se producen en el cerebro después de la síntesis local o mediante la conversión de esteroides suprarrenales o esteroides gonadales de origen periférico. Se acumulan especialmente en las células mielinizantes de la glía, a partir del colesterol o de precursores esteroides importados de fuentes periféricas. La 5α-reductasa tipo I y la 3α-hidroxiesteroide deshidrogenasa participan en la biosíntesis de neuroesteroides inhibidores, mientras que la 3β-hidroxiesteroide deshidrogenasa y las hidroxiesteroide sulfotransferasas participan en la producción de neuroesteroides excitadores.
Función
Algunas de las principales funciones biológicas conocidas de los neuroesteroides incluyen la modulación de la plasticidad neuronal, los procesos de aprendizaje y memoria, el comportamiento y la susceptibilidad a las convulsiones, así como las respuestas al estrés, la ansiedad y la depresión. Los neuroesteroides también parecen desempeñar un papel importante en diversos comportamientos sexualmente dimórficos y respuestas emocionales.
El estrés agudo eleva los niveles de neuroesteroides inhibidores como la alopregnanolona, y se sabe que estos neuroesteroides contrarrestan muchos de los efectos del estrés. Esto es similar al caso de las endorfinas, que se liberan en respuesta al estrés y al dolor físico y contrarrestan los efectos subjetivos negativos de dichos estados. Como tal, se ha sugerido que una de las funciones biológicas de estos neuromoduladores puede ser ayudar a mantener la homeostasis emocional. El estrés crónico se ha asociado con niveles disminuidos de alopregnanolona y una respuesta alterada al estrés de la alopregnanolona, trastornos psiquiátricos y desregulación del eje hipotalámico-pituitario-suprarrenal.
Se cree que las fluctuaciones en los niveles de neuroesteroides inhibidores durante el ciclo menstrual y el embarazo desempeñan un papel importante en una variedad de afecciones de la mujer, incluido el síndrome premenstrual (PMS), el trastorno disfórico premenstrual (PMDD), el posparto. depresión (PPD), psicosis posparto y epilepsia catamenial. Además, se cree que los cambios en los niveles de neuroesteroides pueden estar involucrados en los cambios de humor, ansiedad y deseo sexual que ocurren durante la pubertad en ambos sexos y durante la menopausia en las mujeres.
Los niveles elevados de neuroesteroides inhibidores, concretamente la alopregnanolona, pueden producir efectos paradójicos, como estado de ánimo negativo, ansiedad, irritabilidad y agresión. Esto parece deberse a que estos neuroesteroides, al igual que otros moduladores alostéricos positivos del receptor GABAA, como las benzodiazepinas, los barbitúricos y el etanol, poseen acciones bifásicas en forma de U: niveles moderados (en el rango de 1,5–2 nM/L de aloprogesterona total, que son aproximadamente equivalentes a los niveles de la fase lútea) inhiben la actividad del receptor GABAA, mientras que concentraciones más bajas y más altas facilitan la actividad del receptor.
Actividad biológica
Receptor sigma-1
| Compuesto | Ki (nM) | Medida | Especies | Ref. |
|---|---|---|---|---|
| Progesterona | 268 | Antagonista | Guiso | |
| Deoxycorticosterone | 938 | Desconocido | Guiso | |
| Testosterona | 1.014 | Desconocido | Guiso | |
| Pregnenolone | ND | Agonista | ND | ND |
| Sulfato de pregnenolona | 3.198 | Agonista | Guiso | |
| DHEA | 3.700 | Agonista | ? | |
| DHEA-S | ND | Agonista | ND | ND |
| Corticosterona | 4,074 | Desconocido | Guiso |
Aplicaciones terapéuticas
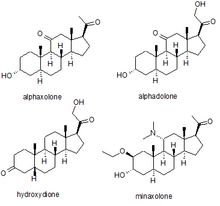
Anestesia
Se han utilizado varios neuroesteroides sintéticos como sedantes con fines de anestesia general para realizar procedimientos quirúrgicos. Los más conocidos son la alfaxolona, la alfadolona, la hidroxidiona y la minaxolona. El primero de ellos en introducirse fue la hidroxidiona, que es el derivado 21-hidroxi esterificado de la 5β-pregnanodiona. La hidroxidiona demostró ser un fármaco anestésico útil con un buen perfil de seguridad, pero era dolorosa e irritante cuando se inyectaba, probablemente debido a su escasa solubilidad en agua. Esto llevó al desarrollo de esteroides neuroactivos más nuevos. El siguiente fármaco de esta familia que se comercializó fue una mezcla de alfaxolona y alfadolona, conocida como Althesin. Se retiró del uso humano debido a reacciones tóxicas raras pero graves, pero todavía se utiliza en medicina veterinaria. El siguiente anestésico neuroesteroide introducido en la medicina humana fue el fármaco más nuevo minaxolona, que es aproximadamente tres veces más potente que la altesina y conserva el perfil de seguridad favorable, sin los problemas de toxicidad observados con la altesina. Sin embargo, este medicamento también fue finalmente retirado, no por problemas en el uso clínico, sino porque los estudios en animales sugirieron una posible carcinogenicidad y, dado que había agentes alternativos disponibles, se consideró que el posible riesgo superaba el beneficio de mantener el medicamento en el mercado.
Ganaxolona

El neuroesteroide ganaxolona, un análogo del metabolito de la progesterona alopregnanolona, se ha investigado exhaustivamente en modelos animales y actualmente se encuentra en ensayos clínicos para el tratamiento de la epilepsia. Los neuroesteroides, incluida la ganaxolona, tienen un amplio espectro de actividad en modelos animales. Pueden tener ventajas sobre otros moduladores del receptor GABAA, en particular las benzodiazepinas, en el sentido de que la tolerancia no parece ocurrir con el uso prolongado.
Un ensayo clínico de fase 2, aleatorizado, controlado con placebo, de 10 semanas de duración, de ganaxolona administrada por vía oral en adultos con convulsiones de inicio parcial demostró que el tratamiento es seguro, bien tolerado y eficaz. El fármaco siguió demostrando eficacia en una extensión abierta de 104 semanas. Los datos de estudios no clínicos sugieren que la ganaxolona puede tener un riesgo bajo si se usa durante el embarazo. Además de su uso en el tratamiento de la epilepsia, el fármaco tiene potencial en el tratamiento de una amplia gama de afecciones neurológicas y psiquiátricas. Actualmente se están realizando estudios de prueba de concepto sobre el trastorno de estrés postraumático y el síndrome de X frágil. La ganaxolona fue aprobada para uso médico en los Estados Unidos en marzo de 2022.
Epilepsia catamenial
Los investigadores han sugerido el uso de la llamada "terapia de reemplazo de neurosteroides" como forma de tratar la epilepsia catamenial con esteroides neuroactivos como la ganaxolona durante el período del ciclo menstrual en el que aumenta la frecuencia de las convulsiones. La progesterona micronizada, que se comporta de manera confiable como un profármaco de la alopregnanolona, se ha sugerido de la misma manera como tratamiento para la epilepsia catamenial.
Alopregnanolona
La alopregnanolona (SAGE-547) está en desarrollo como terapia intravenosa para el tratamiento del estado epiléptico superrefractario, la depresión posparto y el temblor esencial.
Otras aplicaciones
4,16-Androstadien-3β-ol (PH94B, Aloradine) es una feromona sintética, o ferina, neuroesteroide que está bajo investigación para el tratamiento de los trastornos de ansiedad en mujeres.
La 3β-metoxipregnenolona (MAP-4343), o 3β-metil éter de pregnenolona, es un esteroide neuroactivo sintético y un derivado de pregnenolona que interactúa con la proteína 2 asociada a los microtúbulos (MAP2) de manera similar a la pregnenolona y está en desarrollo para su potencial. Uso clínico para indicaciones tales como el tratamiento de lesiones cerebrales y de la médula espinal y trastornos depresivos.
Papel en la acción antidepresiva
También se ha descubierto que ciertos medicamentos antidepresivos, como la fluoxetina y la fluvoxamina, que generalmente afectan la depresión al actuar como inhibidores selectivos de la recaptación de serotonina (ISRS), normalizan los niveles de ciertos neuroesteroides (que con frecuencia son deficientes en pacientes deprimidos). en dosis que son inactivas para afectar la recaptación de serotonina. Esto sugiere que otras acciones que involucran a los neuroesteroides también pueden influir en la eficacia de estos medicamentos contra la depresión.
La enzima 3α-hidroxiesteroide deshidrogenasa (3α-HSD) es inducida por ciertos (ISRS), incluidos fluoxetina, fluvoxamina, sertralina y paroxetina, así como por otros antidepresivos como venlafaxina y mirtazapina, y se ha encontrado que estos antidepresivos para aumentar los niveles de neuroesteroides inhibidores. La mejora de la biosíntesis de neuroesteroides inhibidores se ha implicado en los efectos antidepresivos y ansiolíticos de algunos de los ISRS.
Efectos de las benzodiazepinas sobre los neuroesteroides
Las benzodiazepinas pueden influir en el metabolismo de los neuroesteroides en virtud de sus acciones sobre la proteína translocadora (TSPO; "receptor periférico de benzodiazepinas"). Las acciones farmacológicas de las benzodiazepinas en el receptor GABAA son similares a las de los neuroesteroides. Los factores que afectan la capacidad de las benzodiazepinas individuales para alterar los niveles de neuroesteroides pueden depender de si la benzodiazepina individual interactúa con la TSPO. Algunas benzodiazepinas también pueden inhibir las enzimas neuroesteroidogénicas que reducen la síntesis de neuroesteroides.