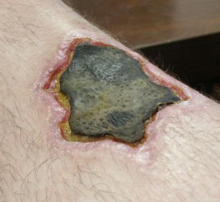
Necrosis
Necrosis (del griego antiguo νέκρωσις (nékrōsis) 'muerte') es una forma de lesión celular que resulta en la muerte prematura de células en tejido vivo por autólisis. La necrosis es causada por factores externos a la célula o al tejido, como una infección o un traumatismo, que dan como resultado la digestión no regulada de los componentes celulares. Por el contrario, la apoptosis es una causa natural programada y dirigida de muerte celular. Mientras que la apoptosis a menudo proporciona efectos beneficiosos para el organismo, la necrosis casi siempre es perjudicial y puede ser fatal.
La muerte celular debida a la necrosis no sigue la vía de transducción de señales apoptóticas, sino que se activan varios receptores y provocan la pérdida de la integridad de la membrana celular y una liberación incontrolada de productos de la muerte celular en el espacio extracelular. Esto inicia en el tejido circundante una respuesta inflamatoria, que atrae leucocitos y fagocitos cercanos que eliminan las células muertas por fagocitosis. Sin embargo, las sustancias dañinas microbianas liberadas por los leucocitos crearían daños colaterales en los tejidos circundantes. Este exceso de daño colateral inhibe el proceso de curación. Por lo tanto, la necrosis no tratada da como resultado una acumulación de tejido muerto en descomposición y restos celulares en o cerca del sitio de la muerte celular. Un ejemplo clásico es la gangrena. Por esta razón, a menudo es necesario extirpar quirúrgicamente el tejido necrótico, procedimiento conocido como desbridamiento.
Clasificación
Los signos estructurales que indican una lesión celular irreversible y la progresión de la necrosis incluyen la formación de grumos densos y la alteración progresiva del material genético, así como la alteración de las membranas de las células y los orgánulos.
Patrones morfológicos
Hay seis patrones morfológicos distintivos de necrosis:
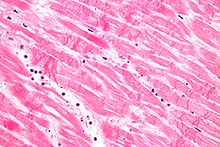
- La necrosis coagulativa se caracteriza por la formación de una sustancia gelatina (comogel) en tejidos muertos en los que se mantiene la arquitectura del tejido, y se observa mediante microscopía ligera. La coagulación ocurre como resultado de la desnaturalización de proteínas, causando que la albumina se transforme en un estado firme y opaco. Este patrón de necrosis se ve típicamente en entornos hipoxicos (low-oxygen), como el infarto. La necrosis coagulativa ocurre principalmente en tejidos como el riñón, el corazón y las glándulas suprarrenales. La isquemia severa más comúnmente causa necrosis de esta forma.
- La necrosis Liquefactiva (o necrosis coliquativa), en contraste con la necrosis coagulativa, se caracteriza por la digestión de células muertas para formar una masa líquida viscosa. Esto es típico de infecciones bacterianas, o a veces fúngicas, debido a su capacidad de estimular una respuesta inflamatoria. La masa líquida necrótica es con frecuencia amarilla cremosa debido a la presencia de leucocitos muertos y es comúnmente conocido como pus. Infartos hipoxicos en el cerebro presenta como este tipo de necrosis, ya que el cerebro contiene poco tejido conectivo pero altas cantidades de enzimas digestivas y lípidos, y las células por lo tanto pueden ser fácilmente digeridas por sus propias enzimas.
- La necrosis gángrenosa se puede considerar un tipo de necrosis coagulativa que se asemeja al tejido momificado. Es característico de la isquemia de la extremidad inferior y de las vías gastrointestinales. Si ocurre una infección superpuesta de tejidos muertos, entonces la necrosis licuada se produce (gangrena húmeda).
- La necrosis Caseous puede considerarse una combinación de necrosis coagulativa y licuada, típicamente causada por micobacterias (por ejemplo, tuberculosis), hongos y algunas sustancias extranjeras. El tejido necrótico aparece como blanco y friable, como el queso agrupado. Las células muertas se desintegran pero no son completamente digeridas, dejando partículas granulares. El examen microscópico muestra restos granulares amorfos encerrados en una frontera inflamatoria distintiva. Algunos granulomas contienen este patrón de necrosis.
- La necrosis grasa es necrosis especializada del tejido de grasa, resultante de la acción de las lipas activadas en los tejidos grasos como el páncreas. En el páncreas conduce a la pancreatitis aguda, una afección donde las enzimas pancreáticas se filtran en la cavidad peritoneal, y licuar la membrana dividiendo los ésteres de triglicéridos en ácidos grasos a través de la saponificación de grasa. El calcio, el magnesio o el sodio pueden unirse a estas lesiones para producir una sustancia blanca tiza. Los depósitos de calcio son microscópicamente distintivos y pueden ser suficientemente grandes para ser visibles en exámenes radiográficos. A simple vista, los depósitos de calcio aparecen como pulgas blancas graciosas.
- La necrosis fibrinoide es una forma especial de necrosis generalmente causada por daño vascular inmunitario. Está marcada por complejos de antígeno y anticuerpos, llamados complejos inmunitarios depositados en las paredes arteriales junto con fibrina.
Otras clasificaciones clínicas de la necrosis
- También hay formas muy específicas de necrosis tales como gangrena (termino utilizado en prácticas clínicas para extremidades que han tenido hipoxia severa), necrosis gurmatosa (debido a infecciones spirochaetales) y necrosis hemorrágica (debido al bloqueo del drenaje venoso de un órgano o tejido).
- Algunas picaduras de araña pueden llevar a la necrosis. En los Estados Unidos, sólo picaduras de araña de la araña de recluso marrón (genus Loxosceles) progresan de forma fiable a la necrosis. En otros países, las arañas del mismo género, como el recluso chileno en América del Sur, también se sabe que causan necrosis. Afirma que las arañas de saco amarillo y las arañas de hobo poseen veneno necrótico no han sido fundamentadas.
- En ratas de topo ciego (genus Spalax), el proceso de necrosis reemplaza el papel de la apoptosis sistemática normalmente utilizada en muchos organismos. Las bajas condiciones de oxígeno, como las comunes en las madrigueras de las ratas topo ciegas, generalmente hacen que las células se sometan a apoptosis. En adaptación a una mayor tendencia de muerte celular, las ratas de topos ciegos evolucionaron una mutación en la proteína del supresor tumoral p53 (que también se utiliza en humanos) para evitar que las células se sometan a apoptosis. Los pacientes de cáncer humano tienen mutaciones similares, y las ratas de topo ciego se pensaban más susceptibles al cáncer porque sus células no pueden someterse a apoptosis. Sin embargo, después de una cantidad específica de tiempo (dentro de 3 días según un estudio realizado en la Universidad de Rochester), las células de ratas topo ciegas liberan interferón-beta (que el sistema inmunitario normalmente utiliza para contrarrestar virus) en respuesta a la sobreproliferación de células causada por la supresión de la apoptosis. En este caso, el interferón-beta activa células para someterse a necrosis, y este mecanismo también mata células cancerosas en ratas topo ciegas. Debido a mecanismos de supresión tumoral como este, las ratas de topos ciegos y otros spalacidas son resistentes al cáncer.
Causas
La necrosis puede ocurrir debido a factores externos o internos.
Factores externos
Los factores externos pueden incluir traumatismos mecánicos (daño físico al cuerpo que causa descomposición celular), daño a los vasos sanguíneos (que puede interrumpir el suministro de sangre al tejido asociado) e isquemia. Los efectos térmicos (temperaturas extremadamente altas o bajas) pueden provocar necrosis debido a la alteración de las células.
En la congelación, se forman cristales, lo que aumenta la presión del tejido y el líquido restantes y hace que las células exploten. En condiciones extremas, los tejidos y las células mueren a través de un proceso no regulado de destrucción de las membranas y el citosol.
Factores internos
Los factores internos que causan la necrosis incluyen: trastornos trophoneuróticos (enfermedades que ocurren debido a una acción nerviosa defectuosa en una parte de un órgano que resulta en una falla en la nutrición); lesión y parálisis de las células nerviosas. Las enzimas pancreáticas (lipasas) son la causa principal de la necrosis grasa.
La necrosis puede ser activada por componentes del sistema inmunitario, como el sistema del complemento; toxinas bacterianas; células asesinas naturales activadas; y macrófagos peritoneales. Los programas de necrosis inducida por patógenos en células con barreras inmunológicas (mucosa intestinal) pueden aliviar la invasión de patógenos a través de las superficies afectadas por la inflamación. Las toxinas y los patógenos pueden causar necrosis; las toxinas como los venenos de serpiente pueden inhibir las enzimas y causar la muerte celular. También se han producido heridas necróticas por las picaduras de Vespa mandarinia.
Las condiciones patológicas se caracterizan por una secreción inadecuada de citocinas. El óxido nítrico (NO) y las especies reactivas de oxígeno (ROS) también se acompañan de una intensa muerte necrótica de las células. Un ejemplo clásico de una condición necrótica es la isquemia que conduce a un agotamiento drástico de oxígeno, glucosa y otros factores tróficos e induce la muerte necrótica masiva de las células endoteliales y las células no proliferantes de los tejidos circundantes (neuronas, cardiomiocitos, células renales, etc.).). Datos citológicos recientes indican que la muerte necrótica ocurre no solo durante eventos patológicos sino que también es un componente de algún proceso fisiológico.
La muerte inducida por la activación de los linfocitos T primarios y otros componentes importantes de la respuesta inmunitaria son independientes de la caspasa y necróticos por morfología; por lo tanto, los investigadores actuales han demostrado que la muerte celular necrótica puede ocurrir no solo durante procesos patológicos, sino también durante procesos normales como la renovación de tejidos, la embriogénesis y la respuesta inmunitaria.
Patogénesis
Caminos
Hasta hace poco, se pensaba que la necrosis era un proceso no regulado. Sin embargo, hay dos vías amplias en las que se puede producir necrosis en un organismo.
La primera de estas dos vías implica inicialmente la oncosis, en la que se produce la inflamación de las células. Las células afectadas luego proceden a la formación de ampollas, y esto es seguido por picnosis, en la que se produce la contracción nuclear. En el paso final de esta vía, los núcleos celulares se disuelven en el citoplasma, lo que se denomina cariolisis.
La segunda vía es una forma secundaria de necrosis que se ha demostrado que ocurre después de la apoptosis y la gemación. En estos cambios celulares de necrosis, el núcleo se rompe en fragmentos (lo que se conoce como cariorrexis).
Cambios histopatológicos
Los cambios del núcleo en la necrosis y las características de este cambio están determinados por la forma en que se descompone su ADN:
- Karyolysis: la cromatina del núcleo se desvanece debido a la pérdida del ADN por degradación.
- Karyorrhexis: los fragmentos de núcleo roto para la dispersión completa.
- Piknosis: el núcleo se encoge, y la cromatina se condensa.
Otros cambios celulares típicos en la necrosis incluyen:
- Hipereosinofilia citoplasmática en muestras con mancha H.E. Se ve como una mancha más oscura del citoplasma.
- El membrana celular aparece discontinuo cuando se ve con un microscopio electrónico. Esta membrana discontinua es causada por el blanqueamiento celular y la pérdida de microvilli.
En una escala histológica mayor, las pseudopalisades (falsas empalizadas) son zonas hipercelulares que normalmente rodean el tejido necrótico. La necrosis pseudoempalizada indica un tumor agresivo.
Tratamiento
Hay muchas causas de necrosis y, como tal, el tratamiento se basa en cómo se produjo la necrosis. El tratamiento de la necrosis generalmente implica dos procesos distintos: por lo general, la causa subyacente de la necrosis debe tratarse antes de que se pueda tratar el tejido muerto en sí.
- El escombro, refiriéndose a la eliminación del tejido muerto por medios quirúrgicos o no quirúrgicos, es la terapia estándar para la necrosis. Dependiendo de la gravedad de la necrosis, esto puede variar desde la eliminación de pequeños parches de piel hasta la amputación completa de los miembros o órganos afectados. La eliminación química del tejido necromático es otra opción en la que los agentes enzimáticos de escombro, clasificados como proteolíticos, fibrinolíticos o collagenases, se utilizan para apuntar los diversos componentes del tejido muerto. En casos selectos, terapia maggot especial usando Lucilia sericata Larvas ha sido empleada para extirpar el tejido necrótico y la infección.
- En el caso de isquemia, que incluye infarto de miocardio, la restricción del suministro de sangre a los tejidos provoca hipoxia y la creación de especies reactivas de oxígeno (ROS) que reaccionan con proteínas y membranas dañadas y dañan. Los tratamientos antioxidantes se pueden aplicar para escavenear el ROS.
- Las heridas causadas por agentes físicos, incluyendo traumas físicos y quemaduras químicas, se pueden tratar con antibióticos y medicamentos antiinflamatorios para prevenir la infección bacteriana y la inflamación. Mantener la herida limpia de la infección también impide la necrosis.
- Los agentes químicos y tóxicos (p. ej. fármacos, ácidos, bases) reaccionan con la piel que conduce a la pérdida de la piel y eventualmente a la necrosis. El tratamiento implica la identificación y la discontinuación del agente dañino, seguido del tratamiento de la herida, incluyendo la prevención de la infección y posiblemente el uso de terapias inmunosupresoras como medicamentos antiinflamatorios o inmunosupresores. En el ejemplo de una mordedura de serpiente, el uso de anti-venom detiene la propagación de toxinas mientras recibe antibióticos para impedir la infección.
Incluso después de que se haya detenido la causa inicial de la necrosis, el tejido necrótico permanecerá en el cuerpo. La respuesta inmunitaria del cuerpo a la apoptosis, que implica la descomposición y el reciclaje automáticos del material celular, no se desencadena por la muerte celular necrótica debido a la desactivación de la vía apoptótica.
En plantas
Si el calcio es deficiente, la pectina no se puede sintetizar y, por lo tanto, las paredes celulares no se pueden unir y, por lo tanto, un impedimento para los meristemas. Esto conducirá a la necrosis del tallo y las puntas de las raíces y los bordes de las hojas. Por ejemplo, la necrosis del tejido puede ocurrir en Arabidopsis thaliana debido a patógenos de plantas.
Los cactus como el saguaro y el cardón en el desierto de Sonora experimentan la formación de parches necróticos regularmente; una especie de díptero llamada Drosophila mettleri ha desarrollado un sistema de desintoxicación p450 que le permite utilizar los exudados liberados en estos parches para anidar y alimentar a las larvas.
Contenido relacionado
William harvey
Guacamayo
Fagales