Miopatía por almacenamiento de polisacáridos equinos
La miopatía por almacenamiento de polisacáridos equinos (EPSM, PSSM, EPSSM) es una enfermedad hereditaria de almacenamiento de glucógeno de los caballos que causa rabdomiólisis por esfuerzo. Actualmente se sabe que afecta a las siguientes razas: American Quarter Horses, American Paint Horses, Warmbloods, Cobs, Dales Ponies, Thoroughbreds, Arabians, New Forest Ponies y una gran cantidad de razas de caballos pesados. Si bien es incurable, la PSSM se puede controlar con una dieta y ejercicio adecuados. Actualmente existen 2 subtipos, conocidos como PSSM tipo 1 y PSSM tipo 2.
Patophysiology of glycogen storage disorders and sub-typing of PSSM
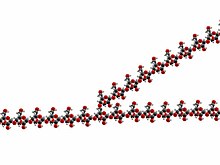
El glucógeno es un polímero molecular de glucosa (un polisacárido) que se utiliza para almacenar energía y es importante para mantener la homeostasis de la glucosa en la sangre, así como para proporcionar energía para la contracción del músculo esquelético y del músculo cardíaco. Las moléculas de glucosa están unidas en cadenas lineales mediante enlaces α-1,4-glucosídicos. Además, se forman ramificaciones de glucosa a partir de la cadena mediante enlaces α-1,6-glucosídicos. Dos moléculas de glucosa se unen en enlaces α-1,4-glucosídicos mediante una enzima conocida como glucógeno sintasa. Este enlace puede romperse por la amilasa cuando el cuerpo desea descomponer el glucógeno en glucosa para obtener energía. La enzima de ramificación del glucógeno es responsable de los enlaces α-1,6-glucosídicos necesarios para iniciar una ramificación de estas cadenas lineales.
Cualquier alteración de este sistema da lugar a una enfermedad de almacenamiento de glucógeno. Actualmente, existen dos subcategorías de enfermedades de almacenamiento de glucógeno en caballos: miopatía de almacenamiento de polisacáridos de tipo 1, deficiencia de la enzima ramificadora de glucógeno y miopatía de almacenamiento de polisacáridos de tipo 2.
Tipo 1 PSSM
La PSSM tipo 1 es causada por una mutación genética autosómica dominante conocida como GSY1. Esta mutación provoca una regulación positiva de la glucógeno sintasa y niveles elevados de glucógeno sintasa en relación con la enzima ramificadora de glucógeno (GBE). Esta relación alterada de glucógeno sintasa a GBE da como resultado moléculas de glucógeno con cadenas largas y pocas ramificaciones, lo que hace que estas moléculas sean algo resistentes a la amilasa. La mutación GSY1 está asociada con un metabolismo de glucosa alterado (pero un metabolismo de glucógeno normal), así como con la acumulación de altos niveles de glucógeno y polisacáridos anormales en los músculos del caballo. Además, se ha demostrado que algunos caballos tienen sensibilidad a la insulina, lo que mejora la absorción de glucosa por las células musculares y contribuye al almacenamiento excesivo de glucógeno que ya está elevado de forma secundaria a la mutación GSY1.
Deficiencia de la enzima ramificadora de Glucógeno
Los niveles bajos de la enzima ramificadora del glucógeno conducen a una afección conocida como deficiencia de la enzima ramificadora del glucógeno. Esta afección es causada por una mutación del gen GBE1, responsable de producir la enzima ramificadora del glucógeno. Posteriormente, se producen moléculas de glucógeno con pocas ramificaciones, lo que disminuye en gran medida el número de extremos no reductores, lo que reduce drásticamente la velocidad a la que se puede sintetizar o descomponer la molécula. Esto provoca niveles bajos de glucógeno muscular que es muy resistente a la amilasa. Esta enfermedad se observa generalmente en potros Quarter Horse y es mortal.
Tipo 2 PSSM
La PSSM tipo 2 es una categoría de trastornos que provocan una deposición anormal de glucógeno en los músculos esqueléticos del caballo que no se debe a mutaciones en GSY1 o GBE1.
Presentación

La PSSM es más frecuente en los caballos Quarter Horse y sus razas relacionadas (Paint Horse, Appaloosa, Appendix Quarter Horse), en las razas de caballos de tiro (especialmente los Belgian Draft y los Percherones) y en las razas de sangre caliente. Se ha demostrado que los Belgian Draft tienen una prevalencia de PSSM del 36%. Otras razas a las que se les ha diagnosticado PSSM incluyen el árabe, el lipizzano, el Morgan, el Mustang, el peruano de Paso, el Rocky Mountain Horse, el Standardbred, el Tennessee Walking Horse, el pura sangre y el National Show Horse. Se ha sugerido que la mutación GSY1 proporcionó algún beneficio a los animales que trabajan duro con dietas de mala calidad, y ahora está dañando a los miembros de esas razas "ahorrativa" que se manejan con niveles de trabajo moderados a bajos y dietas ricas en carbohidratos no estructurales.
El PSSM tipo 1 (homocigoto o heterocigoto para la mutación GSY1) es más común en los Quarter Horses y sus razas relacionadas, y en las razas de tiro, mientras que el PSSM tipo 2 (negativo para la mutación GSY1) se observa con más frecuencia en otras razas, incluidas las de sangre caliente. No existe predilección sexual por la enfermedad.
Signos clínicos
Los caballos con PSSM tipo 1 suelen parecer normales en reposo, pero muestran signos de rabdomiólisis por esfuerzo ('atascamiento') como zancada acortada, rigidez, musculatura firme, sudoración, dolor o renuencia a hacer ejercicio, cuando se les pide que realicen un trabajo liviano. Si bien los episodios de rabdomiólisis por esfuerzo son uno de los signos más frecuentes asociados con los caballos afectados (se informan en aproximadamente el 37 % de los animales afectados), otros signos comunes incluyen anomalías en la marcha, cojera cambiante, debilidad muscular que puede resultar en una incapacidad para levantarse, dolor similar a un cólico y fasciculación, atrofia y/o rigidez muscular (que se observan con mayor frecuencia en los músculos semimembranoso, semitendinoso y longissimus).
Estos signos clínicos suelen aparecer por primera vez cuando el caballo comienza a entrenarse cuando es un animal joven; sin embargo, los caballos afectados mostrarán cambios histológicos compatibles con daño muscular al mes de edad, y también pueden mostrar elevaciones en la creatina quinasa (CK), una enzima que se eleva con el daño muscular. Una enfermedad concurrente, como una infección respiratoria o gastrointestinal, puede provocar elevaciones en la CK y una rabdomiólisis potencialmente mortal, incluso sin ejercicio. Los caballos con PSSM a menudo tienen una CK elevada de forma persistente en reposo, lo que diferencia la enfermedad de la rabdomiólisis recurrente por esfuerzo, en la que los caballos tienen concentraciones normales de CK entre episodios.
Variabilidad del fenotipo y modificación de genes
Algunos animales afectados pueden permanecer subclínicos, otros pueden presentar signos leves que no impidan el rendimiento atlético, mientras que algunos caballos presentarán signos clínicos que les impidan realizar cualquier ejercicio forzado. En raras ocasiones, los caballos mueren por episodios agudos de rabdomiólisis. La razón de esta variabilidad del fenotipo no se entiende por completo. El temperamento, el sexo y el tipo de cuerpo no tienen ningún efecto sobre el grado de signos clínicos. Sin embargo, factores ambientales como la dieta y el ejercicio, si el caballo es heterocigoto u homocigoto para el alelo GSY1 mutado y la presencia de genes modificadores juegan un papel. Además, algunos caballos afectados pueden tener PSSM tipo 2, que producirá diferentes cambios celulares y, posteriormente, diferentes efectos fenotípicos.
Uno de estos genes modificadores es el RYR1, responsable de la regulación del calcio en las células musculares. La mutación del RYR1 causa hipertermia maligna, un trastorno poco frecuente pero potencialmente mortal que suele asociarse a la anestesia. Aunque la mutación del RYR1 es poco frecuente en los caballos, incluida la población general de Quarter Horses, es mucho más común en Quarter Horses con la mutación GSY1. Los caballos con ambas mutaciones tienen más probabilidades de presentar un fenotipo PSSM grave, que incluye niveles más elevados de creatina quinasa (CK) en sangre, una intolerancia al ejercicio más grave, episodios más graves de rabdomiólisis (fasciculaciones musculares más frecuentes, episodios más frecuentes que no están asociados al ejercicio, muerte aguda) y una respuesta deficiente al tratamiento con PSSM.
Además, se han encontrado defectos en los genes GSY1 y SCNA4, responsables de la parálisis periódica hipercalémica (HYPP) en Quarter Horses y razas relacionadas, en el 14 % de los caballos Halter. Una combinación de ambos genes puede causar rabdomiólisis grave si el caballo se recuesta debido a un ataque de HYPP.
Diagnosis
Existe una prueba genética para detectar la PSSM tipo 1. Esta prueba requiere una muestra de sangre o pelo y es menos invasiva que la biopsia muscular. Sin embargo, puede ser menos útil para las razas que se ven más comúnmente afectadas por la PSSM tipo 2, como las razas de caballos ligeros. A menudo se recomienda una biopsia muscular para los caballos que presentan signos clínicos de PSSM pero que tienen resultados negativos para la mutación GSY1.
Se puede tomar una biopsia muscular de los músculos semimembranoso o semitendinoso (isquiotibiales). La biopsia se tiñe para detectar glucógeno, y la intensidad de la captación de la tinción en el músculo, así como la presencia de inclusiones, ayuda a determinar el diagnóstico de PSSM. Esta prueba es el único método para diagnosticar PSSM tipo 2. Los caballos con PSSM tipo 1 generalmente tendrán entre 1,5 y 2 veces los niveles normales de glucógeno en su músculo esquelético. Si bien las anomalías que indican daño muscular se pueden ver en secciones histológicas de músculo a partir del primer mes de edad, la acumulación anormal de polisacáridos puede tardar hasta 3 años en desarrollarse.
Gestión
Efecto del metabolismo
Los caballos con PSSM tienen niveles elevados de glucógeno muscular en reposo. Durante el ejercicio, los niveles de glucógeno se agotan más rápido que en los caballos no afectados y se reducen a niveles considerados normales para un caballo en reposo sin PSSM. Esto demuestra que el metabolismo del glucógeno es en realidad normal en estos animales. Sin embargo, los caballos con PSSM sintetizan glucógeno muscular al doble de la velocidad de un caballo normal una vez que ha cesado el ejercicio, lo que conduce a un aumento del glucógeno muscular. El mecanismo exacto del metabolismo anormal de la glucosa aún no se ha establecido, pero puede tener similitudes con la deficiencia de fosfofructoquinasa en humanos.
Las razas relacionadas con los Quarter Horse con PSSM muestran sensibilidad a la insulina, lo que mejora la absorción de glucosa por parte de las células, y estos caballos eliminan la glucosa de la sangre más rápidamente después de comer que los caballos no afectados. Esto proporciona un fácil acceso a la glucosa por parte de los músculos, que luego pueden usar el sustrato para producir glucógeno. El defecto GSY1, que regula positivamente la enzima glucógeno sintasa, permite que los músculos usen esta glucosa para producir rápidamente glucógeno para almacenarlo en el músculo. Sorprendentemente, no se observa una mayor sensibilidad a la insulina en las razas de caballos de tiro.
Se puede utilizar la manipulación de la dieta y el ejercicio para contrarrestar estos cambios metabólicos. Aproximadamente el 50% de los caballos que cumplen con las recomendaciones dietéticas y el 90% de los caballos que cumplen con las recomendaciones dietéticas y de ejercicio tienen pocos o ningún episodio de rabdomiólisis por esfuerzo.
Dieta
Para la mayoría de los caballos, la dieta tiene un impacto significativo en el grado de los signos clínicos. Se ha demostrado que los caballos con PSSM alimentados con dietas ricas en carbohidratos no estructurales (NSC), que estimulan la secreción de insulina, presentan una mayor gravedad de la rabdomiólisis con el ejercicio. Las recomendaciones actuales para caballos con PSSM incluyen una dieta baja en almidón y alta en grasas. Las dietas bajas en almidón producen niveles bajos de glucosa e insulina en sangre después de comer, lo que puede reducir la cantidad de glucosa absorbida por las células musculares. Las dietas ricas en grasas aumentan las concentraciones de ácidos grasos libres en la sangre, lo que puede promover el uso de grasa para energía (a través de la oxidación de ácidos grasos libres) en lugar del metabolismo de la glucosa. Los caballos con los signos clínicos más graves a menudo muestran la mayor mejora con la dieta.
Las recomendaciones dietéticas suelen incluir una combinación de restricción calórica, reducción del contenido diario de NSC y un aumento de la grasa de la dieta. Las recomendaciones dietéticas deben equilibrarse con la condición corporal del animal y su nivel de ejercicio, ya que puede ser beneficioso esperar para aumentar la grasa de la dieta después de que un animal obeso haya perdido peso. La dieta debe tener <10% de energía digestible proveniente de NSC y entre 15 y 20% de la energía digestible diaria proveniente de grasas.
Ejercicio
Los caballos con PSSM muestran menos signos clínicos si su ejercicio se incrementa lentamente con el tiempo (es decir, se los condiciona lentamente). Además, es mucho más probable que desarrollen rigidez muscular y rabdomiólisis si se ejercitan después de un descanso prolongado en el establo.
Los caballos generalmente presentan menos signos clínicos cuando se les pide que realicen períodos cortos de trabajo a un nivel de actividad máxima (ejercicio anaeróbico), aunque tienen dificultades para alcanzar la velocidad máxima y se cansan más rápido que los caballos no afectados. Tienen más daño muscular cuando se les pide que realicen una actividad de menor intensidad durante un período de tiempo más prolongado (actividad aeróbica), debido a un déficit de energía en el músculo.
Referencias
- ^ a b c d e f h i j k l Mickelson JR, Valberg SJ (2015). "La genética de los trastornos musculares esqueléticos en caballos". Annu. Rev. Anim. Biosci. 3: 197–217. doi:10.1146/annurev-animal-022114-110653. PMID 25387114.
- ^ a b c d Annandale, E. J.; Valberg, S. J.; Mickelson, J. R.; Seaquist, E. R. (octubre de 2004). "La sensibilidad de la insulina y el transporte de glucosa muscular esquelético en caballos con miopatía de almacenamiento de polisacáridos equinos". Trastornos neuromusculares. 14 (10): 666–674. doi:10.1016/j.nmd.2004.05.007. PMID 15351424. S2CID 121731.
- ^ a b c McCue ME, Ribeiro WP, Valberg SJ (agosto de 2006). "Prevalencia de miopatía de almacenamiento de polisacáridos en caballos con trastornos neuromusculares". Equine Veterinary Journal. 38 (S36): 340–344. doi:10.1111/j.2042-3306.2006.tb05565.x. PMID 17402444. S2CID 1861689.
- ^ Firshman AM, Baird JD, Valberg JS (15 de diciembre de 2005). "Prevalencias y signos clínicos de miopatía de almacenamiento de polisacáridos y shivers en caballos belgas". JAVMA. 227 (12): 1958-1964. doi:10.2460/javma.2005.227.1958. PMID 16379634.
- ^ Valentine BA (2003). "Equine polysaccharide storage myopathy". Equine Veterinary Education. 15 (5): 254–262. doi:10.1111/j.2042-3292.2003.tb00537.x.
- ^ a b c d De La Corte FD, Valberg SJ, MacLeay JM, Mickelson JR (2002). "Developmental Onset of Polysaccharide Storage Myopathy in 4 Quarter Horse Foals". Journal of Veterinary Internal Medicine. 16 (5): 581-587. doi:10.1111/j.1939-1676.2002.tb02391.x. PMID 12322710.
- ^ Finno CJ, SPier SJ, Valberg SJ (2009). "Las enfermedades causadas por mutaciones genéticas conocidas". The Veterinary Journal. 179 (3): 336–347. doi:10.1016/j.tvjl.2008.03.016. PMID 18472287.
- ^ a b McCue ME, Valberg SJ, Jackson M, Borgia L, Lucio M, Mickelson JR (enero de 2009). "El fenotipo de miopatía de almacenamiento Polysaccharide en razas relacionadas con caballos trimestrales se modifica por la presencia de una mutación RYR1". Trastornos neuromusculares. 19 (1): 37–43. doi:10.1016/j.nmd.2008.10.001. PMID 19056269. S2CID 28059829.
- ^ Tryon RC, Penedo CT, McCue ME, et al. (enero de 2009). "Evaluación de frecuencias alelo de genes hereditarios de enfermedades en subgrupos de caballos americanos". JAVMA. 234 (1): 120–125. doi:10.2460/javma.234.1.120. PMID 19119976.
- ^ Valberg SJ, Cardinet III GH, Carlson GP, DiMauro S (1992). "Polysaccharide storage myopathy associated with recurrent exertional rhabdomyolysis in Horse". Trastornos neuromusculares. 2 (5–6): 351–359. doi:10.1016/S0960-8966(06)80006-4. PMID 1284408. S2CID 38373381.
- ^ a b Ribeiro WP, Valberg SJ, Pagan JD, Gustavsson BE (2004). "The Effect of Varying Dietary Starch and Fat Content on Serum Creatine Kinase Activity and Substrate Availability in Equine Polysaccharide Storage Myopathy". J Vet Intern Med. 18 (6): 887–894. doi:10.1111/j.1939-1676.2004.tb02637.x. PMID 15638274. S2CID 7326589.
- ^ Corte FD, Valberg SJ, Mickelson JR, Hower-Moritz M (julio de 1999). "Blood glucose clearance after feed and exercise in polysaccharide storage myopathy". Equine Veterinary Journal. 31 324-328. doi:10.1111/j.2042-3306.1999.tb05242.x. PMID 10659276.
- ^ a b c Valberg, Stephanie; James Mickelson. "Polysaccharide Storage Myopathy (PSSM) en caballos". University of Minnesota Equine Center. University of Minnesota. Retrieved 15 de junio 2015.
- ^ Firshman AM, Valberg SJ, et al. (junio de 2008). "La sensibilidad de la insulina en caballos belgas con miopatía de almacenamiento de polisacáridos". American Journal of Veterinary Research. 69 (6): 816–823. doi:10.2460/ajvr.69.6.818. PMID 18518664.
- ^ Firshman AM, Valberg SJ, Bender JB, Finno CJ (octubre de 2003). "Características epídemiológicas y gestión de la miopatía de almacenamiento de polisacáridos en Caballos Trimestres". American Journal of Veterinary Research. 64 (10): 1319–1327. doi:10.2460/ajvr.2003.64.1319. PMID 14596472. S2CID 13060528.
- ^ Annandale EJ, Valberg SJ, Essen-Gustavsson B (mayo de 2005). "Efectos del ejercicio submaximal en concentraciones de nucleótido adenina en fibras musculares esqueléticas de caballos con miopatía de almacenamiento de polisacáridos". Soy J. Vet. Res. 66 (5): 839-845. doi:10.2460/ajvr.2005.66.839. PMID 15934611.