Miopatía mitocondrial
Las Miopatías mitocondriales son tipos de miopatías asociadas con enfermedades mitocondriales. El trifosfato de adenosina (ATP), la sustancia química utilizada para proporcionar energía a la célula, no puede producirse suficientemente mediante fosforilación oxidativa cuando la mitocondria está dañada o le faltan las enzimas o proteínas de transporte necesarias. Con una producción deficiente de ATP en las mitocondrias, existe una dependencia excesiva de la glucólisis anaeróbica que conduce a acidosis láctica, ya sea en reposo o inducida por el ejercicio.
Las miopatías mitocondriales primarias se heredan, mientras que las miopatías mitocondriales secundarias pueden ser hereditarias (p. ej., distrofia muscular de Duchenne) o ambientales (p. ej., miopatía alcohólica). Cuando se trata de una enfermedad primaria hereditaria, se trata de una de las miopatías metabólicas.
En la biopsia, el tejido muscular de los pacientes con estas enfermedades generalmente muestra músculos "rojos irregulares" Fibras musculares en tinción con tricrómico de Gomori. La apariencia roja irregular se debe a una acumulación de mitocondrias anormales debajo de la membrana plasmática. Estas fibras de color rojo irregular pueden contener acumulaciones normales o anormalmente aumentadas de glucógeno y lípidos neutros, y la tinción histoquímica muestra una afectación anormal de la cadena respiratoria, como una disminución de la succinato deshidrogenasa o la citocromo c oxidasa. Se creía que la herencia era materna (extranuclear no mendeliana). Ahora se sabe que ciertas deleciones del ADN nuclear también pueden causar miopatía mitocondrial, como la deleción del gen OPA1.
Signos y síntomas
Los síntomas comunes son debilidad muscular proximal, intolerancia al ejercicio, acidosis láctica, relación alta de lactato/piruvato sérico, CK sérica normal a elevada, disnea y respuesta cardiorrespiratoria exagerada al ejercicio. Puede estar aislada del músculo (miopatía pura) o puede ser sistémica e incluir no solo miopatía, sino también anomalías oculares, neuropatía periférica y anomalías neurológicas. La biopsia muscular generalmente muestra fibras rojas irregulares, la tinción histoquímica muestra una anomalía de la cadena respiratoria o una disminución de la citocromo c oxidasa (COX).
Los cinco más comunes son MELAS, MERF, KSS, CPEO y MNGIE, que se enumeran a continuación:
- Encefalomyopatía mitocondrial, acidosis láctica y síndrome tipo derrame cerebral (MELAS)
- Grados de deterioro cognitivo y demencia
- acidosis láctica
- Strokes
- Ataques isquémicos transitorios
- Pérdida auditiva
- Pérdida de peso
- Epilepsia mioclonica y fibras rojas (MERRF)
- Epilepsia miocánica progresiva
- Los clústeres de mitocondria enferma se acumulan en fibras musculares y aparecen como "fibras rojas enraizadas" cuando el músculo se mancha con la mancha tricroma modificada
- Estatura corta
- Kearns – Síndrome de Sayre (KSS)
- Oftalmología externa
- Defectos de conducción cardiaca
- Pérdida de audición sensorinural
- Oftalmoplegia externa progresiva crónica (CPEO)
- Ophthalmoparesis progresiva
- Sobrelapso sintomático con otras mitocondriales
- Encefalopatía neurogastrointestinal mitocondrial (MNGIE)
- Debilidad muscular y atrofia, más prominente distally
- Hiporeflexión o areflexicismo
- Ptosis y Oftalmoparesis comunes
- Dismotilidad gastrointestinal (como hinchazón, calambres estomacales, diarrea)
Causa
Miopatía mitocondrial significa literalmente enfermedad del músculo mitocondrial, enfermedad muscular causada por una disfunción mitocondrial. La mitocondria es el principal productor de energía en casi todas las células del cuerpo. La excepción son los eritrocitos maduros (glóbulos rojos), que no agotan el oxígeno que transportan. En el ojo, el cristalino y el segmento externo de la retina casi no contienen mitocondrias. Las células musculares tienen muchas mitocondrias, particularmente fibras musculares tipo I, y si las mitocondrias tienen problemas por los cuales no producen suficiente energía para que la célula funcione, surgen problemas.
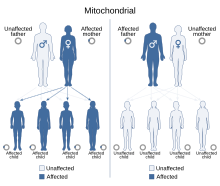
La causa puede ser genética, y muchos tienen herencia mitocondrial (que involucra el ADN mitocondrial que solo se transmite de la madre), aunque las mutaciones del ADN nuclear con herencia mendeliana que son autosómicas dominantes, recesivas o recesivas ligadas al cromosoma X también existir. Un ejemplo de ADN nuclear es una mutación dentro del gen POLG (polimerasa gamma), que hace que el ADN mitocondrial (ADNmt) se dañe y pierda su función.
Lista de enfermedades
Nombre (nombres alternativos) | Gene(s) | Patró n de herencia (MT, AR, AD, X-Linked) | OMIM (GD: descripción de genes, PS: series fenotípicas) |
|---|---|---|---|
| Encefalomyopatía mitocondrial, acidosis láctica y síndrome tipo derrame cerebral (MELAS)
(Miopatía juvenil, encefalopatía, acidosis láctica y derrame cerebral) | MT-TL1, MT-TQ, MT-TH, MT-TK, MT-TC, MT-TS1, MT-ND1, MT-ND5, MT-ND6, MT-TS2 | MT | 540000 |
| Epilepsia mioclonica y fibras rojas (MERRF) | MT-TK, MT-TL1, MT-TH, MT-TS1, MT-TS2, MT-TF | MT | 545000 |
| Kearns – Síndrome de Sayre (KSS)
(Ophthalmoplegia, degeneración pigmentaria de la retina, y miocardiopatía; síndrome oculocranioso; síndrome de ophthalmoplegia-plus; quitopatía mitocondrial, ophthalmoplegia, externo progresivo, con fibras rociadas-rojo; ophtalmoplegia externa crónica con miopatía; CPEO con fibra de rad | MT-TL1 | MT | 530000 |
| Oftalmoplegia externa progresiva crónica (CPEO)
(Ophtalmoplegia externa progresiva con deleciones de ADN mitocondrial, recesivo autosómico/dominante) | POLG, SLC25A4, RNASEH1, TWNK, TK2, POLG2, DGUOK, TOP3A, RRM2B | AR/AD | PS157640 |
| Síndrome de agotamiento del ADN mitocondrial (tipo MNGIE)
(Encefalopatía neurogastrointestinal mitocondrial (MNGIE); síndrome de encefalopatía mioneurogastrointestinal; polineuropatía, oftalmoplegia, leucoencefalopatía y pseudoobstrucción intestinal; síndrome POLIP) | TYMP, RRM2B, POLG, LIG3 | AR | 603041;
612075; 613662; 619780 |
| Sí ndrome de agotamiento del ADN mitocondrial (Tipo de alpers, tipo cardiomiopático, tipo encefalomyopático, tipo hepatocerebral y tipo miopático) | MGME1, SLC25A10, TK2, POLG, SLC25A21, SUCLA2, TWNK, TFAM, AGK, MRM2, SLC25A4, OPA1, SUCLG1 | AR/AD | PS603041 |
| Mitocondrial myopathy, infantile, transient (MMIT)
(Miopatía mitocondrial, infantil, transitoria, debido a la deficiencia de cadena respiratoria; miopatía por deficiencia de COX, infantil, transitoria; deficiencia de cadena respiratoria, infantil, transitoria) | MT-TE | MT | 500009 |
| Mitocondrial myopathy, lethal, infantile (LIMM)
(Miopatía mitocondrial infantil letal) | MT-TT | MT | 551000 |
| Miopatía hereditaria con acidosis láctica (HML)
(Miopatía con intolerancia al ejercicio, tipo sueco; miopatía con deficiencia de deshidrogenasa sucinta y aconitasa; mioglobinuria debido a la glucolisis anormal; síndrome de Larsson-Linderholm; miopatía de Linderholm) | ISCU | AR/AD | 255125 |
| Mitocondrial miopatí a con diabetes (Mitocondrial myopathy, lipid type) | MT-TE | MT | 500002 |
| Diabetes y sordera hereditarias maternamente (MIDD)
(Diabetes y sordera (DAD); síndrome de Ballinger-Wallace; diabetes mellitus no dependiente de la insulina con sordera, heredado maternal) | MT-TL1, MT-TE, MT-TK | MT | 520000 |
| Miopatía, progresiva mitocondrial, con catarata congénita y retraso de desarrollo (MPMCD)
(Miopatía con deficiencia de catarata y cadena respiratoria combinada; deficiencia de complejo mitocondrial, combinada) | GFER | AR | 613076 |
| Miopatía, acidosis láctica y anemia sideroblástica (MLASA)
(Mitocondrial myopathy and sideroblastic anemia) | PUS1, YARS2, MT-ATP6 | AR/MT | 600462 613561 GD: 516060 |
| Miopatía, mitocondrial aislado, autosomal dominante (IMMD) | CHCHD10 | AD | 616209 |
| Miopatía, mitocondrial y ataxia (MMYAT) | MSTO1 | AR/AD | 617675 |
| Mitocondrial miopatía, episódica, con o sin atrofia óptica y leucoencefalopatía reversible (MEOAL) | FDX2 | AR | 251900 |
| Mitocondrial miopatía con acidosis láctica (MMLA) | PNPLA8 | AR | 251950 |
| Mitocondrial myopathy with a defect in mitocondrial-protein transport | Desconocido | AR | 251945 |
| La distrofia misotónica como la miopatía;
Mitocondrial miopatía | MT-TA | MT | GD: 590000 |
| Miopatía mitocondrial aislada | MT-TD | MT | GD: 590015 |
| Miopatía, mitocondrial | MT-TW | MT | GD: 590095 |
| Coenzima Q10 deficiencia, primaria (COQ10D)
(Deficiencia de CoQ10, primaria; deficiencia de ubiquinona; deficiencia de Coenzima Q; deficiencia de CoQ) | COQ2, PDSS1, PDSS2, ADCK3, COQ9, COQ4, COQ7, COQ5 | AR | PS607426 |
| Complejo mitocondrial Deficiencia de I, tipo nuclear (MC1DN)
(NADH:Q(1) deficiencia de oxidoreductasa; deficiencia de reductasa de la NADH-coenzima Q; componente de deshidrogenasa de la NADH mitocondrial del complejo I, deficiencia de) | NDUFA11, NDUF2, NDUFA1 | AR/XL/XLR | PS252010 |
| Deficiencia Mitocondrial complejo II, tipo nuclear (MC2DN)
(Deficiencia de reductasa CoQSuccinate; deficiencia deshidrogenasa succinada) | SDHA, SDHAF1, SDHD, SDHB | AR | PS252011 |
| cytochrome b of complex III (MTCYB);
- La intolerancia al ejercicio; trastorno multisistema; miocardiopatía, histiocitoide infantil; intolerancia al ejercicio, miocardiopatía y displasia septoóptica; síndrome de solapamiento de parkinsonism/MELAS | MT-CYB | MT | GD: 516020 |
| Deficiencia mitocondrial III, tipo nuclear (MC3DN) | BCS1L, TTC19, UQCRQ, UQCRC2, CYC1, UQCC2, LYRM7, UQCC3, UQCRFS1 | AR | PS124000 |
| Deficiencia IV compleja mitocondrial, tipo nuclear (MC4DN)
()deficiencia de mitocondrial complejo IV; deficiencia de citocromo c oxidasa; deficiencia de COX) | SURF1, SCO2, COX10, SCO1, LRPPRC, COX15, COX6B1, TACO1, COX14, COX20, PET100, COA6, COA3, COX8A, COX4I1, APOPT1, COX6A2, PET117, COX5A, COXFA4, COX16, COX11 | AR | PS220110 |
| Deficiencia del complejo mitocondrial V (sintasis ATP), tipo nuclear (MC5DN) | ATPAF2, TMEM70, ATP5E, ATP5F1A, ATP5F1D, ATP5MD, ATP5PO | AR/AD | PS604273 |
| Ditrofia muscular, aguja de extremidad, tipo 1H (As of 2017 was excluded from LGMD for showing histochemical evidence of being a mitocondrial myopathy, but not yet assigned new nomenclature) | Cromosoma 3 (3p23-p25), gen desconocido | AD | 613530 |
Diagnóstico

Biopsia muscular: fibras rojas generalmente irregulares en la tinción tricrómica de Gömöri, acumulación normal o excesiva de glucógeno o lípidos dentro de estas fibras rojas irregulares, tinción histoquímica que muestra un deterioro de la cadena respiratoria, como las fibras COX negativas. Algunas miopatías mitocondriales se limitan a la expresión de la enfermedad únicamente en el músculo esquelético, y los fibroblastos (de la biopsia de piel) parecen normales.
Exámenes de sangre: la relación lactato/piruvato puede estar elevada o normal, la creatina quinasa (CK) puede estar elevada o normal. Panel electrolítico, brecha aniónica, glucosa, vitamina D, TSH, autoanticuerpos anti-HMGCR y AChR para descartar miopatías pseudometabólicas.
Prueba de esfuerzo con ejercicio: respuesta cardiorrespiratoria exagerada al ejercicio (respuesta inapropiada de frecuencia cardíaca rápida al ejercicio con dificultad para respirar [taquicardia y disnea]).
Pruebas de ADN: paneles neuromusculares de secuenciación del exoma completo (WES) (que solo prueban exones) o secuenciación del genoma completo (WGS) para casos más complejos (que prueban exones, intrones y ADN mitocondrial). Inicialmente se pensó que los intrones eran “ADN basura”, pero sin embargo, algunos intrones regulan la expresión de exones. Por ejemplo, en la miopatía mitocondrial de la miopatía hereditaria con acidosis láctica (HML), la mutación patogénica más común es la intrónica IVS5+382 G>C (rs767000507).
Hay dos grupos de ADN que afectan a las mitocondrias: el genoma mitocondrial (ADNmt) y el ADN nuclear. Para las miopatías mitocondriales que implican una única eliminación del ADNmt, solo se encontraría en el ADNmt derivado del músculo, lo que hace que sea necesaria una biopsia del músculo afectado para el análisis del ADN en lugar de saliva o sangre. Incluso entre hermanos con la misma mutación heredada, diferentes grupos de músculos se vieron afectados, y los tejidos no afectados tenían niveles casi normales de ADNmt.
EMG: puede ser normal, miopático o, raramente, neurogénico.
Los síntomas de intolerancia al ejercicio, fatiga muscular anormal, mialgia (dolor muscular), arritmia, posible debilidad muscular proximal fija, depósitos de lípidos, posibles episodios de rabdomiólisis, con síntomas que se hacen evidentes o empeoran durante el ayuno, durante la fiebre, durante la -actividad aeróbica intensa o después de una actividad prolongada: todos estos se superponen con los síntomas de otra miopatía metabólica, la de los trastornos del metabolismo de los ácidos grasos.
Las pruebas de ADN son útiles para determinar entre miopatías metabólicas de presentación similar, pero con origen en el sistema bioenergético diferente. Cuando las pruebas de ADN no son concluyentes, es necesaria una biopsia muscular.
Diagnóstico diferencial
Las enfermedades que imitan los síntomas de la miopatía mitocondrial incluyen desequilibrio electrolítico, miastenia gravis, anomalías de la tiroides, deficiencia de vitamina D, miopatía necrotizante inmunomediada, pseudohipoxia relacionada con la diabetes y trastornos del metabolismo de los ácidos grasos. La hipoxia debida a la isquemia (flujo sanguíneo insuficiente) también altera la fosforilación oxidativa, que puede observarse en la claudicación intermitente, la insuficiencia venosa crónica y el síndrome de atrapamiento de la arteria poplítea. Si los síntomas de fatiga muscular mejoran después de aproximadamente 10 minutos de ejercicio aeróbico de intensidad baja a moderada, o después de aproximadamente 10 minutos de descanso después del ejercicio aeróbico, esto sería indicativo del fenómeno de segundo aliento observado en glucogenosis musculares seleccionadas.
Se pueden encontrar fibras rojas irregulares (una anomalía mitocondrial) en varias miopatías distintas de las miopatías mitocondriales primarias hereditarias. Estos incluyen la enfermedad axonal de Charcot-Marie-Tooth tipos 2CC y 2CC. 2EE, síndrome miasténico congénito tipos 12 y 2. 14, miopatía congénita tipos 10B y 10B. 22A y miopatías relacionadas con MYH7, como la miopatía distal de Laing y la miopatía por almacenamiento de miosina.
La miopatía mitocondrial secundaria puede ser causada por el envejecimiento natural, miopatías inflamatorias y un trastorno por consumo crónico de alcohol. También puede deberse a ciertos medicamentos como estatinas, bupivacaína, medicamentos antiepilépticos (fenitoína, ácido valproico y lamotrigina) e inhibidores nucleósidos de la transcriptasa inversa (medicamentos antivirales) como zidovudina y clevudina.
Algunas miopatías metabólicas afectan múltiples vías bioenergéticas, por ejemplo, la deficiencia múltiple de acil-CoA deshidrogenasa (MADD), anteriormente conocida como acidemia glutárica tipo II (GA-II). Los genes ETF implicados en MADD alteran la beta oxidación (metabolismo de los ácidos grasos), alteran el catabolismo de los aminoácidos (metabolismo de las proteínas) y simultáneamente perjudican la cadena respiratoria al no transferir electrones del FAD+/FADH reducido. 2. El metabolismo alterado de las proteínas conduce a una acumulación de ácido glutárico y otros ácidos. El metabolismo de los ácidos grasos se ve aún más afectado porque la carnitina se utiliza para desintoxicar la acumulación de ácido glutárico, lo que provoca una deficiencia secundaria de carnitina. Aunque MADD afecta múltiples vías bioenergéticas, se clasifica como un trastorno del metabolismo de los ácidos grasos, ya que es la vía bioenergética más afectada por la deficiencia. Sin embargo, es importante señalar como diagnóstico diferencial que no solo los síntomas se superponen con las miopatías mitocondriales, sino que también las biopsias musculares de algunos individuos con MADD muestran fibras COX negativas, deterioro de la cadena respiratoria y deficiencia de coenzima Q10. . Algunas formas de MADD responden bien a la riboflavina, conocida como MADD sensible a riboflavina (RR-MADD).
La intolerancia al ejercicio sensible a la riboflavina (RREI), un trastorno del metabolismo de los ácidos grasos que involucra el gen SLC25A32, tiene síntomas similares a MADD, con una biopsia muscular que muestra fibras rojas irregulares y depósitos de lípidos (principalmente en fibras de tipo I), pequeñas fibras de tipo II. y alteración de la cadena respiratoria mitocondrial dependiente de FAD.
La enfermedad de Pompe (enfermedad por almacenamiento de glucógeno tipo II), otro tipo de miopatía metabólica, tiene disfunción mitocondrial secundaria presente tanto en las formas de aparición más temprana (infantil y juvenil) como en la forma de aparición tardía en adultos.
Las miopatías que involucran el gen DMD, como la distrofia muscular de Duchenne y Becker, tienen una disfunción mitocondrial secundaria que afecta la fosforilación oxidativa. Los mecanismos que conducen a esta disfunción mitocondrial son muchos y aún no se ha dilucidado qué cambios mitocondriales se deben directamente a la enfermedad y cuáles son compensatorios. Tres niños jóvenes no emparentados, con una mutación en el gen DMD, exhibieron una presentación pseudometabólica con síntomas de intolerancia al ejercicio que se manifestaban como mialgia inducida por el ejercicio, rigidez muscular, mioglobinuria y rabdomiólisis.
Se sabe que algunas distrofias musculares de cinturas y extremidades tienen disfunción mitocondrial secundaria, entre ellas: LGMDR1 relacionada con calpaína3 (anteriormente LGMD 2A), LGMDR2 relacionada con disferlina (LGMD 2B), LGMDR3 relacionado con α-sarcoglicano (LGMD 2D), LGMDR5 relacionado con γ-sarcoglicano (LGMD 2C) y LGMDR6 relacionado con δ-sarcoglicano ( LGMD 2F). Además de la miopatía miofibrilar 8 (MFM8) relacionada con PYROXD1, que tiene un fenotipo de cintura y extremidad de inicio en la edad adulta y lentamente progresivo.
Tratamiento
Aunque actualmente no existe cura, hay esperanzas en el tratamiento de esta clase de enfermedades hereditarias a medida que continúan los ensayos.
El entrenamiento aeróbico puede mejorar la capacidad oxidativa al hacer que los músculos esqueléticos se acondicionen aeróbicamente. Los monofosfatos de desoxinucleósidos y el desoxinucleótido tomados por vía oral pueden ayudar en la deficiencia de TK2 (síndrome de agotamiento del ADN mitocondrial 2 de tipo miopático).
Puede ser útil evitar situaciones físicamente estresantes que agoten las reservas de glucógeno, como el ayuno y el ejercicio de resistencia (que dependen predominantemente de la fosforilación oxidativa). Una dieta alta en carbohidratos, baja en grasas y baja en proteínas puede ayudar.