Mezcla zeotrópica
Una mezcla zeotrópica , o mezcla no azeotrópica, es una mezcla con componentes líquidos que tienen diferentes puntos de ebullición. Por ejemplo, el nitrógeno, el metano, el etano, el propano y el isobutano constituyen una mezcla zeotrópica. Las sustancias individuales dentro de la mezcla no se evaporan ni se condensan a la misma temperatura que una sustancia. En otras palabras, la mezcla tiene un deslizamiento de temperatura, ya que el cambio de fase se produce en un rango de temperatura de aproximadamente cuatro a siete grados Celsius, en lugar de a una temperatura constante. En los gráficos de composición de temperatura, este deslizamiento de temperatura puede verse como la diferencia de temperatura entre el punto de burbuja y el punto de rocío. Para mezclas zeotrópicas, las temperaturas en la curva de burbuja (ebullición) están entre las temperaturas de ebullición de los componentes individuales. Cuando una mezcla zeotrópica se hierve o se condensa, la composición del líquido y del vapor cambia según el diagrama de temperatura-composición de la mezcla.
Las mezclas zeotrópicas tienen diferentes características en la ebullición nucleada y convectiva, así como en el ciclo orgánico de Rankine. Debido a que las mezclas zeotrópicas tienen propiedades diferentes a las de los fluidos puros o las mezclas azeotrópicas, las mezclas zeotrópicas tienen muchas aplicaciones únicas en la industria, concretamente en procesos de destilación, refrigeración y limpieza.
Puntos de rocío y burbuja
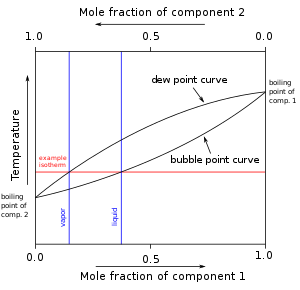
En mezclas de sustancias, el punto de burbuja es la temperatura del líquido saturado, mientras que la temperatura del vapor saturado se llama punto de rocío. Debido a que las líneas de burbuja y rocío del diagrama de temperatura-composición de una mezcla zeotrópica no se cruzan, una mezcla zeotrópica en su fase líquida tiene una fracción diferente de un componente que la fase gaseosa de la mezcla. En un diagrama de temperatura-composición, después de que una mezcla en su fase líquida se calienta a la temperatura en la curva de burbuja (ebullición), la fracción de un componente en la mezcla cambia a lo largo de una línea isotérmica que conecta la curva de rocío con la curva de ebullición como la la mezcla hierve. A cualquier temperatura dada, la composición del líquido es la composición en el punto de burbuja, mientras que la composición del vapor es la composición en el punto de rocío. A diferencia de las mezclas azeotrópicas, no hay ningún punto azeotrópico a ninguna temperatura en el diagrama donde se cruzarían la línea de burbuja y las líneas de rocío. Por lo tanto, la composición de la mezcla siempre cambiará entre las fracciones de los componentes de punto de burbuja y de rocío al hervir de líquido a gas hasta que la fracción de masa de un componente alcance 1 (es decir, la mezcla zeotrópica se separa completamente en sus componentes puros). Como se muestra en la Figura 1, la fracción molar del componente 1 disminuye de 0,4 a aproximadamente 0,15 a medida que la mezcla líquida hierve a la fase gaseosa.
La temperatura se desliza
Las diferentes mezclas zeotrópicas tienen diferentes deslizamientos de temperatura. Por ejemplo, la mezcla zeotrópica R152a/R245fa tiene un deslizamiento de temperatura mayor que R21/R245fa. Una brecha mayor entre los puntos de ebullición crea un mayor deslizamiento de temperatura entre la curva de ebullición y la curva de rocío en una fracción de masa determinada. Sin embargo, con cualquier mezcla zeotrópica, el deslizamiento de temperatura disminuye cuando la fracción de masa de un componente se acerca a 1 o 0 (es decir, cuando la mezcla está casi separada en sus componentes puros) porque las curvas de ebullición y rocío se acercan más a estas fracciones de masa.
Una diferencia mayor en los puntos de ebullición entre las sustancias también afecta las curvas de rocío y burbuja del gráfico. Una diferencia mayor en los puntos de ebullición crea un cambio mayor en las fracciones de masa cuando la mezcla hierve a una temperatura determinada.
Zeotrópico y. mezclas azeotrópicas
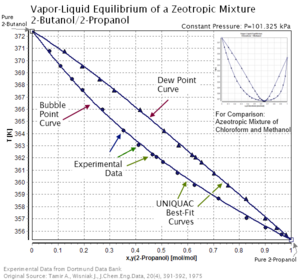
Las mezclas azeotrópicas y zeotrópicas tienen diferentes características de curvas de rocío y burbujas en un gráfico de composición de temperatura. Es decir, las mezclas azeotrópicas tienen curvas de rocío y de burbuja que se cruzan, pero las mezclas zeotrópicas no. En otras palabras, las mezclas zeotrópicas no tienen puntos azeotrópicos. Una mezcla azeotrópica que está cerca de su punto azeotrópico tiene un comportamiento zeotrópico insignificante y es casi azeotrópico en lugar de zeotrópico.
Las mezclas zeotrópicas se diferencian de las mezclas azeotrópicas en que las fases de vapor y líquida de una mezcla azeotrópica tienen la misma fracción de constituyentes. Esto se debe al punto de ebullición constante de la mezcla azeotrópica.
Herviendo
Cuando se sobrecalienta una sustancia, la ebullición en piscina nucleada y la ebullición por flujo convectivo ocurren cuando la temperatura de la superficie utilizada para calentar un líquido es mayor que el punto de ebullición del líquido debido al sobrecalentamiento de la pared.
Piscina nucleada en ebullición
Las características de la ebullición en piscina son diferentes para las mezclas zeotrópicas que para las mezclas puras. Por ejemplo, el sobrecalentamiento mínimo necesario para lograr esta ebullición es mayor para las mezclas zeotrópicas que para los líquidos puros debido a las diferentes proporciones de sustancias individuales en las fases líquida y gaseosa de la mezcla zeotrópica. Las mezclas zeotrópicas y los líquidos puros también tienen diferentes flujos de calor críticos. Además, los coeficientes de transferencia de calor de las mezclas zeotrópicas son menores que los valores ideales predichos utilizando los coeficientes de líquidos puros. Esta disminución en la transferencia de calor se debe al hecho de que los coeficientes de transferencia de calor de las mezclas zeotrópicas no aumentan proporcionalmente con las fracciones de masa de los componentes de la mezcla.
Ebullición del flujo convectivo
Las mezclas zeotrópicas tienen características diferentes en ebullición convectiva que las sustancias puras o las mezclas azeotrópicas. En general, las mezclas zeotrópicas transfieren calor de manera más eficiente en el fondo del fluido, mientras que las sustancias puras y azeotrópicas transfieren calor mejor en la parte superior. Durante la ebullición por flujo convectivo, el espesor de la película líquida es menor en la parte superior de la película que en la parte inferior debido a la gravedad. En el caso de líquidos puros y mezclas azeotrópicas, esta disminución del espesor provoca una disminución de la resistencia a la transferencia de calor. Por tanto, se transfiere más calor y el coeficiente de transferencia de calor es mayor en la parte superior de la película. Lo contrario ocurre con las mezclas zeotrópicas. La disminución en el espesor de la película cerca de la parte superior hace que el componente de la mezcla con el punto de ebullición más alto disminuya en fracción de masa. Por tanto, la resistencia a la transferencia de masa aumenta cerca de la superficie del líquido. Se transfiere menos calor y el coeficiente de transferencia de calor es menor que en el fondo de la película líquida. Debido a que el fondo del líquido transfiere mejor el calor, se requiere una temperatura de pared más baja cerca del fondo que en la parte superior para hervir la mezcla zeotrópica.
Coeficiente de transferencia de calor
Desde temperaturas criogénicas bajas hasta temperaturas ambiente, los coeficientes de transferencia de calor de las mezclas zeotrópicas son sensibles a la composición de la mezcla, el diámetro del tubo de ebullición, los flujos de calor y masa, y la rugosidad de la superficie. Además, diluir la mezcla zeotrópica reduce el coeficiente de transferencia de calor. Disminuir la presión al hervir la mezcla solo aumenta ligeramente el coeficiente. El uso de tubos de ebullición ranurados en lugar de lisos aumenta el coeficiente de transferencia de calor.
Destilación

El caso ideal de destilación utiliza mezclas zeotrópicas. Las mezclas de fluidos zeotrópicos y gaseosos se pueden separar mediante destilación debido a la diferencia en los puntos de ebullición entre las mezclas de componentes. Este proceso implica el uso de columnas de destilación dispuestas verticalmente (ver Figura 2).
Columnas de destilación
Al separar mezclas zeotrópicas con tres o más componentes líquidos, cada columna de destilación elimina solo el componente con el punto de ebullición más bajo y el componente con el punto de ebullición más alto. En otras palabras, cada columna separa dos componentes de forma pura. Si se separan tres sustancias con una sola columna, la sustancia con el punto de ebullición intermedio no se separará puramente y se necesitará una segunda columna. Para separar mezclas formadas por varias sustancias, se debe utilizar una secuencia de columnas de destilación. Este proceso de destilación de varios pasos también se llama rectificación.
En cada columna de destilación, los componentes puros se forman en la parte superior (sección de rectificación) y en la parte inferior (sección de extracción) de la columna cuando el líquido de partida (llamado composición de alimentación) se libera en el medio de la columna. Esto se muestra en la Figura 2. A una determinada temperatura, el componente con el punto de ebullición más bajo (llamado destilado o fracción de cabeza) se vaporiza y se acumula en la parte superior de la columna, mientras que el componente con el punto de ebullición más alto (llamado fondo o fracción de fondo) se recoge en el fondo de la columna. columna. En una mezcla zeotrópica, donde existe más de un componente, los componentes individuales se mueven entre sí a medida que el vapor fluye hacia arriba y el líquido cae.
La separación de mezclas se puede ver en un perfil de concentración. En un perfil de concentración, la posición de un vapor en la columna de destilación se traza frente a la concentración del vapor. El componente con el punto de ebullición más alto tiene una concentración máxima en la parte inferior de la columna, mientras que el componente con el punto de ebullición más bajo tiene una concentración máxima en la parte superior de la columna. El componente con punto de ebullición intermedio tiene una concentración máxima en el medio de la columna de destilación. Debido a cómo se separan estas mezclas, las mezclas con más de tres sustancias requieren más de una columna de destilación para separar los componentes.
Configuraciones de destilación
Se pueden usar muchas configuraciones para separar mezclas en los mismos productos, aunque algunos esquemas son más eficientes y se usan diferentes secuencias de columnas para lograr diferentes necesidades. Por ejemplo, una mezcla zeotrópica ABC se puede separar primero en A y BC antes de separar BC en B y C. Por otro lado, la mezcla ABC se puede separar primero en AB y C, y AB se puede separar finalmente en A y B. Estas dos configuraciones son configuraciones de división brusca en las que la sustancia de punto de ebullición intermedio no contamina cada paso de separación. Por otro lado, la mezcla ABC podría separarse primero en AB y BC y, por último, dividirse en A, B y C en la misma columna. Se trata de una configuración dividida no nítida en la que la sustancia con un punto de ebullición intermedio está presente en diferentes mezclas después de un paso de separación.
Optimización de la eficiencia
Al diseñar procesos de destilación para separar mezclas zeotrópicas, la secuenciación de las columnas de destilación es vital para ahorrar energía y costos. Además, se pueden usar otros métodos para reducir los costos de energía o equipo necesarios para destilar mezclas zeotrópicas. Esto incluye combinar columnas de destilación, usar columnas laterales, combinar columnas principales con columnas laterales y reutilizar el calor residual para el sistema. Después de combinar las columnas de destilación, la cantidad de energía utilizada es sólo la de una columna separada en lugar de la de ambas columnas combinadas. Además, utilizar columnas laterales ahorra energía al evitar que diferentes columnas realicen la misma separación de mezclas. La combinación de columnas principales y laterales ahorra costos de equipo al reducir la cantidad de intercambiadores de calor en el sistema. La reutilización del calor residual requiere que la cantidad de calor y los niveles de temperatura de los residuos coincidan con el calor necesario. Por tanto, utilizar el calor residual requiere cambiar la presión dentro de los evaporadores y condensadores del sistema de destilación para controlar las temperaturas necesarias. Controlar los niveles de temperatura en una parte de un sistema es posible con la tecnología Pinch. Estas técnicas de ahorro de energía tienen una amplia aplicación en la destilación industrial de mezclas zeotrópicas: se han utilizado columnas laterales para refinar el petróleo crudo y cada vez se utiliza más la combinación de columnas principales y laterales.
Ejemplos de mezclas zeotrópicas
En la industria se pueden encontrar ejemplos de destilación de mezclas zeotrópicas. La refinación de petróleo crudo es un ejemplo de destilación de componentes múltiples en la industria que se ha utilizado durante más de 75 años. El petróleo crudo se separa en cinco componentes con columnas principal y lateral en una configuración dividida marcada. Además, el etileno se separa del metano y el etano con fines industriales mediante destilación de múltiples componentes.
La separación de sustancias aromáticas requiere destilación extractiva, por ejemplo, destilar una mezcla zeotrópica de benceno, tolueno y p-xileno.
Refrigeración
A las mezclas zeotrópicas que se utilizan en refrigeración se les asigna un número en la serie 400 para ayudar a identificar su componente y sus proporciones como parte de la nomenclatura. Mientras que a las mezclas azeotrópicas se les asigna un número en la serie 500. Según ASHRAE, los nombres de los refrigerantes comienzan con 'R' seguido de una serie de números (serie 400 si es zeotrópico o 500 si es azeotrópico) seguido de letras mayúsculas que denotan la composición.
La investigación ha propuesto el uso de mezclas zeotrópicas como sustitutos de los refrigerantes halogenados debido a los efectos nocivos que los hidroclorofluorocarbonos (HCFC) y los clorofluorocarbonos (CFC) tienen sobre la capa de ozono y el calentamiento global. Los investigadores se han centrado en utilizar nuevas mezclas que tengan las mismas propiedades que los refrigerantes anteriores para eliminar gradualmente las sustancias halogenadas nocivas, de acuerdo con el Protocolo de Montreal y el Protocolo de Kioto. Por ejemplo, los investigadores descubrieron que la mezcla zeotrópica R-404A puede reemplazar al R-12, un CFC, en los refrigeradores domésticos. Sin embargo, existen algunas dificultades técnicas para el uso de mezclas zeotrópicas. Esto incluye fugas, así como el alto deslizamiento de temperatura asociado con sustancias con diferentes puntos de ebullición, aunque el deslizamiento de temperatura se puede adaptar a la diferencia de temperatura entre los dos refrigerantes al intercambiar calor para aumentar la eficiencia. Reemplazar los refrigerantes puros con mezclas requiere más investigación sobre el impacto ambiental, así como la inflamabilidad y seguridad de las mezclas de refrigerantes.
Ciclo Rankine orgánico
En el ciclo orgánico de Rankine (ORC), las mezclas zeotrópicas son térmicamente más eficientes que los fluidos puros. Debido a sus puntos de ebullición más altos, los fluidos de trabajo zeotrópicos tienen mayores producciones netas de energía a las bajas temperaturas del ciclo de Rankine que las sustancias puras. Los fluidos de trabajo zeotrópicos se condensan en un rango de temperaturas, lo que permite que los intercambiadores de calor externos recuperen el calor de la condensación como fuente de calor para el ciclo Rankine. La temperatura cambiante del fluido de trabajo zeotrópico se puede hacer coincidir con la del fluido que se calienta o enfría para ahorrar calor residual porque el proceso de evaporación de la mezcla ocurre con un deslizamiento de temperatura (consulte Análisis de pellizco).
R21/R245fa y R152a/R245fa son dos ejemplos de fluidos de trabajo zeotrópicos que pueden absorber más calor que el R245fa puro debido a sus mayores puntos de ebullición. La potencia de salida aumenta con la proporción de R152a en R152a/R245fa. R21/R245fa utiliza menos calor y energía que R245fa. En general, la mezcla zeotrópica R21/R245fa tiene mejores propiedades termodinámicas que el R245fa puro y el R152a/R245fa como fluido de trabajo en el ORC.
Procesos de limpieza
Las mezclas zeotrópicas se pueden utilizar como disolventes en procesos de limpieza en la fabricación. Los procesos de limpieza que utilizan mezclas zeotrópicas incluyen procesos cosolventes y procesos bisolventes.
Procesos cosolventes y bisolventes
En un sistema cosolvente, se mezclan dos fluidos miscibles con diferentes puntos de ebullición para crear una mezcla zeotrópica. El primer fluido es un agente solvatante que disuelve la suciedad en el proceso de limpieza. Este fluido es un solvente orgánico con un punto de ebullición bajo y un punto de inflamación mayor que la temperatura de funcionamiento del sistema. Después de que el solvente se mezcla con el aceite, el segundo fluido, un agente de enjuague de hidrofluoroéter (HFE), enjuaga el agente solvatante. El agente solvatante puede ser inflamable porque su mezcla con el HFE no es inflamable. En los procesos de limpieza bisolvente, el agente de enjuague se separa del agente solvatante. Esto hace que los agentes solvatantes y de enjuague sean más efectivos porque no están diluidos.
Los sistemas cosolventes se utilizan para aceites pesados, ceras, grasas y huellas dactilares, y pueden eliminar suciedades más pesadas que los procesos que utilizan disolventes puros o azeotrópicos. Los sistemas cosolventes son flexibles porque se pueden usar diferentes proporciones de sustancias en la mezcla zeotrópica para satisfacer diferentes propósitos de limpieza. Por ejemplo, aumentar la proporción de agente solvatante a agente de enjuague en la mezcla aumenta la solvencia y, por tanto, se utiliza para eliminar suciedades más pesadas.
La temperatura de funcionamiento del sistema depende del punto de ebullición de la mezcla, que a su vez depende de las composiciones de estos agentes en la mezcla zeotrópica. Dado que las mezclas zeotrópicas tienen diferentes puntos de ebullición, el sumidero de limpieza y enjuague tienen diferentes proporciones de agentes de limpieza y solvatación. El agente solvatante de punto de ebullición más bajo no se encuentra en el sumidero de enjuague debido a la gran diferencia en los puntos de ebullición entre los agentes.
Ejemplos de disolventes zeotrópicos
Las mezclas que contienen HFC-43-10mee pueden reemplazar al CFC-113 y al perfluorocarbono (PFC) como solventes en los sistemas de limpieza porque el HFC-43-10mee no daña la capa de ozono, a diferencia del CFC-113 y el PFC. Se encuentran disponibles comercialmente varias mezclas de HFC-43-10mee para diversos fines de limpieza. Ejemplos de disolventes zeotrópicos en procesos de limpieza incluyen:
- Las mezclas Zeotropic de HFC-43-10mee y hexametildisiloxane pueden disolver siliconas y son altamente compatibles con policarbonatos y poliuretano. Se pueden utilizar para eliminar el lubricante de silicona de dispositivos médicos.
- Las mezclas Zeotropic de HFC-43-10mee y isopropanol pueden eliminar iones y agua de materiales sin superficies porosas. Esta mezcla zeotrópica ayuda con secado de absorción.
- Las mezclas Zeotropic de HFC-43-10mee, fluorosurfactant y aditivos antiestáticos son fluidos de secado de eficiencia energética y ambientalmente seguros que proporcionan secado sin mancha.