Metionina sintasa
Metionina sintasa (MS, MeSe, MTR) es responsable de la regeneración de metionina a partir de homocisteína. En humanos está codificado por el gen MTR (5-metiltetrahidrofolato-homocisteína metiltransferasa). La metionina sintasa forma parte del ciclo de biosíntesis y regeneración de S-adenosilmetionina (SAMe), y es la enzima responsable de vincular el ciclo al metabolismo de un carbono a través del ciclo del folato. Hay dos formas principales de esta enzima, la vitamina B12 (cobalamina) dependiente (MetH) y la forma independiente (MetE), aunque en algunas bacterias anaeróbicas también se han descrito metionina sintasas centrales mínimas que no encajan claramente en ninguna de las categorías. Las dos formas dominantes de las enzimas parecen ser evolutivamente independientes y dependen de mecanismos químicos considerablemente diferentes. Los mamíferos y otros eucariotas superiores expresan sólo la forma dependiente de cobalamina. Por el contrario, la distribución de las dos formas en Archaeplastida (plantas y algas) es más compleja. Las plantas poseen exclusivamente la forma independiente de cobalamina, mientras que las algas tienen cualquiera de las dos, dependiendo de la especie. Muchos microorganismos diferentes expresan tanto la forma dependiente como la independiente de cobalamina.
Mecanismo

La metionina sintasa cataliza el paso final en la regeneración de metionina (Met) a partir de homocisteína (Hcy). Tanto la forma de la enzima dependiente como la independiente de cobalamina llevan a cabo la misma reacción química general, la transferencia de un grupo metilo del 5-metiltetrahidrofolato (N5-MeTHF) a la homocisteína, produciendo tetrahidrofolato ( THF) y metionina. La metionina sintasa es la única enzima de los mamíferos que metaboliza el N5-MeTHF para regenerar el cofactor activo THF. En la forma de la enzima dependiente de cobalamina (MetH), la reacción se desarrolla en dos pasos en un mecanismo secuencial ordenado preferido. Se cree que el estado de reposo fisiológico de la enzima contiene el cofactor unido a la enzima (Cob) en forma de metilcobalamina, con el átomo de cobalto en el estado de valencia formal +3 (Cob (III) -Me). Luego, la cobalamina se desmetila mediante tiolato homocisteína activada por zinc, generando metionina y reduciendo el cofactor a un estado Cob (I). Cuando está en la forma Cob(I), el cofactor unido a enzima ahora puede extraer un grupo metilo del 5-metiltetrahidrofolato (N5-MeTHF) activado, produciendo tetrahidrofolato (THF) y regenerando la metilcoalamina. forma de la enzima.

En condiciones fisiológicas, aproximadamente una vez cada 2000 cambios catalíticos, el Co(I) puede oxidarse a Co(II) inactivo en MetH dependiente de mazorca. Para explicar este efecto, la proteína contiene un mecanismo de autorreactivación, un proceso de metilación reductora que utiliza S-adenosilmetionina como donante de metilo distinto. En los seres humanos, la enzima se reduce en este proceso mediante la metionina sintasa reductasa (MTRR), que consta de dominios similares a flavodoxina y ferrodoxina-NADP+ oxidorreductasa (FNR). En muchas bacterias, la reducción se lleva a cabo mediante una proteína flavodoxina de un solo dominio. La proteína reductasa es responsable de la transferencia de un electrón desde un cofactor FMN reducido al Cob (II) inactivo, lo que permite la regeneración de la enzima metilcobalamina activa mediante la transferencia de metilo desde la S-adenosilmetionina al intermedio Cob (I) reducido. Este proceso se conoce como ciclo de reactivación y se cree que se separa del ciclo catalítico normal mediante reordenamientos conformacionales a gran escala dentro de la enzima. Debido a que la oxidación de Cob (I) inevitablemente desactiva la actividad de la metionina sintasa dependiente de la mazorca, se han implicado defectos o deficiencias en la metionina sintasa reductasa en algunas de las asociaciones de enfermedades relacionadas con la deficiencia de metionina sintasa.
El mecanismo de la forma independiente de cobalamina (MetE), por el contrario, se produce mediante una transferencia directa de metilo desde el N5-MeTHF activado a la homocisteína tiolato de zinc. Aunque el mecanismo es considerablemente más simple, la reacción de transferencia directa es mucho menos favorable que las reacciones mediadas por cobalamina y, como resultado, la tasa de recambio de MetE es aproximadamente 100 veces más lenta que la de MetH. Como no contiene el cofactor cobalamina, la enzima independiente de cobalamina no es propensa a la inactivación oxidativa.
Estructura
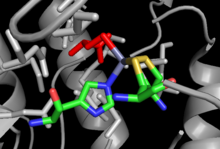
Se han resuelto estructuras de alta resolución mediante cristalografía de rayos X para MetE intacta tanto en ausencia como en presencia de sustratos y para fragmentos de MetH, aunque no existe una descripción estructural de una enzima MetH completamente intacta. Las estructuras disponibles y el análisis bioinformático que las acompaña indican una similitud mínima en la estructura general, aunque existen similitudes dentro de los propios sitios de unión al sustrato. La MetH dependiente de Cob se divide en 4 dominios separados. Los dominios, desde el extremo N al C, se denominan unión a homocisteína (dominio Hcy), unión a N5-metilTHF (dominio MTHF), unión a cobalamina (dominio Cob) y unión a S-adenosimetionina. o dominio de reactivación. El dominio de reactivación se une a SAM y es el sitio de interacción con flavodoxina o metionina sintasa reductasa durante el ciclo de reactivación de la enzima. El dominio de unión a cobalamina contiene dos subdominios, con el cofactor unido al subdominio de unión B12 de Rossman-fold, que a su vez está limitado por el otro subdominio, el subdominio de límite del haz de cuatro hélices. El haz de cuatro hélices sirve para proteger el cofactor de cobalamina de reactividad no deseada, pero puede cambiar significativamente las conformaciones para exponer el cofactor y permitirle acceder a los otros sustratos durante el recambio. Tanto el dominio Hcy como el N5-MeTHF adoptan una arquitectura de barril TIM; el dominio Hcy contiene el sitio de unión al zinc, que en MetH consta de tres residuos de cisteína coordinados con un ion zinc que a su vez se une y activa la Hcy. El dominio de unión de N5-MeTHF se une y activa N5-MeTHF a través de una red de enlaces de hidrógeno con varios residuos de asparagina, arginina y ácido aspártico. Durante el recambio, la enzima sufre cambios conformacionales significativos que implican mover el dominio Cob hacia adelante y hacia atrás desde el dominio Hcy al dominio N5-MeTHF para que se lleven a cabo las dos reacciones de transferencia de metilo.
El MetE independiente de la mazorca consta de dos dominios de barril TIM que se unen a la homocisteína y al N5-MeTHF individualmente. Los dos dominios adoptan una arquitectura de doble barril cara a cara, lo que requiere un proceso de “cierre”. de la estructura tras la unión de ambos sustratos para permitir la transferencia directa de metilo. Las estrategias de unión al sustrato son similares a las del MetH, aunque en el caso del MetE el átomo de zinc está coordinado con dos cisteínas, una histidina y un glutamato, de las cuales se muestra un ejemplo a la derecha.
Función bioquímica

En humanos, el objetivo principal de la enzima es regenerar Met en el ciclo de la S-adenosilmetionina (SAM). El ciclo SAM en un solo recambio consume Met y ATP y genera Hcy, y puede implicar cualquiera de una serie de reacciones enzimáticas críticas que utilizan S-adenosilmetionina como fuente de un grupo metilo activo para la metilación de ácidos nucleicos, histonas, fosfolípidos y diversos proteínas. Como tal, la metionina sintasa cumple una función esencial al permitir que el ciclo SAM se perpetúe sin un flujo constante de Met. Como efecto secundario, la metionina sintasa también sirve para mantener niveles bajos de Hcy y, debido a que la metionina sintasa es una de las pocas enzimas que utiliza N5-MeTHF como sustrato, para mantener indirectamente los niveles de THF.
En bacterias y plantas, la metionina sintasa tiene el doble propósito de perpetuar el ciclo SAM y catalizar el paso sintético final en la síntesis de novo de Met, que es uno de los 20 aminoácidos canónicos. Si bien la reacción química es exactamente la misma para ambos procesos, la función general es distinta de la metionina sintasa en humanos porque Met es un aminoácido esencial que no se sintetiza de novo en el cuerpo.
Importancia clínica
Se han identificado mutaciones en el gen MTR como la causa subyacente de la deficiencia de metilcobalamina del grupo de complementación G, o deficiencia de metilcobalamina de tipo cblG. La deficiencia o desregulación de la enzima debido a una deficiencia de metionina sintasa reductasa puede resultar directamente en niveles elevados de homocisteína (hiperhomocisteinemia), que se asocia con ceguera, síntomas neurológicos y defectos de nacimiento. Las deficiencias de metionina sintasa reductasa (MTRR) o metilentetrahidrofolato reductasa (MTHFR) también pueden provocar esta afección. La mayoría de los casos de deficiencia de metionina sintasa son sintomáticos dentro de los 2 años posteriores al nacimiento y muchos pacientes desarrollan rápidamente encefalopatía grave. Una consecuencia de la reducción de la actividad de la metionina sintasa que se puede medir mediante análisis de sangre clínicos de rutina es la anemia megaloblástica.
Genética
Se han identificado varios polimorfismos asociados a cblG en el gen MTR.
- 2756D→G (Asp919Gly)
- 3804C→T (Pro1137Leu)
- Δ2926A-2928T (ΔIle881)