Metionina
Metionina (símbolo Met o M) () es un aminoácido esencial en humanos. Como precursor de otros aminoácidos como la cisteína y la taurina, compuestos versátiles como SAM-e y el importante antioxidante glutatión, la metionina desempeña un papel fundamental en el metabolismo y la salud de muchas especies, incluidos los humanos. Está codificado por el codón AUG.
La metionina también es una parte importante de la angiogénesis, el crecimiento de nuevos vasos sanguíneos. La suplementación puede beneficiar a quienes sufren de envenenamiento por cobre. El consumo excesivo de metionina, el donante del grupo metilo en la metilación del ADN, está relacionado con el crecimiento del cáncer en varios estudios. La metionina fue aislada por primera vez en 1921 por John Howard Mueller.
Detalles bioquímicos
La metionina (abreviada como Met o M; codificada por el codón AUG) es un α-aminoácido que se utiliza en la biosíntesis de proteínas. Contiene un grupo carboxilo (que se encuentra en la forma −COO− desprotonada en condiciones de pH biológico), un grupo amino (que se encuentra en la forma protonada −NH+
3 bajo condiciones biológicas de pH) ubicado en posición α con respecto al grupo carboxilo, y una cadena lateral S-metil tioéter, clasificando como un aminoácido alifático no polar.
En genes nucleares de eucariotas y Archaea, la metionina está codificada por el codón de inicio, lo que significa que indica el inicio de la región codificante y es el primer aminoácido producido en un polipéptido naciente durante la traducción del ARNm.
Un aminoácido proteinogénico
Junto con la cisteína, la metionina es uno de los dos aminoácidos proteinogénicos que contienen azufre. Excluyendo las pocas excepciones en las que la metionina puede actuar como un sensor redox (por ejemplo,), los residuos de metionina no tienen un papel catalítico. Esto contrasta con los residuos de cisteína, donde el grupo tiol tiene un papel catalítico en muchas proteínas. Sin embargo, el tioéter tiene un papel estructural menor debido al efecto de estabilidad de las interacciones S/π entre el átomo de azufre de la cadena lateral y los aminoácidos aromáticos en un tercio de todas las estructuras proteicas conocidas. Esta falta de un papel importante se refleja en los experimentos en los que se observa poco efecto en proteínas en las que la metionina se sustituye por norleucina, un aminoácido de cadena lateral de hidrocarburo lineal que carece del tioéter. Se ha conjeturado que la norleucina estaba presente en las primeras versiones del código genético, pero la metionina se introdujo en la versión final del código genético debido al hecho de que se usa en el cofactor S-adenosilmetionina (SAM-e). Esta situación no es única y puede haber ocurrido con la ornitina y la arginina.
Codificación
La metionina es uno de los dos únicos aminoácidos codificados por un solo codón (AUG) en el código genético estándar (el triptófano, codificado por UGG, es el otro). En reflejo del origen evolutivo de su codón, los otros codones AUN codifican isoleucina, que también es un aminoácido hidrofóbico. En el genoma mitocondrial de varios organismos, incluidos los metazoos y la levadura, el codón AUA también codifica para la metionina. En el código genético estándar, los códigos AUA para la isoleucina y el ARNt respectivo (ileX en Escherichia coli) utiliza la base inusual lisidina (bacteria) o agmatidina (arqueas) para discriminar contra AUG.
El codón de metionina AUG también es el codón de inicio más común. Un "Inicio" El codón es un mensaje para un ribosoma que señala el inicio de la traducción de proteínas desde el ARNm cuando el codón AUG está en una secuencia consenso de Kozak. Como consecuencia, la metionina a menudo se incorpora en la posición N-terminal de las proteínas en eucariotas y arqueas durante la traducción, aunque puede eliminarse mediante modificación postraduccional. En bacterias, el derivado N-formilmetionina se usa como aminoácido inicial.
Derivados
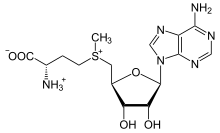
S-Adenosilmetionina
El derivado de metionina S-adenosilmetionina (SAM-e) es un cofactor que sirve principalmente como donante de metilo. SAM-e está compuesto por una molécula de adenosilo (a través del carbono 5 ') unida al azufre de la metionina, lo que lo convierte en un catión de sulfonio (es decir, tres sustituyentes y carga positiva). El azufre actúa como un ácido de Lewis suave (es decir, donante/electrófilo) que permite que el grupo S-metilo se transfiera a un sistema de oxígeno, nitrógeno o aromático, a menudo con la ayuda de otros cofactores como como cobalamina (vitamina B12 en humanos). Algunas enzimas usan SAM-e para iniciar una reacción de radicales; estos se llaman enzimas radicales SAM-e. Como resultado de la transferencia del grupo metilo, se obtiene S-adenosilhomocisteína. En las bacterias, esto se regenera por metilación o se recupera eliminando la adenina y la homocisteína, dejando que el compuesto dihidroxipentandiona se convierta espontáneamente en el autoinductor-2, que se excreta como producto de desecho o señal de quórum.
Biosíntesis
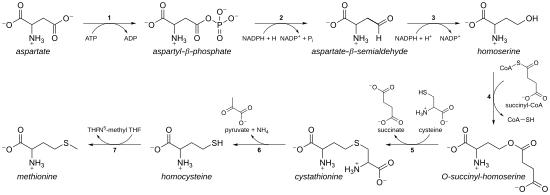
Como aminoácido esencial, la metionina no se sintetiza de novo en humanos y otros animales, que deben ingerir metionina o proteínas que contengan metionina. En plantas y microorganismos, la biosíntesis de la metionina pertenece a la familia de los aspartatos, junto con la treonina y la lisina (vía diaminopimelato, pero no vía α-aminoadipato). La columna vertebral principal se deriva del ácido aspártico, mientras que el azufre puede provenir de la cisteína, el metanotiol o el sulfuro de hidrógeno.
- En primer lugar, el ácido aspartico se convierte a través de semialdehído β-aspartyl en la homoserina por dos pasos de reducción del grupo terminal de carboxilo (por lo tanto, la homoserina tiene un γ-hidroxil, por lo tanto la serie homo-). El semialdehído intermedio aspartado es el punto de ramificación con la vía biosintética lisina, donde se condensa con piruvato. Homoserina es el punto de ramificación con la vía threonina, donde en cambio se isomeriza después de activar el hidroxilo terminal con fosfato (también utilizado para la biosíntesis metionina en plantas).
- La Homoserina se activa con un fosfato, succinilo o un grupo acetil sobre el hidroxilo.
- En las plantas y posiblemente en algunas bacterias, se utiliza fosfato. Este paso se comparte con la biosíntesis trionina.
- En la mayoría de los organismos, un grupo acetil se utiliza para activar la homoserina. Esto puede ser catalizado en bacterias por una enzima codificada por metX o metA (no homologues).
- En enterobacteria y un número limitado de otros organismos, se utiliza el sucinto. La enzima que cataliza la reacción es MetA y la especificidad para acetil-CoA y succinyl-CoA es dictada por un solo residuo. La base fisiológica para la preferencia del acetil-CoA o succinyl-CoA es desconocida, pero tales rutas alternativas están presentes en algunas otras vías (Por ejemplo. Biosíntesis de lisina y biosíntesis de arginina).
- El grupo de activación hidroxil se reemplaza con cisteína, metanol o sulfuro de hidrógeno. Una reacción de reemplazo es técnicamente una γ-elimination seguido de una variante de una adición de Miguel. Todas las enzimas involucradas son homologues y miembros del metabolismo Cis/Met familia de enzimas dependientes de PLP, que es un subconjunto de la PLP-dependiente del doble tipo I clade. Utilizan el cofactor PLP (fosfato piridoxal), que funciona mediante la estabilización de intermediarios de carbanión.
- Si reacciona con cisteína, produce cistationina, la cual es liberada para rendir homocisteína. Las enzimas involucradas son cistathionina-γ-synthase (codificado por metB en bacterias) y citonina-β-lisa (metC). La cistationina está ligada de manera diferente en las dos enzimas que permiten que se produzcan reacciones β o γ.
- Si reacciona con sulfuro de hidrógeno gratuito, produce homocisteína. Esto es catalizado por O-acetylhomoserine aminocarboxypropyltransferase (antes conocido como O-acetilhomoserina (thiol)-lyase. Es codificado por cualquiera mety o metZ en bacterias.
- Si reacciona con metanol, produce metionina directamente. El metanol es un subproducto de la vía catabólica de ciertos compuestos, por lo que esta ruta es más infrecuente.
- Si se produce homocisteína, el grupo thiol se metiliza, dando metionina. Se conocen dos sintasas metioninas; una es cobalamina (vitamina B12) dependiente y uno es independiente.
La vía que utiliza cisteína se denomina "vía de transsulfuración", mientras que la vía que utiliza sulfuro de hidrógeno (o metanotiol) se denomina "vía de sulfurilación directa".
La cisteína se produce de manera similar, es decir, se puede hacer a partir de una serina activada y de homocisteína ("ruta de transsulfurilación inversa") o de sulfuro de hidrógeno ("ruta de sulfurilación directa"); la serina activada es generalmente O-acetilserina (a través de CysK o CysM en E. coli), pero en Aeropyrum pernix y algunas otras arqueas O-fosfoserina. CysK y CysM son homólogos, pero pertenecen al clado PLP tipo III.
Vía de transsulfuración
Enzimas implicadas en la E. coli ruta de transsulfurilación de la biosíntesis de metionina:
- Aspartokinase
- Aspartate-semialdehyde dehydrogenase
- Homoserine dehydrogenase
- Homoserine O-transsuccinylase
- Cystathionine-γ-synthase
- Cystathionine-β-lyase
- Sinthasa metionina (en mamíferos, este paso es realizado por la homocisteína metiltransferasa o betaine—homocysteine S-methyltransferase.)
Otras vías bioquímicas
Aunque los mamíferos no pueden sintetizar metionina, aún pueden usarla en una variedad de vías bioquímicas:
Catabolismo
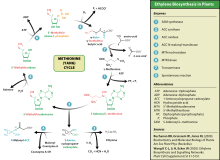
La metionina se convierte en S-adenosilmetionina (SAM-e) mediante (1) metionina adenosiltransferasa.
SAM-e sirve como donante de metilo en muchas (2) reacciones de metiltransferasa y se convierte en S-adenosilhomocisteína (SAH).
(3) adenosilhomocisteasa cisteína
Regeneración
La metionina se puede regenerar a partir de homocisteína a través de (4) metionina sintasa en una reacción que requiere vitamina B12 como cofactor.
La homocisteína también se puede remetilar usando glicina betaína (N,N,N-trimetilglicina, TMG) a metionina a través de la enzima betaína- homocisteína metiltransferasa (E.C.2.1.1.5, BHMT). La BHMT constituye hasta el 1,5 % de toda la proteína soluble del hígado, y la evidencia reciente sugiere que puede tener una mayor influencia en la homeostasis de la metionina y la homocisteína que la metionina sintasa.
Vía de transulfurilación inversa: conversión a cisteína
La homocisteína se puede convertir en cisteína.
- (5) Cystathionine-β-synthase (enzima que requiere la forma activa de la vitamina B6, fosfato piridoxal) combina homocisteína y serina para producir cistationina. En lugar de degradar la cistationina a través de la cistolatina-β-lyase, como en la vía biosintética, la cistationina se descompone a la cisteína y α-ketobutyrate a través de (6) citostationina-γ-lisa.
- (7) La enzima α-ketoacid dehidrogenasa convierte α-ketobutyrate a propionyl-CoA, que se metaboliza a succinyl-CoA en un proceso de tres pasos (ver propionyl-CoA para la vía).
Síntesis de etileno
Este aminoácido también es utilizado por las plantas para la síntesis de etileno. El proceso se conoce como el ciclo Yang o el ciclo de la metionina.
Síntesis química
La síntesis industrial combina acroleína, metanotiol y cianuro, lo que produce la hidantoína. La metionina racémica también se puede sintetizar a partir de ftalimidomalonato dietílico de sodio mediante alquilación con sulfuro de cloroetilmetilo (ClCH2CH2SCH3) seguida de hidrólisis y descarboxilación.
Nutrición humana
Requisitos
La Junta de Alimentos y Nutrición del Instituto de Medicina de EE. UU. estableció cantidades dietéticas recomendadas (RDA) para aminoácidos esenciales en 2002. Para la metionina combinada con cisteína, para adultos de 19 años y mayores, 19 mg/kg de peso corporal/día.
Esto se traduce en aproximadamente 1,33 gramos por día para una persona de 70 kilogramos.
Fuentes dietéticas
| Alimentos | g/100 g |
|---|---|
| Huevo, blanco, seco, polvo, glucosa reducida | 3.204 |
| Harina de semillas de sésamo (grasa baja) | 1.656 |
| Nueces de Brasil | 1.124 |
| Queso, parmesano, triturado | 1.114 |
| semilla de cáñamo, casco | 0.933 |
| Concentración de proteínas de soja | 0.814 |
| Pollo, caldo o freidora, asado | 0.801 |
| Pescado, atún, luz, enlatado en agua, sólidos drenados | 0,7555 |
| Carne, curada, seca | 0.749 |
| Bacon | 0,593 |
| semillas de chia | 0.588 |
| carne, tierra, 95% de carne magra / 5% de grasa, cruda | 0.565 |
| cerdo, suelo, 96% magro / 4% grasa, crudo | 0.564 |
| Soybeans | 0.547 |
| germen de trigo | 0.456 |
| Huevo, entero, cocido, duro | 0.392 |
| Carne | 0.312 |
| Maní | 0.309 |
| Chickpea | 0,253 |
| Corn, amarillo | 0.197 |
| Almendras | 0.151 |
| frijoles, pinto, cocidos | 0.117 |
| Lentils, cocinado | 0,077 |
| Arroz, marrón, mediano, cocinado | 0,052 |
Se pueden encontrar altos niveles de metionina en los huevos, la carne y el pescado; semillas de sésamo, nueces de Brasil y algunas otras semillas de plantas; y granos de cereales. La mayoría de las frutas y verduras contienen muy poco. La mayoría de las legumbres, aunque densas en proteínas, son bajas en metionina. Las proteínas sin metionina adecuada no se consideran proteínas completas. Por esa razón, a veces se agrega metionina racémica como ingrediente a los alimentos para mascotas.
Restricción
Alguna evidencia científica indica que restringir el consumo de metionina puede aumentar la esperanza de vida de las moscas de la fruta.
Un estudio de 2005 mostró que la restricción de metionina sin restricción de energía prolonga la vida útil de los ratones. Esta extensión requiere una señalización intacta de la hormona del crecimiento, ya que los animales sin una señalización intacta de la hormona del crecimiento no tienen un aumento adicional en la esperanza de vida cuando se les restringe la metionina. La respuesta metabólica a la restricción de metionina también se altera en los mutantes de señalización de la hormona del crecimiento de ratón.
Un estudio publicado en Nature mostró que agregar solo el aminoácido esencial metionina a la dieta de las moscas de la fruta bajo restricción dietética, incluida la restricción de aminoácidos esenciales (EAA), restauró la fertilidad sin reducir la esperanza de vida más larga que es típica de la restricción dietética. lo que llevó a los investigadores a determinar que la metionina "actúa en combinación con uno o más EAA para acortar la vida útil". La restauración de la metionina en la dieta de ratones con un régimen de restricción dietética bloquea muchos de los beneficios agudos de la restricción dietética, un proceso que puede estar mediado por una mayor producción de sulfuro de hidrógeno.
La restricción de metionina puede aumentar la circulación de la hormona hepática FGF21 entre 5 y 10 veces en ratones. Varios estudios mostraron que la restricción de metionina también inhibe los procesos de enfermedades relacionadas con el envejecimiento en ratones e inhibe la carcinogénesis de colon en ratas. En humanos, la restricción de metionina a través de la modificación de la dieta podría lograrse a través de una dieta basada en plantas.
La restricción de metionina en la dieta reduce los niveles de su catabolito S-adenosilmetionina (SAM-e), lo que resulta en una pérdida posterior de la metilación de histonas. Un proceso activo mediado por una metilación preservada específica de H3K9 conserva la memoria del perfil de metilación original, lo que permite restaurar el epigenoma cuando los niveles de metionina en la dieta regresan.
Un estudio de 2009 en ratas mostró que "la suplementación con metionina en la dieta aumenta específicamente la producción de ROS mitocondrial y el daño oxidativo del ADN mitocondrial en las mitocondrias del hígado de rata, lo que ofrece un mecanismo plausible para su hepatotoxicidad".
Sin embargo, dado que la metionina es un aminoácido esencial, no se puede eliminar por completo de los animales' dietas sin enfermedad o muerte que ocurra con el tiempo. Por ejemplo, las ratas alimentadas con una dieta sin metionina y colina desarrollaron esteatohepatitis (hígado graso) y anemia, y perdieron dos tercios de su peso corporal durante 5 semanas. La administración de metionina mejoró las consecuencias patológicas de la privación de metionina. La eliminación a corto plazo de solo metionina de la dieta puede revertir la obesidad inducida por la dieta y promueve la sensibilidad a la insulina en ratones, y la restricción de metionina también protege un modelo de ratón de obesidad poligénica espontánea y diabetes.
Salud
La pérdida de metionina se ha relacionado con el envejecimiento senil del cabello. Su falta conduce a una acumulación de peróxido de hidrógeno en los folículos pilosos, una reducción de la eficacia de la tirosinasa y una pérdida gradual del color del cabello. La metionina eleva la concentración intracelular de glutatión, promoviendo así la defensa celular mediada por antioxidantes y la regulación redox. También protege a las células contra la pérdida de células nigrales inducida por la dopamina mediante la unión de metabolitos oxidativos.
La metionina es un intermediario en la biosíntesis de cisteína, carnitina, taurina, lecitina, fosfatidilcolina y otros fosfolípidos. La conversión inadecuada de metionina puede provocar aterosclerosis debido a la acumulación de homocisteína.
Otros usos
DL: la metionina a veces se administra como suplemento a los perros; Ayuda a reducir las posibilidades de cálculos renales en perros. También se sabe que la metionina aumenta la excreción urinaria de quinidina al acidificar la orina. Los antibióticos aminoglucósidos utilizados para tratar infecciones del tracto urinario funcionan mejor en condiciones alcalinas, y la acidificación urinaria por el uso de metionina puede reducir su eficacia. Si un perro sigue una dieta que acidifica la orina, no se debe usar metionina.
La metionina está permitida como complemento del alimento orgánico para aves bajo el programa orgánico certificado de EE. UU.
La metionina se puede usar como una opción de pesticida no tóxico contra las orugas gigantes de cola de golondrina, que son una plaga grave para los cultivos de naranja.
Contenido relacionado
Gametofito
Eneldo
Michael Behe