Metátesis de olefinas
La metátesis de olefinas o metátesis olefínica es una reacción orgánica que implica la redistribución de fragmentos de alquenos (olefinas) por escisión y regeneración de dobles enlaces carbono-carbono. Debido a la relativa simplicidad de la metátesis de olefinas, a menudo crea menos subproductos no deseados y desechos peligrosos que las reacciones orgánicas alternativas. Por su elucidación del mecanismo de reacción y su descubrimiento de una variedad de catalizadores altamente activos, Yves Chauvin, Robert H. Grubbs y Richard R. Schrock recibieron colectivamente el Premio Nobel de Química 2005.
Catalizadores
La reacción requiere catalizadores metálicos. La mayoría de los procesos comercialmente importantes emplean catalizadores heterogéneos. Los catalizadores heterogéneos a menudo se preparan mediante la activación in situ de haluros metálicos (MCl x) utilizando compuestos de organoaluminio u organoestaño, por ejemplo, combinando MCl x –EtAlCl 2. Un soporte de catalizador típico es la alúmina. Los catalizadores comerciales a menudo se basan en molibdeno y rutenio. Los compuestos organometálicos bien definidos se han investigado principalmente para reacciones a pequeña escala o en la investigación académica. Los catalizadores homogéneos a menudo se clasifican como catalizadores de Schrock y catalizadores de Grubbs. Los catalizadores de Schrock cuentan con centros basados en molibdeno (VI) y tungsteno (VI) respaldados por ligandos de alcóxido e imido.

Los catalizadores de Grubbs, por otro lado, son complejos carbenoides de rutenio (II). Se conocen muchas variaciones de los catalizadores de Grubbs. Algunos se han modificado con un ligando de isopropoxibencilideno quelante para formar el catalizador Hoveyda-Grubbs relacionado.

Aplicaciones
La metátesis de olefinas tiene varias aplicaciones industriales. Casi todas las aplicaciones comerciales emplean catalizadores heterogéneos utilizando catalizadores desarrollados mucho antes del trabajo ganador del Premio Nobel sobre complejos homogéneos. Los procesos representativos incluyen:
- La triolefina Phillips y la tecnología de conversión de olefinas. Este proceso interconvierte propileno con etileno y 2-butenos. Se utilizan catalizadores de renio y molibdeno. Sin embargo, hoy en día sólo se practica industrialmente la reacción inversa, es decir, la conversión de etileno y 2-buteno en propileno.
- El proceso de olefina superior de Shell (SHOP) produce (alfa-olefinas) para convertirlas en detergentes. El proceso recicla ciertas fracciones de olefinas mediante metátesis.
- Producción de neohexeno, que implica etenolisis de dímeros de isobuteno. El catalizador se deriva de trióxido de tungsteno soportado sobre sílice y MgO.
- El 1,5-hexadieno y el 1,9-decadieno, agentes reticulantes e intermedios sintéticos útiles, se producen comercialmente mediante etenolisis de 1,5-ciclooctadieno y cicloocteno. El catalizador se deriva de Re 2 O 7 sobre alúmina.
- Síntesis de fármacos,
Potencial de catalizador homogéneo
Los catalizadores moleculares se han explorado para la preparación de una variedad de aplicaciones potenciales. la fabricación de materiales de alta resistencia, la preparación de nanopartículas contra el cáncer y la conversión de materias primas renovables de origen vegetal en productos para el cuidado del cabello y la piel.
Tipos
Algunas clases importantes de metátesis de olefina incluyen:
- Metátesis cruzada (CM)
- Metátesis de apertura de anillo (ROM)
- Metátesis de cierre de anillo (RCM)
- Polimerización por metátesis de apertura de anillo (ROMP)
- Metátesis de dieno acíclico (ADMET)
- etenólisis
Mecanismo
Hérisson y Chauvin propusieron por primera vez el mecanismo ampliamente aceptado de metátesis de alquenos de metales de transición. La cicloadición directa [2+2] de dos alquenos está formalmente prohibida por simetría y, por lo tanto, tiene una alta energía de activación. El mecanismo de Chauvin implica la cicloadición [2+2] de un doble enlace de alqueno a un alquilideno de metal de transición para formar un metalaciclobutano intermedio. El metalaciclobutano producido puede luego cicloeliminarse para dar la especie original o un nuevo alqueno y alquilideno. La interacción con los orbitales d en el catalizador metálico reduce la energía de activación lo suficiente como para que la reacción pueda proceder rápidamente a temperaturas modestas.

La metátesis de olefinas implica un pequeño cambio en la entalpía para los alquenos no tensados. En cambio, las distribuciones de productos están determinadas por el principio de Le Chatelier, es decir, la entropía.

La metátesis cruzada y la metátesis de cierre de anillo están impulsadas por la evolución favorecida entrópicamente de etileno o propileno, que pueden eliminarse del sistema porque son gases. Debido a esto, las reacciones de CM y RCM a menudo usan alfa-olefinas. La reacción inversa de CM de dos alfa-olefinas, la etenólisis, se puede favorecer pero requiere altas presiones de etileno para aumentar la concentración de etileno en solución. La reacción inversa de RCM, metátesis de apertura de anillo, también puede verse favorecida por un gran exceso de una alfa-olefina, a menudo estireno. La metátesis de apertura de anillo generalmente involucra un alqueno tenso (a menudo un norborneno) y la liberación de tensión anular impulsa la reacción. La metátesis de cierre de anillo, por el contrario, suele implicar la formación de un anillo de cinco o seis miembros, que es entálpicamente favorable; aunque estas reacciones tienden a desprender también etileno, como se discutió anteriormente. RCM se ha utilizado para cerrar macrociclos más grandes, en cuyo caso la reacción puede controlarse cinéticamente ejecutando la reacción a diluciones altas.Los mismos sustratos que se someten a RCM pueden sufrir metátesis de dieno acíclico, con ADMET favorecido a altas concentraciones. El efecto Thorpe-Ingold también puede aprovecharse para mejorar tanto las velocidades de reacción como la selectividad del producto.
La metátesis cruzada es sintéticamente equivalente a (y ha reemplazado) un procedimiento de ozonólisis de un alqueno a dos fragmentos de cetona seguido de la reacción de uno de ellos con un reactivo de Wittig.
Panorama historico
"La metátesis de olefinas es hija de la industria y, como ocurre con muchos procesos catalíticos, se descubrió por accidente". Como parte del trabajo en curso en lo que más tarde se conocería como catálisis Ziegler-Natta, Karl Ziegler descubrió la conversión de etileno en 1-buteno en lugar de un hidrocarburo saturado de cadena larga (ver efecto níquel).
En 1960, un grupo de investigación de Du Pont polimerizó norborneno a polinorborneno usando tetraheptilo de litio y aluminio y tetracloruro de titanio (una patente de esta empresa sobre este tema data de 1955),
una reacción entonces clasificada como una llamada polimerización de coordinación. De acuerdo con el mecanismo de reacción propuesto entonces, un intermedio de titanio RTiX primero se coordina con el doble enlace en un complejo pi. Entonces, el segundo paso es una reacción SNi concertada que rompe un enlace CC y forma un nuevo enlace alquilideno-titanio; el proceso luego se repite con un segundo monómero:
Solo mucho más tarde, el polinorborneno se iba a producir a través de la polimerización por metátesis de apertura de anillo. El trabajo de DuPont fue dirigido por Herbert S. Eleuterio. Giulio Natta en 1964 también observó la formación de un polímero insaturado al polimerizar ciclopenteno con haluros de tungsteno y molibdeno.
En un tercer desarrollo que condujo a la metátesis de olefinas, los investigadores de Phillips Petroleum Company en 1964 describieron la desproporción de olefinas con catalizadores hexacarbonilo de molibdeno, hexacarbonilo de tungsteno y óxido de molibdeno soportados en alúmina, por ejemplo, convirtiendo propileno en una mezcla igual de etileno y 2-buteno para la cual propusieron un mecanismo de reacción que involucra un ciclobutano (lo llamaron cuasiciclobutano) - complejo metálico:
Este mecanismo particular es simetría prohibida según las reglas de Woodward-Hoffmann formuladas por primera vez dos años antes. Los ciclobutanos tampoco se han identificado nunca en las reacciones de metátesis, que es otra razón por la que se abandonó rápidamente.
Luego, en 1967, investigadores dirigidos por Nissim Calderón en Goodyear Tire and Rubber Company describieron un nuevo sistema catalizador para la metátesis de 2-penteno basado en hexacloruro de tungsteno, etanol y el compuesto de organoaluminio EtAlMe 2. Los investigadores propusieron un nombre para este tipo de reacción: metátesis de olefinas. Anteriormente, la reacción se llamaba "desproporción de olefinas".
En esta reacción, el 2-penteno forma un equilibrio químico rápido (cuestión de segundos) con el 2-buteno y el 3-hexeno. No se observan migraciones de dobles enlaces; la reacción se puede iniciar también con buteno y hexeno y la reacción se puede detener mediante la adición de metanol.
El grupo de Goodyear demostró que la reacción del 2-buteno regular con su isotopólogo completamente deuterado producía C 4 H 4 D 4 con deuterio distribuido uniformemente. De esta forma pudieron diferenciar entre un mecanismo de transalquilidenación y un mecanismo de transalquilación (descartado):
En 1971, Chauvin propuso un metalaciclo intermedio de cuatro miembros para explicar la distribución estadística de los productos encontrados en ciertas reacciones de metátesis. Este mecanismo se considera hoy en día el mecanismo real que tiene lugar en la metátesis de olefinas.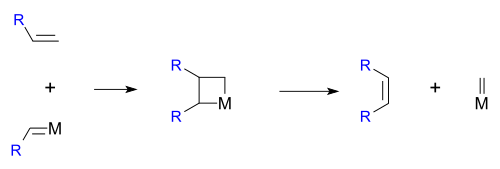
La evidencia experimental de Chauvin se basó en la reacción de ciclopenteno y 2-penteno con el catalizador homogéneo oxitetracloruro de tungsteno (VI) y tetrabutilestaño:
Los tres productos principales C9, C10 y C11 se encuentran en una relación 1:2:1 independientemente de la conversión. La misma relación se encuentra con los oligómeros superiores. Chauvin también explicó cómo se forma el carbeno en primer lugar: por eliminación de hidruro alfa de un enlace simple de metal de carbono. Por ejemplo, el propileno (C3) se forma en una reacción de 2-buteno (C4) con hexacloruro de tungsteno y tetrametilestaño (C1).
En el mismo año, Pettit, que sintetizó ciclobutadieno unos años antes, ideó de forma independiente un mecanismo competitivo. Consistía en un intermedio de tetrametileno con átomos de carbono hibridados sp unidos a un átomo de metal central con múltiples enlaces de dos electrones de tres centros.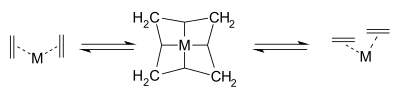
El apoyo experimental ofrecido por Pettit para este mecanismo se basó en una inhibición de la reacción observada por el monóxido de carbono en ciertas reacciones de metátesis del 4-noneno con un carbonilo metálico de tungsteno.
Robert H. Grubbs se involucró en la metátesis en 1972 y también propuso un metalaciclo intermedio pero con cuatro átomos de carbono en el anillo. El grupo en el que trabajaba hizo reaccionar 1,4-dilitiobutano con hexacloruro de tungsteno en un intento de producir directamente un ciclometilenometalaciclo produciendo un intermedio, que produjo productos idénticos a los producidos por el intermedio en la reacción de metátesis de olefina. Este mecanismo es por pares:
En 1973, Grubbs encontró más evidencia de este mecanismo al aislar uno de esos metalaciclos no con tungsteno sino con platino por reacción del dilitiobutano con cis-bis (trifenilfosfina) dicloroplatino (II).
En 1975, Katz también llegó a un metalaciclobutano intermedio consistente con el propuesto por Chauvin. Hizo reaccionar una mezcla de cicloocteno, 2-buteno y 4-octeno con un catalizador de molibdeno y observó que el producto de reacción de hidrocarburo C14 asimétrico está presente desde el principio en conversión baja.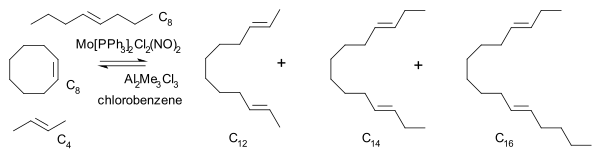
En cualquiera de los mecanismos por pares con emparejamiento de olefinas como paso determinante de la velocidad, este compuesto, un producto de reacción secundario de C12 con C6, se formaría mucho después de la formación de los dos productos de reacción primarios C12 y C16.
En 1974, Casey fue el primero en implementar carbenos en el mecanismo de reacción de metátesis:
Grubbs en 1976 proporcionó evidencia contra su propio mecanismo actualizado por pares: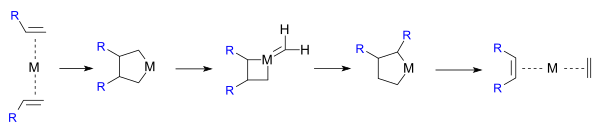
con un ciclo de 5 miembros en otra ronda de estudios de etiquetado de isótopos a favor del mecanismo de Chauvin del ciclo de 4 miembros:
En esta reacción 
El primer sistema práctico de metátesis fue introducido en 1978 por Tebbe basado en (lo que más tarde se conocería como) reactivo de Tebbe. En una reacción modelo, los átomos de carbono marcados isotópicamente en isobuteno y metilenociclohexano intercambiaron lugares:
Luego, el grupo de Grubbs aisló el intermedio de metalaciclobutano propuesto en 1980 también con este reactivo junto con 3-metil-1-buteno:
Aislaron un compuesto similar en la síntesis total de capnellene en 1986:
En ese mismo año, el grupo de Grubbs demostró que la polimerización por metátesis del norborneno mediante el reactivo de Tebbe es un sistema de polimerización vivo y un año después, Grubbs y Schrock publicaron conjuntamente un artículo que describe la polimerización viva con un complejo de carbeno de tungsteno. Mientras que Schrock centró su investigación en el tungsteno y el molibdeno. catalizadores para la metátesis de olefinas, Grubbs inició el desarrollo de catalizadores a base de rutenio, que demostraron ser menos sensibles al oxígeno y al agua y, por lo tanto, más tolerantes a los grupos funcionales.
Catalizadores de Grubbs
En las décadas de 1960 y 1970, varios grupos informaron sobre la polimerización por apertura de anillo de norborneno catalizada por tricloruros hidratados de rutenio y otros metales de transición tardía en solventes próticos polares. Esto llevó a Robert H. Grubbs y colaboradores a buscar catalizadores tolerantes a grupos funcionales bien definidos basados en rutenio. El grupo de Grubbs polimerizó con éxito el derivado de 7-oxo norborneno utilizando tricloruro de rutenio, tricloruro de osmio y alquilidenos de tungsteno. Identificaron un carbeno de Ru(II) como un centro de metal efectivo y en 1992 publicaron el primer catalizador de metátesis de olefina basado en rutenio bien definido, (PPh 3) 2 Cl 2 Ru=CHCH=CPh 2:
También se demostró que el correspondiente complejo de triciclohexilfosfina (PCy 3) 2 Cl 2 Ru=CHCH=CPh 2 es activo. Este trabajo culminó en el catalizador Grubbs de primera generación ahora disponible comercialmente.
Catalizadores Schrock
Schrock ingresó al campo de la metátesis de olefinas en 1979 como una extensión del trabajo sobre los alquilidenos de tantalio. El resultado inicial fue decepcionante ya que la reacción de CpTa(=CH−t−Bu)Cl 2 con etileno produjo solo un metalaciclopentano, no productos de metátesis:
Pero ajustando esta estructura a un PR 3 Ta(CHt−bu)(Ot−bu) 2 Cl (reemplazando el cloruro por t-butóxido y un ciclopentadienilo por una organofosfina, se estableció la metátesis con cis-2-penteno. En otro desarrollo, también se encontró que ciertos complejos oxo de tungsteno del tipo W(O)(CHt−Bu)(Cl) 2 (PEt) 3 son efectivos.
Los alquilidenos de Schrock para metátesis de olefinas del tipo Mo(NAr)(CHC(CH 3) 2 R){OC(CH 3)(CF 3) 2 } 2 se comercializaron a partir de 1990.
El primer catalizador asimétrico siguió en 1993.
Con un catalizador de Schrock modificado con un ligando BINOL en un ROMP de norbornadieno que conduce a un polímero isotáctico cis altamente estereorregular.
Contenido relacionado
Tetraetilo de plomo
Ceteno
Azida de plomo (II)