Metaloproteína
Metaloproteína es un término genérico para una proteína que contiene un cofactor de iones metálicos. Una gran proporción de todas las proteínas forman parte de esta categoría. Por ejemplo, al menos 1000 proteínas humanas (de ~20 000) contienen dominios de proteínas de unión a zinc, aunque puede haber hasta 3000 metaloproteínas de zinc humanas.
Abundancia
Se estima que aproximadamente la mitad de todas las proteínas contienen un metal. En otra estimación, se propone que entre un cuarto y un tercio de todas las proteínas requieren metales para llevar a cabo sus funciones. Así, las metaloproteínas tienen muchas funciones diferentes en las células, como el almacenamiento y transporte de proteínas, enzimas y proteínas de transducción de señales, o enfermedades infecciosas. La abundancia de proteínas de unión a metales puede ser inherente a los aminoácidos que utilizan las proteínas, ya que incluso las proteínas artificiales sin antecedentes evolutivos se unen fácilmente a los metales.
La mayoría de los metales del cuerpo humano están unidos a proteínas. Por ejemplo, la concentración relativamente alta de hierro en el cuerpo humano se debe principalmente al hierro en la hemoglobina.
| Liver | Kidney | Lung | Corazón | Cerebro | Musculo | |
|---|---|---|---|---|---|---|
| Mn (manganese) | 138 | 79 | 29 | 27 | 22 | c) 4-40 |
| Fe (iron) | 16.769 | 7,168 | 24.967 | 5.530 | 4,100 | 3.500 |
| Co (cobalto) | ▪2-13 | . | 2-8 | -... | . | 150 (?) |
| Ni (nickel) | c) | . | c) | c) | c) | . |
| Cu (cobre) | 882 | 379 | 220 | 350 | 401 | 85-305 |
| Zn (zinc) | 5,543 | 5.018 | 1.470 | 2.772 | 915 | 4.688 |
Principios de la química de coordinación
En las metaloproteínas, los iones metálicos suelen estar coordinados por centros de nitrógeno, oxígeno o azufre pertenecientes a residuos de aminoácidos de la proteína. Estos grupos donantes a menudo son proporcionados por cadenas laterales en los residuos de aminoácidos. Son especialmente importantes el sustituyente imidazol en los residuos de histidina, los sustituyentes de tiolato en los residuos de cisteína y los grupos carboxilato proporcionados por el aspartato. Dada la diversidad del metaloproteoma, se ha demostrado que prácticamente todos los residuos de aminoácidos se unen a centros metálicos. El esqueleto peptídico también proporciona grupos donantes; estos incluyen amidas desprotonadas y los centros de oxígeno de carbonilo de amida. Se ha revisado la unión de plomo (II) en proteínas naturales y artificiales.
Además de los grupos donantes que proporcionan los residuos de aminoácidos, muchos cofactores orgánicos funcionan como ligandos. Quizás los más famosos son los ligandos macrocíclicos tetradentados N4 incorporados en la proteína hemo. Los ligandos inorgánicos como el sulfuro y el óxido también son comunes.
Almacenamiento y transporte de metaloproteínas
Estos son el producto de la segunda etapa de la hidrólisis de proteínas obtenido por tratamiento con ácidos y álcalis ligeramente más fuertes.
Transportadores de oxígeno
La hemoglobina, que es el principal transportador de oxígeno en los seres humanos, tiene cuatro subunidades en las que el ion de hierro (II) está coordinado por el ligando macrocíclico planar protoporfirina IX (PIX) y el átomo de nitrógeno de imidazol de un residuo de histidina. El sexto sitio de coordinación contiene una molécula de agua o una molécula de dioxígeno. Por el contrario, la proteína mioglobina, que se encuentra en las células musculares, tiene solo una de esas unidades. El sitio activo se encuentra en un bolsillo hidrofóbico. Esto es importante ya que sin él, el hierro (II) se oxidaría irreversiblemente a hierro (III). La constante de equilibrio para la formación de HbO2 es tal que el oxígeno es absorbido o liberado dependiendo de la presión parcial de oxígeno en los pulmones o en el músculo. En la hemoglobina, las cuatro subunidades muestran un efecto cooperativo que permite una fácil transferencia de oxígeno de la hemoglobina a la mioglobina.
Tanto en la hemoglobina como en la mioglobina, a veces se afirma incorrectamente que las especies oxigenadas contienen hierro (III). Ahora se sabe que la naturaleza diamagnética de estas especies se debe a que el átomo de hierro (II) se encuentra en un estado de espín bajo. En la oxihemoglobina, el átomo de hierro se encuentra en el plano del anillo de porfirina, pero en la desoxihemoglobina paramagnética, el átomo de hierro se encuentra por encima del plano del anillo. Este cambio en el estado de espín es un efecto cooperativo debido a la mayor división del campo cristalino y al menor radio iónico de Fe2+ en el resto de oxihemoglobina.
La hemeritrina es otro transportador de oxígeno que contiene hierro. El sitio de unión de oxígeno es un centro de hierro binuclear. Los átomos de hierro se coordinan con la proteína a través de las cadenas laterales de carboxilato de glutamato y aspartato y cinco residuos de histidina. La absorción de O2 por la hemeritrina se acompaña de una oxidación de dos electrones del centro binuclear reducido para producir peróxido unido (OOH−). El mecanismo de captación y liberación de oxígeno se ha elaborado en detalle.
Las hemocianinas transportan oxígeno en la sangre de la mayoría de los moluscos y de algunos artrópodos, como el cangrejo herradura. Solo son superados por la hemoglobina en popularidad biológica de uso en el transporte de oxígeno. En la oxigenación, los dos átomos de cobre (I) en el sitio activo se oxidan a cobre (II) y las moléculas de dioxígeno se reducen a peróxido, O2−
2.
La clorocruorina (como el transportador más grande, la eritrocruorina) es una hemoproteína que se une al oxígeno presente en el plasma sanguíneo de muchos anélidos, particularmente en ciertos poliquetos marinos.
Citocromos
Las reacciones de oxidación y reducción no son comunes en la química orgánica ya que pocas moléculas orgánicas pueden actuar como agentes oxidantes o reductores. El hierro (II), por otro lado, puede oxidarse fácilmente a hierro (III). Esta funcionalidad se utiliza en los citocromos, que funcionan como vectores de transferencia de electrones. La presencia del ion metálico permite que las metaloenzimas realicen funciones tales como reacciones redox que no pueden ser realizadas fácilmente por el conjunto limitado de grupos funcionales que se encuentran en los aminoácidos. El átomo de hierro en la mayoría de los citocromos está contenido en un grupo hemo. Las diferencias entre esos citocromos radican en las diferentes cadenas laterales. Por ejemplo, el citocromo a tiene un grupo prostético hemo a y el citocromo b tiene un grupo prostético hemo b. Estas diferencias dan como resultado diferentes potenciales redox de Fe2+/Fe3+, de modo que varios citocromos están involucrados en la cadena de transporte de electrones mitocondrial.
Las enzimas del citocromo P450 realizan la función de insertar un átomo de oxígeno en un enlace C-H, una reacción de oxidación.
Rubredoxina
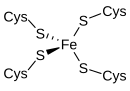
La rubredoxina es un transportador de electrones que se encuentra en bacterias y arqueas que metabolizan el azufre. El sitio activo contiene un ion de hierro coordinado por los átomos de azufre de cuatro residuos de cisteína que forman un tetraedro casi regular. Las rubredoxinas realizan procesos de transferencia de un electrón. El estado de oxidación del átomo de hierro cambia entre los estados +2 y +3. En ambos estados de oxidación, el metal tiene un espín alto, lo que ayuda a minimizar los cambios estructurales.
Plastocianina
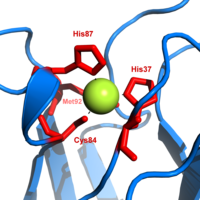
La plastocianina pertenece a la familia de proteínas de cobre azul que intervienen en las reacciones de transferencia de electrones. El sitio de unión al cobre se describe como una pirámide trigonal distorsionada. El plano trigonal de la base piramidal está compuesto por dos átomos de nitrógeno (N1 y N2) de histidinas separadas y un azufre (S1) de una cisteína. El azufre (S2) de una metionina axial forma el vértice. La distorsión ocurre en las longitudes de enlace entre los ligandos de cobre y azufre. El contacto Cu−S1 es más corto (207 pm) que Cu−S2 (282 pm). El enlace Cu−S2 alargado desestabiliza la forma Cu(II) y aumenta el potencial redox de la proteína. El color azul (absorción máxima de 597 nm) se debe al enlace Cu−S1 donde S(pπ) a Cu(dx2−y2) se produce la transferencia de carga.
En la forma reducida de plastocianina, His-87 se protonará con un pKa de 4,4. La protonación evita que actúe como ligando y la geometría del sitio de cobre se vuelve plana trigonal.
Almacenamiento y transferencia de iones metálicos
Hierro
El hierro se almacena como hierro (III) en la ferritina. Aún no se ha determinado la naturaleza exacta del sitio de unión. El hierro parece estar presente como un producto de hidrólisis como el FeO(OH). El hierro es transportado por la transferrina cuyo sitio de unión consta de dos tirosinas, una de ácido aspártico y una de histidina. El cuerpo humano no tiene ningún mecanismo para la excreción de hierro. Esto puede conducir a problemas de sobrecarga de hierro en pacientes tratados con transfusiones de sangre, como, por ejemplo, con β-talasemia. El hierro en realidad se excreta en la orina y también se concentra en la bilis que se excreta en las heces.
Cobre
La ceruloplasmina es la principal proteína transportadora de cobre en la sangre. La ceruloplasmina exhibe actividad oxidasa, que está asociada con la posible oxidación de Fe(II) en Fe(III), por lo tanto, ayuda en su transporte en el plasma sanguíneo en asociación con la transferrina, que puede transportar hierro solo en el estado de Fe(III).
Calcio
La osteopontina participa en la mineralización de las matrices extracelulares de huesos y dientes.
Metaloenzimas
Todas las metaloenzimas tienen una característica en común, a saber, que el ion metálico se une a la proteína con un sitio de coordinación lábil. Como con todas las enzimas, la forma del sitio activo es crucial. El ion metálico generalmente se encuentra en un bolsillo cuya forma se adapta al sustrato. El ion metálico cataliza reacciones que son difíciles de lograr en química orgánica.
Anhidrasa carbónica
En solución acuosa, el dióxido de carbono forma ácido carbónico
- CO2 + H2O ⇌ H2CO3
Esta reacción es muy lenta en ausencia de un catalizador, pero bastante rápida en presencia del ion hidróxido
- CO2 + OH− ⇌ HCO−3
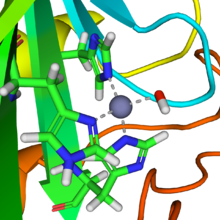
Una reacción similar a esta es casi instantánea con la anhidrasa carbónica. La estructura del sitio activo en las anhidrasas carbónicas es bien conocida a partir de varias estructuras cristalinas. Consiste en un ion de zinc coordinado por tres átomos de nitrógeno de imidazol de tres unidades de histidina. El cuarto sitio de coordinación está ocupado por una molécula de agua. La esfera de coordinación del ion zinc es aproximadamente tetraédrica. El ion de zinc cargado positivamente polariza la molécula de agua coordinada, y el ataque nucleofílico de la porción de hidróxido cargada negativamente sobre el dióxido de carbono avanza rápidamente. El ciclo catalítico produce el ion bicarbonato y el ion hidrógeno como el equilibrio
- H2CO3 ⇌ HCO−
3 + H+
favorece la disociación del ácido carbónico a valores de pH biológicos.
Enzimas dependientes de la vitamina B12
La vitamina B12 que contiene cobalto (también conocida como cobalamina) cataliza la transferencia de grupos metilo (−CH3) entre dos moléculas, lo que implica la ruptura de los enlaces C−C, un proceso que es energéticamente caro en reacciones orgánicas. El ion metálico reduce la energía de activación del proceso al formar un enlace Co−CH3 transitorio. La estructura de la coenzima fue determinada por Dorothy Hodgkin y sus colaboradores, por lo que recibió el Premio Nobel de Química. Consiste en un ion de cobalto (II) coordinado con cuatro átomos de nitrógeno de un anillo de corrina y un quinto átomo de nitrógeno de un grupo imidazol. En estado de reposo existe un enlace sigma Co−C con el átomo de carbono 5′ de la adenosina. Se trata de un compuesto organometálico de origen natural, lo que explica su función en las reacciones de trans-metilación, como la reacción llevada a cabo por la metionina sintasa.
Nitrogenasa (fijación de nitrógeno)
La fijación del nitrógeno atmosférico es un proceso que consume mucha energía, ya que implica romper el enlace triple muy estable entre los átomos de nitrógeno. La enzima nitrogenasa es una de las pocas enzimas que pueden catalizar el proceso. La enzima se produce en la bacteria Rhizobium. Hay tres componentes en su acción: un átomo de molibdeno en el sitio activo, grupos de hierro y azufre que están involucrados en el transporte de los electrones necesarios para reducir el nitrógeno y una fuente de energía abundante en forma de ATP de magnesio. Este último lo proporciona una simbiosis mutualista entre la bacteria y una planta huésped, a menudo una leguminosa. La reacción puede escribirse simbólicamente como
- N2 + 16 MgATP + 8 e− → 2 NH3 + 16 MgADP +16 Pi + H2
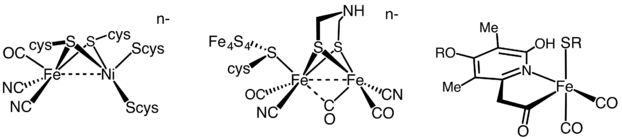
donde Pi representa fosfato inorgánico. La estructura precisa del sitio activo ha sido difícil de determinar. Parece contener un grupo de MoFe7S8 que puede unirse a la molécula de dinitrógeno y, presumiblemente, permitir que comience el proceso de reducción. Los electrones son transportados por el "P" clúster, que contiene dos clústeres cúbicos de Fe4S4 unidos por puentes de azufre.
Superóxido dismutasa
El ion superóxido, O−
2 se genera en sistemas biológicos mediante la reducción del oxígeno molecular. Tiene un electrón desapareado, por lo que se comporta como un radical libre. Es un poderoso agente oxidante. Estas propiedades hacen que el ion superóxido sea muy tóxico y los fagocitos los aprovechan para matar los microorganismos invasores. De lo contrario, el ion superóxido debe destruirse antes de que cause daños no deseados en una célula. Las enzimas superóxido dismutasa realizan esta función de manera muy eficiente.
El estado de oxidación formal de los átomos de oxígeno es −1⁄2. En soluciones a pH neutro, el ion superóxido se desproporciona al oxígeno molecular y al peróxido de hidrógeno.
- 2O−
2 + 2 H+ → O2 + H2O2
En biología, este tipo de reacción se denomina reacción de dismutación. Implica tanto la oxidación como la reducción de iones superóxido. El grupo de enzimas superóxido dismutasa (SOD) aumenta la velocidad de reacción hasta casi la velocidad limitada por difusión. La clave de la acción de estas enzimas es un ion metálico con estado de oxidación variable que puede actuar como agente oxidante o como agente reductor.
- Oxidación: M()n+1)+ + O−
2 → Mn+ + O2 - Reducción: Mn+ + O−
2 + 2 H+ → M()n+1)+ + H2O2.
En la SOD humana, el metal activo es el cobre, como Cu(II) o Cu(I), coordinado tetraédricamente por cuatro residuos de histidina. Esta enzima también contiene iones de zinc para la estabilización y es activada por la chaperona de cobre para la superóxido dismutasa (CCS). Otras isoenzimas pueden contener hierro, manganeso o níquel. Ni-SOD es particularmente interesante ya que involucra níquel (III), un estado de oxidación inusual para este elemento. Los ciclos de geometría de níquel del sitio activo de Ni(II) plano cuadrado, con tiolato (Cys2 y Cys6) y nitrógeno de la columna vertebral (His1 y Cys2), a Ni(III) piramidal cuadrado con un ligando de cadena lateral His1 axial añadido.
Proteínas que contienen clorofila

La clorofila juega un papel crucial en la fotosíntesis. Contiene un magnesio encerrado en un anillo de clorina. Sin embargo, el ion magnesio no está directamente involucrado en la función fotosintética y puede ser reemplazado por otros iones divalentes con poca pérdida de actividad. Más bien, el fotón es absorbido por el anillo de cloro, cuya estructura electrónica está bien adaptada para este propósito.
Inicialmente, la absorción de un fotón hace que un electrón se excite en un estado singulete de la banda Q. El estado excitado sufre un cruce entre sistemas desde el estado singlete a un estado triplete en el que hay dos electrones con espín paralelo. Esta especie es, en efecto, un radical libre, y es muy reactiva y permite que un electrón se transfiera a los aceptores que están adyacentes a la clorofila en el cloroplasto. En el proceso se oxida la clorofila. Más adelante en el ciclo fotosintético, la clorofila se reduce nuevamente. Esta reducción finalmente extrae electrones del agua, produciendo oxígeno molecular como producto de oxidación final.
Hidrogenasa
Las hidrogenasas se subclasifican en tres tipos diferentes según el contenido de metal del sitio activo: hidrogenasa de hierro-hierro, hidrogenasa de hierro-níquel e hidrogenasa de hierro. Todas las hidrogenasas catalizan la captación reversible de H2, pero mientras que las hidrogenasas [FeFe] y [NiFe] son verdaderos catalizadores redox, impulsan la oxidación de H2 y la reducción de H+
- H2 ⇌ 2 H+ + 2 e−
Las [Fe] hidrogenasas catalizan la escisión heterolítica reversible de H2.
- H2 ⇌ H+ + H−
Ribozima y desoxirribozima
Desde que Thomas Cech y Sidney Altman descubrieron las ribozimas a principios de la década de 1980, se ha demostrado que las ribozimas son una clase distinta de metaloenzimas. Muchas ribozimas requieren iones metálicos en sus sitios activos para la catálisis química; de ahí que se llamen metaloenzimas. Además, los iones metálicos son esenciales para la estabilización estructural de las ribozimas. El intrón del grupo I es la ribozima más estudiada que tiene tres metales que participan en la catálisis. Otras ribozimas conocidas incluyen el intrón del grupo II, la RNasa P y varias ribozimas virales pequeñas (como cabeza de martillo, horquilla, HDV y VS) y la subunidad grande de ribosomas. Recientemente, se han descubierto cuatro nuevas clases de ribozimas (denominadas twister, twister sister, pistol y hacha) que son todas ribozimas autoescindibles.
Las desoxirribozimas, también llamadas ADNzimas o ADN catalítico, son moléculas de ADN catalítico artificial que se produjeron por primera vez en 1994 y desde entonces ganaron un rápido aumento de interés. Casi todas las ADNzimas requieren iones metálicos para funcionar; por lo que se clasifican como metaloenzimas. Aunque las ribozimas catalizan principalmente la escisión de sustratos de ARN, las ADNzimas pueden catalizar una variedad de reacciones, incluida la escisión de ARN/ADN, la ligadura de ARN/ADN, la fosforilación y desfosforilación de aminoácidos y la formación de enlaces carbono-carbono. Sin embargo, las ADNzimas que catalizan la reacción de escisión del ARN son las más exploradas. La ADNzima 10-23, descubierta en 1997, es uno de los ADN catalíticos más estudiados con aplicaciones clínicas como agente terapéutico. Se han informado varias ADNzimas específicas de metales, incluida la ADNzima GR-5 (específica del plomo), las ADNzimas CA1-3 (específicas del cobre), la ADNzima 39E (específica del uranilo) y la ADNzima NaA43 (específica del sodio).
Metaloproteínas de transducción de señales
Calmodulina
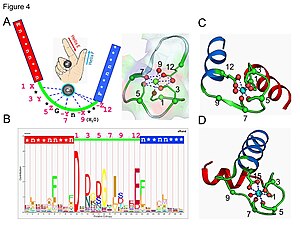
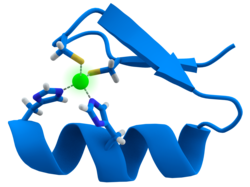
La calmodulina es un ejemplo de una proteína de transducción de señales. Es una pequeña proteína que contiene cuatro motivos EF-hand, cada uno de los cuales puede unirse a un ion Ca2+.
En un dominio de proteína de bucle de mano EF, el ion de calcio está coordinado en una configuración bipiramidal pentagonal. Seis residuos de ácido glutámico y ácido aspártico implicados en la unión están en las posiciones 1, 3, 5, 7 y 9 de la cadena polipeptídica. En la posición 12, hay un ligando glutamato o aspartato que se comporta como un (ligando bidentado), proporcionando dos átomos de oxígeno. El noveno residuo en el bucle es necesariamente glicina debido a los requisitos de conformación de la columna vertebral. La esfera de coordinación del ion calcio contiene solo átomos de oxígeno de carboxilato y ningún átomo de nitrógeno. Esto es consistente con la naturaleza dura del ion de calcio.
La proteína tiene dos dominios aproximadamente simétricos, separados por una "bisagra" flexible. región. La unión del calcio provoca un cambio conformacional en la proteína. La calmodulina participa en un sistema de señalización intracelular al actuar como segundo mensajero difusible de los estímulos iniciales.
Troponina
Tanto en los músculos cardíacos como en los esqueléticos, la producción de fuerza muscular está controlada principalmente por cambios en la concentración de calcio intracelular. En general, cuando el calcio sube, los músculos se contraen y, cuando el calcio baja, los músculos se relajan. La troponina, junto con la actina y la tropomiosina, es el complejo proteico al que se une el calcio para desencadenar la producción de fuerza muscular.
Factores de transcripción
Muchos factores de transcripción contienen una estructura conocida como dedo de zinc, este es un módulo estructural donde una región de proteína se pliega alrededor de un ion de zinc. El zinc no entra en contacto directo con el ADN al que se unen estas proteínas. En cambio, el cofactor es esencial para la estabilidad de la cadena proteica estrechamente plegada. En estas proteínas, el ion zinc suele estar coordinado por pares de cadenas laterales de cisteína e histidina.
Otras metaloenzimas
Hay dos tipos de monóxido de carbono deshidrogenasa: una contiene hierro y molibdeno, la otra contiene hierro y níquel. Se han revisado los paralelos y las diferencias en las estrategias catalíticas.
ElPb2+ (plomo) puede sustituir al Ca2+ (calcio) como, por ejemplo, con calmodulina o Zn2+ (zinc) como con metalocarboxipeptidasas
Algunas otras metaloenzimas se dan en la siguiente tabla, según el metal involucrado.
| Ion | Ejemplos de enzimas que contienen este ión |
|---|---|
| Magnesio | Glucose 6-phosphatase Hexokinasa polimerasa de ADN Poly(A) polymerase |
| Vanadium | vanabins |
| Manganese | Arginase Complejo giratorio de oxígeno |
| Iron | Catalase Hidrogenasa IRE-BP Aconitase |
| Cobalto | Nitrile hidrataatase Methionyl aminopeptidase Metilmalonil-CoA mutase Isobutyryl-CoA mutase |
| Nickel | Urease Hidrogenasa Metil-coenzyme M reductase (MCR) |
| Copper | Citocromo oxidasa Laccase Nitrous-oxide reductase Nitrite reductase |
| Zinc | Alcohol deshidrogenasa Carboxypeptidase Aminopeptidase Beta amiloide |
| Cadmio | Metallothionein Proteínas tioladas |
| Molybdenum | Nitrato reductasa Sulfito oxidase Xanthine oxidase DMSO reductase |
| Tungsten | Acetylene hidrataatase |
| diversos | Metallothionein Fosfatasa |
Contenido relacionado
James dewar
Carbono-14
Fusión nuclear