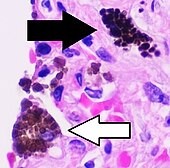
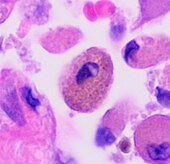
Macrófago alveolar

Un macrófago alveolar, macrófago pulmonar, (o célula de polvo) es un tipo de macrófago, un fagocito profesional, que se encuentra en las vías respiratorias y a nivel de los alvéolos de los pulmones, pero separado de sus paredes.
La actividad de los macrófagos alveolares es relativamente alta, ya que se encuentran en uno de los principales límites entre el cuerpo y el mundo exterior. Son los encargados de eliminar partículas como polvo o microorganismos de las superficies respiratorias.
Con frecuencia se observa que los macrófagos alveolares contienen gránulos de material exógeno, como partículas de carbono, que han recogido de las superficies respiratorias. Estos gránulos negros pueden ser especialmente comunes en los pulmones de los fumadores o de los habitantes de ciudades que viven mucho tiempo en la ciudad.
El macrófago alveolar es el tercer tipo de célula del alvéolo; los otros son los neumocitos tipo I y tipo II.
Comparación de macrófagos pulmonares pigmentados

Función


- señalización de RRR que activa mecanismos de transcripción genética que conducen a la activación celular,
- endocytic PRR que funcionan en la unión patógeno y la fagocitosis, y
- PRR secretas que normalmente funcionan como opsoninas o activadores de complemento.
El reconocimiento y la eliminación de microorganismos invasores se produce a través de vías dependientes e independientes de la opsonina. Los mecanismos moleculares que facilitan la fagocitosis dependiente de la opsonina son diferentes para pares específicos de opsonina/receptor. Por ejemplo, la fagocitosis de patógenos opsonizados por IgG se produce a través de los receptores Fcγ (FcγR) e implica extensiones de fagocitos alrededor del microbio, lo que da lugar a la producción de mediadores proinflamatorios. Por el contrario, la ingestión de patógenos mediada por el receptor del complemento se produce sin extensiones de membrana observables (las partículas simplemente se hunden en la célula) y, por lo general, no da lugar a una respuesta mediadora inflamatoria.
Tras la internalización, el microbio queda encerrado en un fagosoma vesicular que luego se fusiona con lisosomas primarios o secundarios, formando un fagolisosoma. Existen varios mecanismos que conducen a la muerte intracelular; hay procesos oxidativos y otros independientes del metabolismo oxidativo. El primero implica la activación de sistemas enzimáticos de membrana que conducen a una estimulación de la captación de oxígeno (conocido como estallido respiratorio) y su reducción a intermediarios reactivos de oxígeno (ROI), especies moleculares que son altamente tóxicas para los microorganismos. La enzima responsable de la provocación del estallido respiratorio se conoce como nicotinamida adenina dinucleótido fosfato (NADPH) oxidasa, que está compuesta por cinco subunidades. Un componente es un citocromo de membrana formado por dos subunidades proteicas, gp91phox y p22phox; los tres componentes restantes son proteínas derivadas del citosol: p40phox, p47phox y p67phox. La NADPH oxidasa existe en el citosol de la membrana ampollosa cuando está en estado de reposo; pero al activarse, dos de sus componentes citosólicos, p47phox y p67phox, tienen sus residuos de tirosina y serina fosforilados, que luego pueden mediar la translocación de la NADPHox al componente del citocromo, gp91phox/p22phox, en la membrana plasmática a través de elementos del citoesqueleto.
En comparación con otros fagocitos, el estallido respiratorio en los macrófagos AM es de mayor magnitud. Los mecanismos microbicidas independientes del oxígeno se basan en la producción de ácido, en la secreción de lisozimas, en proteínas que se unen al hierro y en la síntesis de polipéptidos catiónicos tóxicos. Los macrófagos poseen un repertorio de moléculas antimicrobianas empaquetadas dentro de sus gránulos y lisosomas. Estos orgánulos contienen una gran cantidad de enzimas degradativas y péptidos antimicrobianos que se liberan en el fagolisosoma, como proteasas, nucleasas, fosfatasas, esterasas, lipasas y péptidos altamente básicos. Además, los macrófagos poseen una serie de mecanismos de privación de nutrientes que se utilizan para privar a los patógenos fagocitados de micronutrientes esenciales. Ciertos microorganismos han desarrollado contramedidas que les permiten evadir su destrucción por los fagocitos. Aunque la degradación mediada por lisosomas es un medio eficiente para neutralizar una infección y prevenir la colonización, varios patógenos parasitan a los macrófagos, explotándolos como una célula huésped para el crecimiento, el mantenimiento y la replicación. Los parásitos como Toxoplasma gondii y las micobacterias son capaces de evitar la fusión de los fagosomas con los lisosomas, escapando así a la acción dañina de las hidrolasas lisosomales. Otros evitan los lisosomas abandonando la vacuola fagocítica para llegar a la matriz citosólica donde su desarrollo no se ve obstaculizado. En estos casos, los macrófagos pueden verse inducidos a destruir activamente los microorganismos fagocitados produciendo una serie de moléculas altamente tóxicas e induciendo un mecanismo de privación para matarlos de hambre. Por último, algunos microbios tienen enzimas para desintoxicar los metabolitos de oxígeno formados durante el estallido respiratorio.
Cuando no son suficientes para protegerse de la amenaza, los macrófagos alveolares pueden liberar citocinas proinflamatorias y quimiocinas para activar una red altamente desarrollada de células fagocíticas defensivas responsables de la respuesta inmunitaria adaptativa. Durante la infección por COVID-19, los macrófagos alveolares desempeñan un papel doble: actúan como primera línea de defensa contra el SARS-CoV-2 en el espacio alveolar y, al mismo tiempo, contribuyen a la respuesta hiperinflamatoria a través de la producción excesiva de citocinas, que puede exacerbar el daño pulmonar y el síndrome de dificultad respiratoria aguda (SDRA).
Los pulmones son especialmente sensibles y propensos a sufrir daños, por lo que para evitar daños colaterales a los neumocitos tipo I y tipo II, los macrófagos alveolares se mantienen en un estado de reposo, produciendo pocas citocinas inflamatorias y mostrando poca actividad fagocítica, como lo demuestra la expresión regulada a la baja del antígeno del receptor fagocítico Macrófago 1 (Mac-1). Los macrófagos alveolares suprimen activamente la inducción de dos de los sistemas de inmunidad del cuerpo: la inmunidad adaptativa y la inmunidad humoral. La inmunidad adaptativa se suprime a través de los efectos de los macrófagos alveolares sobre las células dendríticas intersticiales, las células B y las células T, ya que estas células son menos selectivas de lo que destruyen y a menudo causan daños innecesarios a las células normales. Para prevenir la inflamación descontrolada en el tracto respiratorio inferior, los macrófagos alveolares secretan óxido nítrico, prostaglandinas, interleucina-4 y -10 (IL-4, IL-10) y factor de crecimiento transformante-β (TGF-β).
Papel de las moléculas de señalización
Óxido métrico
El óxido nítrico (NO) es una fuente importante de inmunomodulación en roedores y es producido por la enzima óxido nítrico sintetasa tipo 2 (NOS2) en el macrófago alveolar. El NO inhibe la fosforilación de tirosina de las quinasas involucradas en la producción del receptor de interleucina-2 (IL-2), cuya expresión es fundamental para la proliferación de células T. En humanos, sin embargo, la actividad de NOS2 ha sido difícil de verificar.
Existen dos explicaciones para la falta de respuesta del promotor de la óxido nítrico sintetasa inducible humana (iNOS) a la activación del NO por lipopolisacáridos (LPS) + interferón gamma (IFNγ). La primera es que existen diversas variaciones de nucleótidos inactivadores en la contraparte humana del elemento potenciador que regula la expresión inducida por LPS/IFNγ del gen NOS2 de ratón. La segunda se debe a la ausencia de un factor nuclear en los macrófagos humanos que se requiere para la expresión óptima del gen NOS2 (complejo factor nuclear inducible por LPS-kappa B/Rel). Se supone que la dificultad para verificar NOS2 se debe a una expresión mucho más controlada en los macrófagos amónicos humanos en comparación con la de los macrófagos amónicos de roedores. NOS2 es parte de un ciclo de retroalimentación autorregulador, en el que un alérgeno o provocador estimula la producción de citocinas inflamatorias, que a su vez estimula la producción de NO, y el NO regula a la baja la producción de citocinas. En ratas, el NO inhibe la maduración de las células dendríticas mediada por el factor estimulante de colonias de granulocitos y macrófagos (GM-CSF), y en humanos inhibe la maduración de las células dendríticas humanas mediada por el TNF-alfa, a través de mecanismos dependientes del GMP cíclico. El NO prolonga la capacidad de las células dendríticas humanas de internalizar antígenos en sitios de inflamación, modulando así los pasos iniciales que conducen a respuestas inmunitarias específicas de antígeno.
Se ha implicado a la producción de NO como un factor relevante en la patología del asma. Las personas con asma muestran una mayor expresión de iNOS en las células epiteliales de las vías respiratorias y un mayor nivel de óxido nítrico en el aire exhalado.
Prostaglandin endoperoxide 2 (PGE2)
Se han aislado muchos otros factores inmunomoduladores, de los cuales los más importantes son las prostaglandinas y las citocinas. La PGE2 fue el primer inmunomodulador derivado de los macrófagos y descrito. La PGE2 actúa amplificando la transcripción de IL-10 y la producción de proteínas de los linfocitos de sangre periférica, así como desactivando los macrófagos y las células T. La PGE2 es un eicosanoide inmunomodulador derivado del componente de la membrana celular, el ácido araquidónico, y se procesa en la cascada del ácido araquidónico: la oxigenación e isomerización sucesivas del ácido araquidónico por las enzimas ciclooxigenasa y PGE2 sintasa. La regulación de las células diana por la PGE2 se produce mediante la señalización a través de cuatro receptores E-prostanoides (EP) acoplados a la proteína G asociados a la membrana celular, denominados EP1, EP2, EP3 y EP4. La PGE2 inhibe la muerte bacteriana y la producción de ROI por AM al alterar la fagocitosis mediada por Fcγ a través de su capacidad para estimular la producción de efectores intracelulares de monofosfato de adenosina cíclico (cAMP) a través de la señalización de los receptores EP2 y EP4. Los receptores EP2 y EP4 señalan principalmente a través de la proteína G estimuladora (Gs), aumentando la actividad de la adenilil ciclasa (AC) y la posterior formación de cAMP. El cAMP es un segundo mensajero que influye en múltiples funciones celulares a través de la activación de dos moléculas efectoras posteriores, la proteína quinasa A (PKA) y las proteínas de intercambio activadas directamente por cAMP (Epac-1 y -2). Epac-1 y PKA son ambos factores importantes involucrados en la inhibición de la muerte bacteriana de AM. Los efectos de PKA resultan de su capacidad para fosforilar residuos de serina y treonina en muchas proteínas celulares, especialmente la proteína de unión al elemento de respuesta al cAMP (CREB), un factor de transcripción. El eje cAMP/PKA/CREB media la inhibición de la liberación de TNF-alfa. La eliminación de las bacterias fagocitadas por los AM depende de varios mecanismos microbicidas distintos, como la liberación reducida de ROI mediada por la NADPH oxidasa. La generación de ROI por la NADPH oxidasa es un mecanismo bactericida importante después de la fagocitosis mediada por FcR. La PGE2 activa los receptores EP2 y EP4 acoplados a Gs mediante ligadura, estimulando la producción de AMPc y la posterior activación de los efectores de AMPc descendentes, PKA y Epac-1; ambos a su vez alteran la fosforilación y la translocación de la membrana fagosómica del componente de la NADPH oxidasa, p47phox, inhibiendo así el estallido respiratorio.
Interleukin-4 y -10
La IL-4 es una citocina pleiotrópica que desempeña un papel fundamental en el desarrollo de las células T auxiliares de tipo 2 (Th2). La IL-4 es importante para la diferenciación de las células T CD4-naïve en células maduras de tipo Th2, así como para el cambio de la clase de inmunoglobulina (Ig) a IgE e IgG4 durante el desarrollo de las respuestas inmunitarias. La Ig es una clase de anticuerpo que se encuentra únicamente en los mamíferos y que desempeña un papel importante en la respuesta alérgica y la defensa contra muchos tipos de patógenos, protegiendo al organismo contra ellos mediante la activación del complemento, la opsonización para la fagocitosis y la neutralización de sus toxinas.
Se ha demostrado que tanto la IL-4 como la IL-10 reducen la producción de metaloproteinasas (endopeptidasas que degradan el colágeno y otras proteínas extracelulares) por parte de los macrófagos humanos. La IL-4 tiene efectos duales sobre la función biológica de los macrófagos, que pueden ser estimulantes o inhibidores. Mejora la expresión del antígeno MHC de clase II (complejo proteico extracelular que interactúa exclusivamente con las células CD4-T como parte de la vía exógena) y Mac-1 (receptor de superficie como parte del sistema innato del complemento), promoviendo así la fagocitosis. También se ha demostrado que la IL-4 inhibe la producción de PGE2 al reducir la expresión de la enzima prostaglandina H sintasa -2 (PGHS-2), que es fundamental en la producción de PGE2. Sin embargo, la IL-4 inhibe la producción de TNF-alfa, IL-1 y -6, que son todas citocinas importantes en la respuesta proinflamatoria).
La IL-10 inhibe la secreción de las citocinas proinflamatorias TNF-alfa e INF-gamma, suprimiendo así la proliferación de células T, células NK y AM. La IL-10 comparte mecanismos inmunomoduladores similares a los del TGF-β. Se cree que ambas citocinas reducen la tasa de apoptosis en los macrófagos alveolares humanos, mejorando así indirectamente la inhibición de la proliferación de células T mediada por los macrófagos alveolares. Hay un aumento significativo en la tasa basal de apoptosis tras la activación por productos bacterianos. La apoptosis está particularmente regulada por la presencia de citocinas: el IFNγ aumenta la tasa de apoptosis, mientras que la IL-10 y el TGF-β la disminuyen. Sin embargo, la IL-10 tiene efectos contraproducentes en el sistema inmunológico y se ha demostrado que en realidad promueve la infección por patógenos extraños. Se ha descubierto el papel de la IL-10 en la infección bacteriana y parasitaria como una estrategia para evadir los sistemas inmunológicos del huésped. Existen bacterias que parasitan a los macrófagos alveolares invadiendo sus membranas y prosperan creciendo y replicándose dentro de ellos, explotando a los macrófagos alveolares como células hospedadoras. Normalmente, esta infección puede ser eliminada por las células T, que activan enzimas en los macrófagos alveolares que destruyen las bacterias; pero se ha demostrado que estas bacterias alteran la red de señalización de citocinas en su beneficio. Como citocina inhibidora, la IL-10 facilita la infección de los macrófagos alveolares y monocitos humanos al revertir completamente el efecto protector del IFNγ contra la replicación intracelular de Legionella pneumophila. También se ha demostrado que Yersinia enterocolitica libera el antígeno de virulencia LcrV, que induce IL-10 a través del receptor tipo Toll-2 y CD14 (una proteína de superficie accesoria de la señalización de LPS mediada por TLR4), lo que da como resultado la supresión del IFNγ y la supresión del TNF-alfa.
Factor de crecimiento transformador β (TGF-β)
En condiciones normales, los macrófagos alveolares se adhieren estrechamente a las células epiteliales alveolares, induciendo así la expresión de la integrina αvβ6. Las integrinas son receptores diméricos de la superficie celular compuestos por subunidades alfa y beta, que activan el TGF-β. El TGF-β es una citocina multifuncional que modula una variedad de procesos biológicos como el crecimiento celular, la apoptosis, la síntesis de la matriz extracelular, la inflamación y las respuestas inmunitarias. El TGF-β regula estrechamente la actividad antiinflamatoria al suprimir la producción de citocinas proinflamatorias, inhibiendo así la función de los linfocitos T. Las integrinas avβ6 y avβ8 secuestran el TGF-β latente en la superficie celular, donde la activación puede acoplarse estrechamente a las respuestas celulares al estrés ambiental en el mantenimiento de la homeostasis; las integrinas también localizan el TGFβ activado en la proximidad de los macrófagos. Normalmente, el TGFβ maduro se secreta como un complejo latente con su fragmento N-terminal, el péptido asociado a la latencia (LAP), que inhibe su actividad. El complejo latente está unido covalentemente a la matriz extracelular mediante la unión a las proteínas de unión a TGF-β latentes. El TGF-β se activa por diversos mecanismos en el pulmón, que en última instancia implican la proteólisis o la alteración conformacional del LAP. La integrina αvβ6 es capaz de mediar la activación de TGF-β mediante la unión al LAP de TGF-β1, que sirve como sitio de unión del ligando para la integrina y es un componente esencial del aparato de activación de TGF-β. Una vez activado, el TGFβ conduce a la supresión de la funcionalidad de los macrófagos (producción de citocinas y fagocitosis). La unión del TGF-β activado a sus receptores expresados en los macrófagos alveolares induce una cascada de señalización descendente, que incluye la fosforilación de los homólogos 2 y 3 de Small Mothers Against Decapentaplegic (R-SMAD) regulados por el receptor. Los SMAD-2 y -3 fosforilados forman entonces complejos heteroméricos con el mediador común SMAD 4 (co-SMAD-4). Una vez ensamblados, los complejos se translocan al núcleo a través del poro nuclear con la ayuda de las importinas alfa/beta. Una vez en el núcleo, estos complejos se acumulan y finalmente actúan como factores de transcripción, regulando la expresión de los genes diana del TGF-β. Por lo tanto, la señalización del TGF-β implica una vía directa desde los receptores en la superficie de una célula hasta el núcleo.
Activación
Los receptores tipo Toll (TLR) son receptores de señalización PRR capaces de reconocer diversas proteínas bacterianas. Aunque las bacterias han desarrollado medios para evadir los mecanismos de defensa del huésped, expresan PAMP, como lipoglucanos y lipoproteínas que son reconocidos por las células del sistema inmunitario innato a través de los TLR. Tras la unión de los PAMP a los TLR, estos desencadenan respuestas inflamatorias y defensivas en la célula huésped, induciendo la polimerización de actina en los macrófagos alveolares (un componente crucial en la endocitosis y la motilidad). La polimerización de actina en los macrófagos alveolares provoca la supresión de la expresión de integrinas, lo que a su vez provoca la desactivación de TGF-β y la regulación negativa del nivel de fosforilación basal de SMAD 2/3; lo que posteriormente conduce a la activación y el desprendimiento de los macrófagos alveolares de las células epiteliales alveolares [15]. Tras la activación, los macrófagos se preparan para la fagocitosis y comienzan a secretar citocinas proinflamatorias (TNF-α e IL-6).
La preparación de los macrófagos implica la mejora de la actividad respiratoria por parte del IFN-γ y el TNF-α. El IFN-γ induce tanto una mayor afinidad de la NADPH oxidasa por el NADPH en los macrófagos, como una mayor tasa de transcripción génica y expresión de mensajes para la proteína gp91phox. El TNF-α actúa como un estímulo autocrino al aumentar la expresión de las transcripciones de p47phox y p67phox. Las regiones de interés producidas durante la respuesta respiratoria, a su vez, mejoran la producción de TNF-α por los macrófagos.
Desactivación
El intercambio de gases debe restablecerse lo más rápidamente posible para evitar daños colaterales, por lo que los linfocitos activados secretan IFNγ para estimular la producción de metaloproteinasa de matriz MMP-9 por los macrófagos. Se ha informado que los macrófagos de matriz producen MMP-9 en parte a través de las vías de señalización de PKA dependientes de PGE2, que son las vías involucradas en la inhibición de la fagocitosis. La MMP-9 activa el TGF-β latente, reinduciendo la expresión de las integrinas αvβ6 en las células epiteliales alveolares, devolviendo así el macrófago alveolar a un estado de reposo. La activación del TGF-β también es ventajosa porque su producción estimula la síntesis de colágeno en los fibroblastos intersticiales, que es necesaria para restaurar la arquitectura de la pared alveolar.
Véase también
- Lista de tipos de células humanas derivados de las capas germinales
Referencias
- ^ Weinberger SE, Cockrill BA, Mandel J (2019). Principios de la medicina pulmonar (Seventh ed.). Philadelphia, PA. pp. 288–289. ISBN 978-0-323-52373-8. OCLC 1020498796.
{{cite book}}: CS1 maint: localización desaparecido editor (link) - ^ Cotran RS, Kumar V, Collins T, Robbins SL (1999). Robbins Base patológica de la enfermedad. Filadelfia: W.B Saunders Company. ISBN 978-0-7216-7335-6.
- ^ Morgan WK (noviembre de 1978). "Bronquitis industrial". Br J Ind Med. 35 (4): 285–91. doi:10.1136/oem.35.4.285. PMC 1008445. PMID 367424.
- ^ Perry W, Konopka K. "Lung - Otras neumonitis intersticial / fibrosis - bronquiolitis respiratoria". Tema Completado: 1 de julio de 2020. Cambios menores: 1 de julio de 2020.
- ^ Zander, Dani (2018). Patología pulmonar. Philadelphia, PA: Elsevier. ISBN 978-0-323-39308-9 OCLC 968711140. - VII Lesión pulmonar aguda con Siderophages
- ^ Majno G, Joris I (12 de agosto de 2004). Celdas, Tissues y Enfermedades: Principios de Patología General. Oxford University Press. p. 620. ISBN 978-0-19-974892-1. OCLC 76950968. Retrieved 19 de marzo 2013.
- ^ a b c d Lambrecht, BN (abril de 2006). "Macrofragio alveolar en el asiento del conductor" Inmunity. 24 (4): 366-8. doi:10.1016/j.immuni.2006.03.008. PMID 16618595.
- ^ a b Guyton AC (2007). "Capítulo 33: Fisiología del sistema respiratorio". Textbook of Medical Physiology. págs. 431 a 433.
- ^ a b c d e f h i j k l m n o p q r s Stafford JL, Neumann NF, Belosevic M (2002). "Macrophage-mediated innate host defense against protozoan parasites". Reseñas críticas en microbiología. 28 (3): 187–248. doi:10.1080/1040-840291046731. PMID 12385499. S2CID 38166749.
- ^ a b c Krutzik SR, Modlin RL (febrero de 2004). "El papel de los receptores de Toll en la lucha contra la micobacteria". Seminarios en Inmunología. 16 (1): 35–41. doi:10.1016/j.smim.2003.10.005. PMID 14751762.
- ^ a b c d e f g h i Serezani CH, Chung J, Ballinger MN, Moore BB, Aronoff DM, Peters-Golden M (noviembre de 2007). "Prostaglandin E2 suprime el asesinato bacteriano en macrófagos alveolares al inhibir la oxidasa NADPH". American Journal of Respiratory Cell and Molecular Biology. 37 (5): 562–70. doi:10.1165/rcmb.2007-0153OC. PMC 2048683. PMID 17585108.
- ^ a b Holt PG, Oliver J, Bilyk N, McMenamin C, McMenamin PG, Kraal G, Thepen T (febrero de 1993). "Desregulación del antígeno que presenta funciones celulares de células dendritas pulmonares in vivo por macrófagos alveolares residentes". The Journal of Experimental Medicine. 177 (2): 397–407. doi:10.1084/jem.177.2.397. PMC 2190916. PMID 8426110.
- ^ a b Bunn HJ, Hewitt CR, Grigg J (mayo de 2002). "Represión de la proliferación de células mononucleares de sangre periférica por macrófagos alveolares de niños pequeños". Inmunología clínica y experimental. 128 (2): 313–7. doi:10.1046/j.1365-2249.2002.01848.x. PMC 1906398. PMID 12041510.
- ^ a b c d e f h i j k l m n o p q r Bingisser RM, Holt PG (abril de 2001). "Mecanismos inmunomoduladores en el tracto respiratorio inferior: óxido nítrico interacciones mediadas entre macrófagos alveolares, células epiteliales y células T". Swiss Medical Weekly. 131 (13–14): 171–9. doi:10.4414/smw.2001.09653PMID 11345807. S2CID 37202272.
- ^ a b c d e Lacraz S, Nicod L, Galve-de Rochemonteix B, Baumberger C, Dayer JM, Welgus HG (agosto de 1992). "Represión de la biosíntesis de metalloproteinasa en macrófagos alveolares humanos por interleucina-4". The Journal of Clinical Investigation. 90 (2): 382-8. doi:10.1172/JCI115872. PMC 443112. PMID 1322938.
- ^ a b c Brock TG, Serezani CH, Carstens JK, Peters-Golden M, Aronoff DM (enero de 2008). "Efectos de prostaglandina E2 en la localización subcelular de proteínas Epac-1 y Rap1 durante la fagocitosis mediada por Fcgamma en macrófagos alveolares". Experimental Cell Research. 314 (2): 255–63. doi:10.1016/j.yexcr.2007.10.011. PMC 2390918. PMID 18021770.
- ^ Pouliot P, Turmel V, Gélinas E, Laviolette M, Bissonnette EY (junio de 2005). "Interleukin-4 producción por macrófagos alveolares humanos". Alergía clínica y experimental. 35 (6): 804-10. doi:10.1111/j.1365-2222.2005.02246.x. PMID 15969673. S2CID 22847451.
- ^ a b Paul WE (mayo de 1991). "Interleukin-4: un linfokine inmunoregulatorio prototípico". Sangre. 77 (9): 1859–70. doi:10.1182/blood.V77.9.1859.1859. PMID 2018830.
- ^ a b c Yoshizawa S, Tateda K, Matsumoto T, Gondaira F, Miyazaki S, Standiford TJ, Yamaguchi K (mayo de 2005). "Legionella pneumophila evades la supresión de crecimiento mediada por gamma a través de la inducción interleucina-10 en macrófagos derivados de la médula ósea". Infección e inmunidad. 73 (5): 2709–17. doi:10.1128/IAI.73.5.2709-2717.2005. PMC 1087334. PMID 15845473.
- ^ a b Araya J, Cambier S, Morris A, Finkbeiner W, Nishimura SL (agosto de 2006). "La activación del factor-beta transformador mediado por la integrina regula la homeostasis de la unidad trofica epitelial-mesenquimal pulmonar". El American Journal of Pathology. 169 (2): 405–15. doi:10.2353/ajpath.2006.060049. PMC 1698780. PMID 16877343.
- ^ Morris DG, Huang X, Kaminski N, Wang Y, Shapiro SD, Dolganov G, Glick A, Sheppard D (marzo de 2003). "La pérdida de integrin alpha(v)beta6-mediated TGF-beta activación causa enfisema dependiente de Mmp12". Naturaleza. 422 (6928): 169–73. código:2003Natur.422..169M. doi:10.1038/nature01413. PMID 12634787. S2CID 4407206.
- ^ a b c d e f h i j k Takabayshi K, Corr M, Hayashi T, Redecke V, Beck L, Guiney D, Sheppard D, Raz E (abril de 2006). "Inducción de un circuito homeostático en tejido pulmonar por compuestos microbianos". Inmunity. 24 (4): 475-87. doi:10.1016/j.immuni.2006.02.008. PMID 16618605. (Retracted, see doi:10.1016/j.immuni.2008.04.011, PMID 18504811)
- ^ a b c Ray CA, Lasbury ME, Durant PJ, Wang SH, Zhang C, Liao CP, Tschang D, Lee CH (2006). "Transforming growth factor-beta activation and signaling in the alveolar environment during Pneumocystis pneumonia". The Journal of Eukaryotic Microbiology. 53 (Supl 1): S127-9. doi:10.1111/j.1550-7408.2006.00200.x. PMID 17169028. S2CID 37439751.
- ^ a b Annes JP, Munger JS, Rifkin DB (enero de 2003). "Haciendo sentido de la activación latente TGFbeta". Journal of Cell Science. 116 (Pt 2): 217–24. doi:10.1242/jcs.00229. PMID 12482908.
- ^ Munger JS, Huang X, Kawakatsu H, Griffiths MJ, Dalton SL, Wu J, Pittet JF, Kaminski N, Garat C, Matthay MA, Rifkin DB, Sheppard D (Febrero de 1999). "El alfa integrino v beta 6 se une y activa la beta de TGF latente 1: un mecanismo para regular la inflamación pulmonar y la fibrosis". Celular. 96 (3): 319–28. doi:10.1016/S0092-8674(00)80545-0. PMID 10025398.
- ^ a b Ohbayashi H, Shimokata K (abril de 2005). "Matrix metalloproteinase-9 y remodelación de vías respiratorias en asma". Metas de drogas actuales. Inflamación y alergia. 4 (2): 177–81. doi:10.2174/1568010053586246. PMID 15853739.
Enlaces externos
- Imagen histológica: 13906loa – Sistema de aprendizaje de histología en la Universidad de Boston - "Sistema respiratorio: pulmón (humano), macrófagos alveolares"
- Histología en KUMC resp-resp16 "Alveoli"
- Diapositiva en ufl.edu