Lisavirus del murciélago australiano
Lissavirus del murciélago australiano (ABLV), originalmente llamado Lissavirus de los pterópidos (PLV), es un virus enzoótico estrechamente relacionado con el virus de la rabia. Se identificó por primera vez en un zorro volador negro juvenil (Pteropus alecto) de 5 meses de edad, recolectado cerca de Ballina en el norte de Nueva Gales del Sur, Australia, en enero de 1995 durante un programa nacional de vigilancia para el recientemente identificado Hendra. virus. ABLV es el séptimo miembro del género Lyssavirus (que incluye el virus de la rabia) y el único miembro del Lyssavirus presente en Australia. ABLV se ha clasificado en el filogrupo I de los Lyssavirus.
Virología
Estructura molecular
El lisavirus del murciélago australiano (ABVL) comparte muchas características estructurales con los otros lisovirus, a pesar de ser genética y serológicamente distinto de los demás. Visualmente, el ABLV es un virus con forma de bala. Molecularmente, ABVL es un virus de ARN monocatenario, con envoltura y de sentido negativo. El genoma (-)ssRNA es relativamente pequeño, contiene 12 kilobases de material genético y codifica cinco proteínas virales. Las cinco proteínas virales, su símbolo y sus funciones funcionales son:

| Signatura | Nombre | Estructura | Función |
|---|---|---|---|
| N | Nucleoproteína | Interactúa con genoma, P y L para formar el complejo ribonucleoproteína | Encapsula el genoma del ARN, haciéndolo disponible para la transcripción y reproducción del genoma |
| P | fosfoproteína | Cofactor para L | Funciones reguladoras para la replicación viral
Ayuda a evadir el virus sistema inmunitario host - suprimir la inmunidad host |
| M | Matriz | Conectar físicamente el capsid viral con la membrana derivada del host
Interactos con P y L | Ayudas en montaje viral, coordina la traducción y la replicación del genoma, y dirige el brote |
| G | Glycoproteína | Espejos de proteína de superficie trimérica, asociados con M y se extiende a través del sobre de membrana derivada de la célula huésped | Utilizado para la entrada de la célula huésped con endocitosis mediada por receptores |
| L | Polimerasa RNA dependiente | Enzyme para la transcripción (producir mRNA del genoma) y la replicación del genoma viral |
Mecanismo de entrada viral y tráfico intracelular
ABLV tiene un mecanismo de entrada similar al de otros virus de la rabia, utilizando endocitosis mediada por receptores por parte de las células huésped. La glicoproteína (G) es una proteína de pico trimérica que se extiende a través de la envoltura del virus y puede interactuar con los receptores de superficie de las células huésped. Si bien los receptores específicos siguen siendo en su mayoría desconocidos en este momento, se cree que el ABLV ingresa al sistema nervioso del huésped a través de la unión neuromuscular del sistema nervioso periférico. Además, se cree que la proteína de pico se une a un receptor del huésped altamente específico o utiliza un correceptor en balsas de lípidos. Algunos de los receptores propuestos incluyen el receptor nicotínico de acetilcolina (nAchR), el receptor de neurotrofina p75 (p75NTR) y la molécula de adhesión de células neuronales (NCAM).
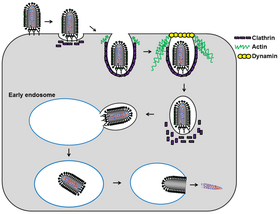
Después de unirse a la superficie de la célula huésped, el ABLV utiliza una vía dependiente de clatrina-dinamina para invaginar la membrana del huésped y extraer una vesícula. La polimerización de actina en el sitio de invaginación también es necesaria para una entrada viral exitosa. El virus está completamente endocitosado, sin envoltura. La vesícula se fusiona con un lisosoma, lo que hace que baje el pH dentro de la vesícula infectada. La disminución del pH en el endosoma temprano provoca un cambio conformacional en la proteína de pico G. Esto permite que la envoltura viral se fusione con el endosoma, liberando la nucleocápside en el citoplasma de la célula huésped.
Prevalencia
Reservorio huésped y especies susceptibles
Los murciélagos, tanto zorros voladores como murciélagos insectívoros, son el único reservorio huésped conocido del ABLV. Las especies conocidas de reservorios de murciélagos son el zorro volador negro (Pteropus alecto), el zorro volador de cabeza gris (P. poliocephalus), el zorro volador de anteojos ( P. conscpicullatus), el pequeño zorro volador rojo (P. scapulatus) y el murciélago cola de vaina de vientre amarillo (Saccolaimus flaviventris). Estas especies se distribuyen por todo el continente australiano, y el ABLV sólo se ha encontrado serológica y filogenéticamente en Australia. Se estima que menos del 1% de los murciélagos sanos son portadores del ABLV. En cuanto a los murciélagos enfermos o heridos, se estima que entre un 5 y un 10% han sido infectados, detectados mediante pruebas de anticuerpos fluorescentes.
En cuanto a otras especies susceptibles a la infección por ABLV, se han notificado casos en humanos y caballos desde 1996 y 2013, respectivamente. No se ha informado que ningún otro animal terrestre esté infectado con ABLV, a pesar de la exposición conocida a murciélagos infectados. Sin embargo, estudios recientes han encontrado que el receptor ABLV para la entrada a la célula huésped se conserva en una variedad de mamíferos, incluidos, entre otros, pequeños roedores, monos y conejos.

Distribución geográfica
Hasta ahora, el ABLV solo se ha aislado y reportado en Australia. La distribución de ABLV en todo el continente australiano se basa en la distribución ecológica de los reservorios de murciélagos. De las cuatro especies de zorros voladores identificadas como reservorios hospedantes, el ABLV está presente en áreas de Australia Occidental, el Territorio del Norte, Queensland, Nueva Gales del Sur y Victoria. Del murciélago cola de vaina de vientre amarillo, el ABLV está presente en toda Australia continental.
Salud humana
Incidencias zoonóticas
El primer caso ocurrió en noviembre de 1996, cuando un cuidador animal en Rockhampton sufrió varios rasguños de los murciélagos de frutas con los que trabajaba. Ella reportó al hospital cuatro a cinco semanas más tarde por dolor de hombro, mareos, vómitos, dolor de cabeza, fiebre y escalofríos. Mientras se hospitaliza, su condición se deterioró rápidamente, con un discurso arraigado, diplopia (doble visión), disfagia (dificultad tragar), y debilidad progresiva en sus miembros. De muestras de líquido cefalorraquídeo, no se encontraron organismos con microscopía o secultación, a pesar de los niveles elevados de glóbulos blancos. Fue tratada con varios antibióticos de amplio espectro sin mejora. Se realizó un electroencefalograma y encontró encefalitis difusa. Finalmente cayó en un estado consciente deprimido, con una sola incidencia de agitación extrema. En su 11o día de hospitalización, era totalmente dependiente de ventilación, no responsable e hipertérmica. Murió 20 días después de su admisión inicial. ABLV fue identificado de tejido cerebral por reacción en cadena de polimerasa e inmunohistoquímica.
El segundo caso comenzó en agosto de 1996, Monique Todhunter, de 37 años, de Mackay, fue mordida en el dedo por un zorro volador en una fiesta de cumpleaños, mientras intentaba quitárselo a un niño sobre el que había aterrizado. Seis meses después, tras la mayor atención pública por la primera muerte por ABLV, consultó a un médico de cabecera sobre las pruebas del virus. Se le recomendó profilaxis post-exposición, pero por una razón desconocida ella rechazó el tratamiento. Después de una incubación de 27 meses, en noviembre de 1998 desarrolló una enfermedad similar a la rabia. Llegó con síntomas de fiebre, vómitos, dolor en el hombro, disfagia y espasmos musculares. Su condición empeoró después del ingreso hospitalario, ya que su disfagia aumentó, sus espasmos musculares se hicieron más pronunciados y frecuentes y se volvió cada vez más agitada. Se volvió dependiente de la ventilación y incapaz de comunicarse debido a una parálisis total. El día de la hospitalización de la mujer, se sometieron a análisis líquido cefalorraquídeo, suero y saliva. Al cuarto día de su ingreso hospitalario, estas pruebas fueron devueltas con resultados de probable infección por ABLV. La infección por ABLV se confirmó mediante PCR al octavo día de hospitalización. Murió 19 días después del inicio de la enfermedad. Todas las pruebas post mortem fueron fuertemente positivas para ABLV. Una característica notable de este caso es que el paciente pasó por un período de incubación de 27 meses; en comparación, la mayoría de los casos de rabia tienen un período de incubación de 20 a 90 días, y el 95% de los casos presentan síntomas dentro del año posterior a la exposición al virus.
El tercer caso, y el más reciente, ocurrió en diciembre de 2012, cuando un murciélago arañó a un niño de ocho años en el norte de Queensland. Ocho semanas después enfermó y mostró síntomas que incluían fiebre, anorexia y dolor abdominal. Su condición empeoró durante su hospitalización, con episodios anormales y agresivos entre el comportamiento normal y espasmos musculares intensos. Necesitó en repetidas ocasiones ser extubado y sedado debido a sus espasmos. El hospital realizó varias pruebas durante su estadía, incluido el envío de muestras de sangre y líquido cefalorraquídeo para su análisis, la toma de imágenes de tomografía computarizada de su pecho y abdomen y la realización de neuroimágenes (MRI, electroencefalografía). Inicialmente, las pruebas para los antígenos ABLV fueron negativas, pero las pruebas repetidas 12 días después de su hospitalización arrojaron resultados positivos. El niño falleció 28 días después del inicio de los síntomas el 22 de febrero de 2013.
Patología y patogénesis del ABLV en humanos
El ABLV (y los otros Lyssavirus) se presentan de manera similar al virus de la rabia encefalítica tradicional (RABV) en humanos. Los primeros síntomas son parecidos a los de la gripe, con fiebre, dolores de cabeza y fatiga. Los síntomas progresan con parálisis, delirio, convulsiones y muerte. No se conocen supervivientes humanos de la infección por ABLV después de que se hayan manifestado los síntomas.
La patogénesis del ABLV aún es ampliamente desconocida y aún se está estudiando. Inicialmente, el virus infecta al huésped a través del sistema nervioso periférico después de una mordedura o rasguño de un animal infectado.
Para los tres casos de ABLV notificados en humanos, el período de incubación osciló entre unas pocas semanas y casi dos años.
Tratamientos actuales para ABLV
Debido a su dificultad de diagnóstico, el bajo número de casos reportados y su relativa novedad como virus endémico, no existen planes de tratamiento exitosos una vez que los síntomas han comenzado. Como se indicó anteriormente, todos los métodos de intervención utilizados en los tres casos humanos de ABLV no fueron curativos y los tres casos resultaron en muerte.
Sin embargo, los médicos recomiendan encarecidamente recibir el protocolo de profilaxis post-exposición (PEP) de RABV inmediatamente después de una posible exposición al lisavirus (es decir, exposición/interacción con murciélagos). Además, el incidente debe ser reportado a la unidad de salud pública correspondiente. Actualmente, el protocolo PEP implica una limpieza profunda de la herida y el tejido circundante, la administración de la vacuna antirrábica y la administración de inmunoglobulina antirrábica (RIG). Actualmente, existen dos variaciones efectivas de RIG utilizadas en el protocolo PEP, RIG humana (HRIG) y RIG equina (ERIG). Las desventajas de HRIG son que hay suministros limitados y el costo de producción es alto. HRIG es en general inaccesible para la población en general. Los inconvenientes de ERIG son la posible inmunogenicidad, que ocurre cuando el sistema inmunológico reconoce el RIG como extraño y provoca una reacción inmune. En un estudio de 2021 realizado por Weir, Coggins y otros, se propuso un nuevo método de tratamiento que utilizaba anticuerpos monoclonales humanos en lugar de RIG. Identificaron dos (A6 y F11) que reconocían la proteína G de los lisavirus del filogrupo I (incluido el ABLV) y neutralizaban completamente el virus. También lo propusieron como una posible herramienta de diagnóstico, en la que solo existen métodos limitados con PCR y llegan tarde a la fase sintomática para identificar positivamente el ABLV.
Prevención
La vacuna contra la rabia y la inmunoglobulina son eficaces en la protección profiláctica y terapéutica contra la infección por ABLV. Desde la aparición del virus, la vacuna contra la rabia se administra a personas con mayor riesgo de exposición, y se proporcionan vacunas e inmunoglobulinas para el tratamiento posterior a la exposición.
Las unidades de salud pública de Australia aconsejan a la población evitar y limitar al máximo sus interacciones y contacto físico con los murciélagos. ABLV es uno de los cuatro virus zoonóticos descubiertos en murciélagos pterópidos desde 1994, los otros son el virus Hendra, el virus Nipah y el virus Menangle. De estos, el ABLV es el único virus que se sabe que es transmisible a los humanos directamente desde los murciélagos sin un huésped intermediario. Por tanto, la educación y la sensibilización de la población en general son imprescindibles. Si se encuentra un murciélago y/o parece herido, se debe evitar el contacto con él y en su lugar llamar al control local de plagas y animales para eliminarlo adecuadamente.
Salud no humana
También se ha informado que el ABLV tiene la capacidad de transferirse a los caballos. Actualmente, esta es la única otra especie susceptible conocida.
ABLV se confirmó en dos caballos en Darling Downs de Queensland en mayo de 2013. Ambos caballos fueron sacrificados cuando su condición se deterioró a pesar del tratamiento y el veterinario a cargo realizó un examen post mortem obteniendo muestras que permitido para el diagnóstico de laboratorio. Luego la propiedad fue puesta en cuarentena. Tres perros y los cuatro caballos en contacto más cercano recibieron profilaxis posterior a la exposición, al igual que las nueve personas en contacto. El virus fue aislado e identificado como la cepa de murciélago insectívoro. Estos casos han llevado a reconsiderar el posible contagio del ABLV a las especies de animales domésticos. Se insta a los veterinarios a considerar el ABLV como diagnóstico diferencial en casos de enfermedad neurológica generalizada progresiva.
Lectura adicional
- Samaratunga H, Searle JW, Hudson N (agosto de 1998). "N-rabies Lyssavirus encefalitis humana de los murciélagos de frutas: infección de Lyssavirus de murciélago australiano (pteropid Lyssavirus)". Neuropatología y Neurobiología Aplicada. 24 (4): 331–335. doi:10.1046/j.1365-2990.1998.00129.x. PMID 9775399. S2CID 22171516.
- Fraser GC, Hooper PT, Lunt RA, Gould AR, Gleeson LJ, Hyatt AD, et al. (1996). "Encefalitis causada por un Lyssavirus en murciélagos de frutas en Australia". Enfermedades Infecciosas Emergentes. 2 (4): 327-331. doi:10.3201/eid0204.960408. PMC 2639915. PMID 8969249.
- Annand EJ, Reid PA (septiembre de 2014). "Revisación clínica de dos casos de infección equina fatal con la cepa insectívora del bat lyssavirus australiano". Australian Veterinary Journal. 92 (9): 324–332. doi:10.1111/avj.12227. PMID 25156050.
Contenido relacionado
Ley de Fick
Precisión y exactitud
Evidencia empírica