Lincosamidas
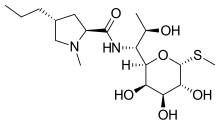

Lincosamidas son una clase de antibióticos, que incluyen lincomycina, clindamicina y pirlimina.
Estructura
Las lincosamidas constan de un anillo de pirrolidina unido a un resto de piranosa (metiltio-lincosamida) mediante un enlace amida. La hidrólisis de las lincosamidas, específicamente la lincomicina, divide la molécula en sus componentes básicos de los restos de azúcar y prolina. Por el contrario, ambos derivados pueden recombinarse en el propio fármaco o en un derivado.
Síntesis
La biosíntesis de lincosamidas se produce a través de una vía bifásica, en la que la propilprolina y la metiltiolincosamida se sintetizan de forma independiente inmediatamente antes de la condensación de las dos moléculas precursoras. La condensación del grupo carboxilo propilprolina con el grupo amina metiltiolincosamida a través de un enlace amida forma N-desmetillincomicina. La N-desmetillincomicina se metila posteriormente mediante S-adenosil metionina para producir lincomicina A.
La lincomicina es producida naturalmente por especies de bacterias, a saber, Streptomyces lincolnensis, S. roseolus y S. caelestis. La clindamicina se deriva mediante la sustitución (7S)-cloro del grupo (7R)-hidroxilo de la lincomicina. La lincomicina se aísla principalmente de fermentaciones de Streptomyces lincolnensis, mientras que la clindamicina se prepara de forma semisintética. Si bien se han preparado varios cientos de derivados sintéticos y semisintéticos de lincosamidas, en la práctica clínica sólo se utilizan lincomicina A y clindamicina debido a problemas de toxicidad y baja actividad biológica en otros antibióticos de lincosamida.

Mecanismo de acción
Las lincosamidas previenen la replicación bacteriana en un mecanismo bacteriostático al interferir con la síntesis de proteínas.
En un mecanismo similar a los macrólidos y la estreptogramina B, las lincosamidas se unen cerca del centro de peptidil transferasa en la porción 23S de la subunidad 50S de los ribosomas bacterianos. Bajo la influencia de rayos X de alta resolución, las estructuras de clindamicina y las subunidades ribosómicas de la bacteria han revelado previamente una unión exclusiva al segmento 23S de la cavidad de peptidil transferasa. La unión está mediada por la fracción de azúcar micarosa que tiene sustratos parcialmente superpuestos con la peptidil transferasa. Al extenderse al centro de peptidil transferasa, las lincosamidas provocan la disociación prematura de peptidil-ARNt que contienen dos, tres o cuatro residuos de aminoácidos. En este caso, los péptidos crecerán hasta cierto punto hasta que el impedimento estérico inhiba la actividad de la peptidil transferasa. Las lincosamidas no interfieren con la síntesis de proteínas en las células humanas (o las de otros eucariotas) debido a diferencias estructurales entre los ribosomas procarióticos y eucariotas. Las lincosamidas se utilizan contra las bacterias Gram positivas ya que no pueden atravesar las porinas de las bacterias Gram negativas.

Resistencia
Metilación ribosómica
Poco después de la aparición del uso clínico de lincosamida en 1953, se aislaron cepas de estafilococos resistentes en varios países, incluidos Francia, Japón y Estados Unidos. Las cepas resistentes se caracterizaron por la expresión de metiltransferasas que dimetilan residuos dentro de la subunidad 23S del ARN ribosómico, impidiendo la unión de macrólidos, lincosamidas y estreptograminas B. La familia de genes responsable de codificar estas metiltransferasas se conoce como " em" familia de genes de la eritromicina ribosoma metilasa. Hasta la fecha se han descrito casi 40 genes erm, que se transfieren principalmente a través de plásmidos y transposones.
Mutación objetivo
Se han aislado varias cepas de bacterias que son altamente resistentes al tratamiento con macrólidos y se ha descubierto que poseen mutaciones en la bolsa de unión de la transferasa en la subunidad ribosomal 23S. Se descubrió que el Streptococcus pneumoniae resistente a macrólidos aislado de pacientes hospitalarios en Europa del este y América del Norte contenía mutaciones en el gen 23S u otros genes de proteínas ribosómicas.
Eflujo de antibióticos
Las bacterias gramnegativas albergan genes que codifican bombas moleculares que pueden contribuir a la resistencia de compuestos hidrofóbicos como macrólidos y lincosamidas. De las muchas familias de bombas de resistencia a múltiples fármacos, las lincosamidas se desvían con mayor frecuencia a través de bombas que pertenecen a la superfamilia de resistencia, nodulación y división celular. Los estafilococos expresan bombas de eflujo con especificidad por macrólidos de anillos de 14 y 15 miembros y estreptogramina B, pero no por moléculas de lincosamida.

Modificación de fármacos
Se han informado aislados clínicos de S. aureus que albergan genes que codifican lincosamida nucleotransferasas. Los genes lnuA e lnuB confieren resistencia a la lincomicina, pero no a la clindamicina. Sin embargo, estos genes limitan la actividad bacteriostática de la clindamicina. Este tipo de resistencia es poco común en S. aureus, pero se ha informado que es más frecuente en otras cepas de bacterias.
Farmacocinética
Aproximadamente el 90 % de las lincosamidas administradas por vía oral se absorben, con una ligera variación según el fármaco que se administre. Las concentraciones plasmáticas por esta vía alcanzan su punto máximo en 2 a 4 horas. La administración intramuscular de lincosamidas produce una fuerte absorción y se alcanzan niveles plasmáticos máximos en 1 a 2 horas. Alrededor del 90% de la clindamicina se une a las proteínas plasmáticas y, en general, es más estable y se absorbe más rápidamente que la lincomicina.
Las lincosamidas tienen una amplia distribución en varios tejidos, excluyendo el líquido cefalorraquídeo. Cuando se administró por vía intramuscular a ratas, se encontró que la lincomicina se acumulaba en concentraciones más altas en los riñones en comparación con otros tejidos, mientras que la clindamicina se encontró en concentraciones más altas en los pulmones. La clindamicina se acumula en los macrófagos y otros glóbulos blancos, lo que puede dar lugar a concentraciones 50 veces superiores a los niveles plasmáticos.
Uso clínico
Las lincosamidas se utilizan a menudo clínicamente como un antibiótico alternativo para pacientes alérgicos a la penicilina. De las lincosamidas, la clindamicina se usa con mayor frecuencia en la clínica debido a su mayor biodisponibilidad, mayor absorción oral y eficacia dentro del espectro del organismo diana. Las lincosamidas son generalmente la clase de antibióticos de primera elección en microbiología veterinaria y se utilizan con mayor frecuencia para combatir infecciones de la piel.
Los usos clínicos potenciales de los antibióticos de lincosamida en humanos son numerosos. Son eficaces en el tratamiento de infecciones dentales, infecciones abdominales, abscesos, enfermedades inflamatorias pélvicas e infecciones anaeróbicas. Se ha demostrado que la clindamicina sola es eficaz en el tratamiento del acné, el síndrome de shock tóxico y la malaria, y que disminuye el riesgo de partos prematuros en mujeres con vaginosis bacteriana. Los antibióticos de lincosamida también pueden ser útiles en el tratamiento de S. aureus resistente a meticilina.
Toxicidad e interacciones

Si bien no ha habido informes de toxicidad orgánica grave por el tratamiento con lincosamida, se han asociado trastornos gastrointestinales con su administración. La enterocolitis pseudomembranosa resultante de la alteración de la flora gastrointestinal inducida por clindamicina puede ser un evento adverso letal observado en varias especies cuando se usa en la clínica veterinaria, particularmente en caballos. En dosis extremadamente altas de clindamicina, se ha demostrado parálisis del músculo esquelético en varias especies. Las lincosamidas pueden interactuar con agentes anestésicos para producir efectos neuromusculares.
Otras reacciones adversas incluyen diarrea, náuseas, vómitos, dolor abdominal y sarpullido. La administración tópica de clindamicina puede inducir dermatitis de contacto, sequedad, ardor, picazón, descamación y descamación de la piel.
Formulaciones de marca de lincosamida
- Clindamycin - Cleocin, Cleocin Pediatric, ClindaMax Vaginal, Dalacin
- Lincomycin - Lincocin
- Pirlimycin
Historia
El primer compuesto de lincosamida descubierto fue la lincomicina, aislada de Streptomyces lincolnensis en una muestra de suelo de Lincoln, Nebraska (de ahí el nombre bacteriano).