Leyes de la termodinámica
Las leyes de la termodinámica definen un grupo de cantidades físicas, como la temperatura, la energía y la entropía, que caracterizan los sistemas termodinámicos en equilibrio termodinámico. Las leyes también utilizan varios parámetros para los procesos termodinámicos, como el trabajo termodinámico y el calor, y establecen relaciones entre ellos. Afirman hechos empíricos que forman una base para excluir la posibilidad de ciertos fenómenos, como el movimiento perpetuo. Además de su uso en termodinámica, son importantes leyes fundamentales de la física en general y son aplicables en otras ciencias naturales.
Tradicionalmente, la termodinámica ha reconocido tres leyes fundamentales, nombradas simplemente por una identificación ordinal, la primera ley, la segunda ley y la tercera ley. Una declaración más fundamental fue etiquetada más tarde como la ley cero, después de que se establecieron las tres primeras leyes.
- Primera ley de la termodinámica establece que, cuando la energía entra o sale de un sistema (como trabajo, calor o materia), la energía interna del sistema cambia de acuerdo con la ley de conservación de la energía.
- Segunda ley de la termodinámica establece que en un proceso termodinámico natural, la suma de las entropías de los sistemas termodinámicos que interactúan nunca disminuye. Otra forma del enunciado es que el calor no pasa espontáneamente de un cuerpo más frío a un cuerpo más caliente.
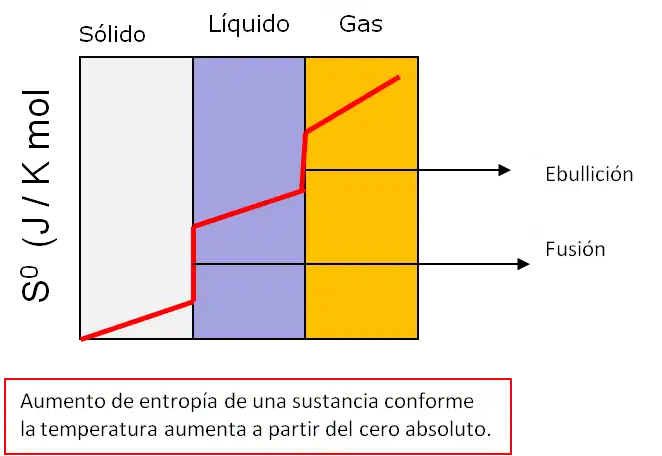
- Tercera ley de la termodinámica establece que la entropía de un sistema se acerca a un valor constante cuando la temperatura se acerca al cero absoluto. Con la excepción de los sólidos no cristalinos (vidrios), la entropía de un sistema en el cero absoluto suele ser cercana a cero.
- Ley cero de la termodinámica define el equilibrio térmico y forma una base para la definición de temperatura: si dos sistemas están en equilibrio térmico cada uno con un tercer sistema, entonces están en equilibrio térmico entre sí.
La primera y segunda leyes prohíben dos tipos de máquinas de movimiento perpetuo, respectivamente: la máquina de movimiento perpetuo del primer tipo que produce trabajo sin entrada de energía, y la máquina de movimiento perpetuo del segundo tipo que convierte espontáneamente la energía térmica en trabajo mecánico.
Primera ley
La primera ley de la termodinámica es una versión de la ley de conservación de la energía, adaptada a los procesos termodinámicos. En general, la ley de conservación establece que la energía total de un sistema aislado es constante; la energía se puede transformar de una forma a otra, pero no se puede crear ni destruir.
En un sistema cerrado (es decir, no hay transferencia de materia dentro o fuera del sistema), la primera ley establece que el cambio en la energía interna del sistema (Δ U sistema) es igual a la diferencia entre el calor suministrado al sistema (Q) y el trabajo (W) realizado por el sistema sobre su entorno. (Tenga en cuenta que una convención de signos alternativa, que no se usa en este artículo, es definir W como el trabajo realizado en el sistema por su entorno): 
Para procesos que incluyen transferencia de materia, se necesita una declaración adicional.
Cuando dos sistemas inicialmente aislados se combinan en un nuevo sistema, entonces la energía interna total del nuevo sistema, U sistema, será igual a la suma de las energías internas de los dos sistemas iniciales, U 1 y U 2: 
La Primera Ley engloba varios principios:
- Conservación de la energía, que dice que la energía no puede crearse ni destruirse, sino que solo puede cambiar de forma. Una consecuencia particular de esto es que la energía total de un sistema aislado no cambia.
- El concepto de energía interna y su relación con la temperatura. Si un sistema tiene una temperatura definida, entonces su energía total tiene tres componentes distinguibles, denominados energía cinética (energía debida al movimiento del sistema como un todo), energía potencial (energía resultante de un campo de fuerza impuesto desde el exterior) y energía interna.. El establecimiento del concepto de energía interna distingue la primera ley de la termodinámica de la ley más general de conservación de la energía.
- El trabajo es un proceso de transferencia de energía hacia o desde un sistema en formas que pueden describirse mediante fuerzas mecánicas macroscópicas que actúan entre el sistema y su entorno. El trabajo realizado por el sistema puede provenir de su energía cinética total, de su energía potencial total o de su energía interna.
Por ejemplo, cuando una máquina (que no es parte del sistema) levanta un sistema hacia arriba, parte de la energía se transfiere de la máquina al sistema. La energía del sistema aumenta a medida que se realiza trabajo sobre el sistema y, en este caso particular, el aumento de energía del sistema se manifiesta como un aumento en la energía potencial gravitatoria del sistema. El trabajo agregado al sistema aumenta la energía potencial del sistema:
- Cuando la materia se transfiere a un sistema, la energía interna asociada de las masas y la energía potencial se transfieren con él.

- El flujo de calor es una forma de transferencia de energía. El calentamiento es el proceso natural de mover energía hacia o desde un sistema que no sea por trabajo o transferencia de materia. En un sistema diatérmico, la energía interna solo puede cambiarse mediante la transferencia de energía en forma de calor:
La combinación de estos principios conduce a una declaración tradicional de la primera ley de la termodinámica: no es posible construir una máquina que genere trabajo perpetuamente sin una cantidad igual de entrada de energía a esa máquina. O más brevemente, una máquina de movimiento perpetuo del primer tipo es imposible.
Segunda ley
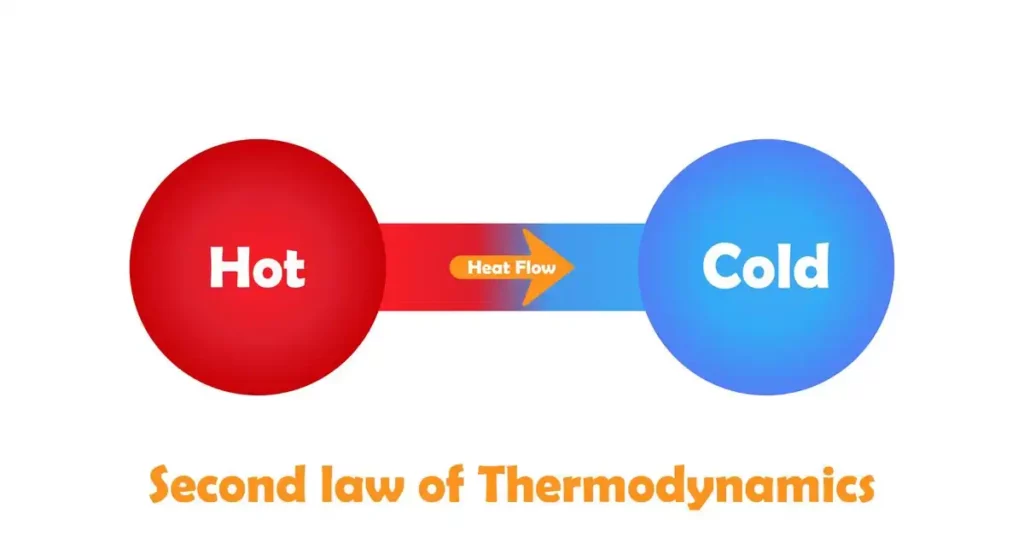
La segunda ley de la termodinámica indica la irreversibilidad de los procesos naturales y, en muchos casos, la tendencia de los procesos naturales a conducir hacia la homogeneidad espacial de la materia y la energía, y especialmente de la temperatura. Se puede formular en una variedad de formas interesantes e importantes. Uno de los más simples es el enunciado de Clausius, según el cual el calor no pasa espontáneamente de un cuerpo más frío a uno más caliente.
Implica la existencia de una cantidad llamada entropía de un sistema termodinámico. En términos de esta cantidad implica que
Cuando se permite que interactúen dos sistemas inicialmente aislados en regiones separadas pero cercanas del espacio, cada uno en equilibrio termodinámico consigo mismo pero no necesariamente entre sí, eventualmente alcanzarán un equilibrio termodinámico mutuo. La suma de las entropías de los sistemas inicialmente aislados es menor o igual a la entropía total de la combinación final. La igualdad ocurre justo cuando los dos sistemas originales tienen todas sus respectivas variables intensivas (temperatura, presión) iguales; entonces el sistema final también tiene los mismos valores.
La segunda ley es aplicable a una amplia variedad de procesos, tanto reversibles como irreversibles. De acuerdo con la segunda ley, en una transferencia de calor reversible, un elemento de calor transferido, δQ, es el producto de la temperatura (T), tanto del sistema como de las fuentes o destino del calor, con el incremento (dS) de la variable conjugada del sistema, su entropía (S):
Si bien los procesos reversibles son un caso límite teórico útil y conveniente, todos los procesos naturales son irreversibles. Un buen ejemplo de esta irreversibilidad es la transferencia de calor por conducción o radiación. Mucho antes del descubrimiento de la noción de entropía, se sabía que cuando dos cuerpos, inicialmente de diferentes temperaturas, entran en conexión térmica directa, el calor fluye inmediata y espontáneamente del cuerpo más caliente al más frío.
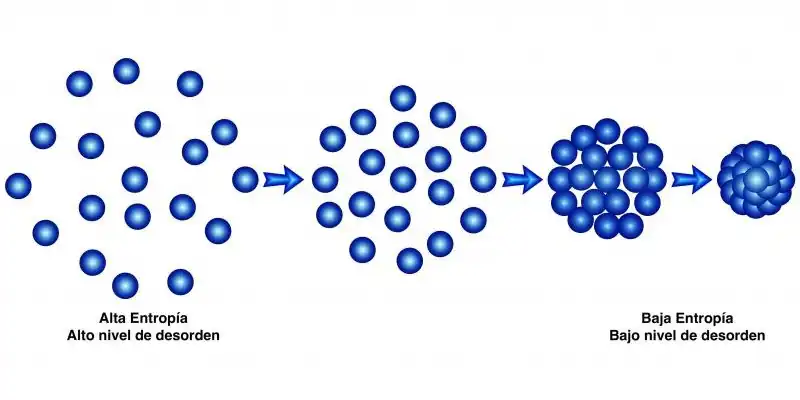
La entropía también puede verse como una medida física relacionada con los detalles microscópicos del movimiento y la configuración de un sistema, cuando solo se conocen los estados macroscópicos. Estos detalles a menudo se denominan desorden a escala microscópica o molecular y, con menos frecuencia, dispersión de energía.. Para dos estados especificados macroscópicamente de un sistema, existe una cantidad definida matemáticamente llamada "diferencia de entropía de información entre ellos". Esto define cuánta información física microscópica adicional se necesita para especificar uno de los estados especificados macroscópicamente, dada la especificación macroscópica del otro, a menudo un estado de referencia elegido convenientemente que puede presuponerse que existe en lugar de declararse explícitamente. Una condición final de un proceso natural siempre contiene efectos especificables microscópicamente que no son total y exactamente predecibles a partir de la especificación macroscópica de la condición inicial del proceso.De manera equivalente, en un proceso termodinámico, la energía se propaga.
Tercera ley
La tercera ley de la termodinámica puede enunciarse como:
La entropía de un sistema se acerca a un valor constante cuando su temperatura se acerca al cero absoluto.
A temperatura cero, el sistema debe estar en el estado con la energía térmica mínima, el estado fundamental. El valor constante (no necesariamente cero) de la entropía en este punto se denomina entropía residual del sistema. Tenga en cuenta que, con la excepción de los sólidos no cristalinos (p. ej., vidrios), la entropía residual de un sistema suele ser cercana a cero.Sin embargo, llega a cero solo cuando el sistema tiene un estado fundamental único (es decir, el estado con la energía térmica mínima tiene solo una configuración o microestado). Los microestados se utilizan aquí para describir la probabilidad de que un sistema se encuentre en un estado específico, ya que se supone que cada microestado tiene la misma probabilidad de ocurrir, por lo que los estados macroscópicos con menos microestados son menos probables. En general, la entropía está relacionada con el número de posibles microestados según el principio de Boltzmann:
Donde S es la entropía del sistema, k B la constante de Boltzmann y Ω el número de microestados. En el cero absoluto solo hay 1 microestado posible (Ω = 1 ya que todos los átomos son idénticos para una sustancia pura y, como resultado, todos los órdenes son idénticos ya que solo hay una combinación) y 
Ley cero
La ley cero de la termodinámica sienta las bases de la temperatura como parámetro empírico en los sistemas termodinámicos y establece la relación transitiva entre las temperaturas de múltiples cuerpos en equilibrio térmico. La ley puede expresarse de la siguiente forma:
Si dos sistemas están en equilibrio térmico con un tercer sistema, entonces están en equilibrio térmico entre sí.
Aunque esta versión de la ley es una de las versiones más comunes, es solo una de una diversidad de declaraciones que se etiquetan como "la ley cero". Algunas declaraciones van más allá, para proporcionar el importante hecho físico de que la temperatura es unidimensional y que uno puede organizar conceptualmente los cuerpos en una secuencia de números reales de más frío a más caliente.
Estos conceptos de temperatura y de equilibrio térmico son fundamentales para la termodinámica y fueron claramente enunciados en el siglo XIX. El nombre 'ley cero' fue inventado por Ralph H. Fowler en la década de 1930, mucho después de que la primera, segunda y tercera leyes fueran ampliamente reconocidas. La ley permite la definición de temperatura de forma no circular sin referencia a la entropía, su variable conjugada. Se dice que tal definición de temperatura es 'empírica'.
Relaciones de Onsager
Las relaciones recíprocas de Onsager han sido consideradas la cuarta ley de la termodinámica. Describen la relación entre los flujos termodinámicos y las fuerzas en la termodinámica de no equilibrio, bajo el supuesto de que las variables termodinámicas se pueden definir localmente en una condición de equilibrio local. Estas relaciones se derivan de la mecánica estadística bajo el principio de reversibilidad microscópica (en ausencia de campos magnéticos externos). Dado un conjunto extenso de parámetros X i (energía, masa, entropía, número de partículas) y fuerzas termodinámicas F i (relacionadas con parámetros intrínsecos, como la temperatura y la presión), el teorema de Onsager establece que
donde
se denominan flujos termodinámicos.
Historia
La historia de la termodinámica está fundamentalmente entrelazada con la historia de la física y la historia de la química y, en última instancia, se remonta a las teorías del calor en la antigüedad. Las leyes de la termodinámica son el resultado de los avances en este campo durante el siglo XIX y principios del XX. El primer principio termodinámico establecido, que finalmente se convirtió en la segunda ley de la termodinámica, fue formulado por Sadi Carnot en 1824 en su libro Reflexiones sobre la fuerza motriz del fuego. Para 1860, como se formalizó en los trabajos de científicos como Rudolf Clausius y William Thomson, se establecieron lo que ahora se conoce como la primera y la segunda ley. Más tarde, el teorema de Nernst (o postulado de Nernst), que ahora se conoce como la tercera ley, fue formulado por Walther Nernst durante el período 1906-1912. Si bien la numeración de las leyes es universal hoy en día, varios libros de texto a lo largo del siglo XX han numerado las leyes de manera diferente. En algunos campos, se consideró que la segunda ley se ocupaba únicamente de la eficiencia de los motores térmicos, mientras que la llamada tercera ley se ocupaba de los aumentos de entropía. Gradualmente, esto se resolvió por sí solo y más tarde se agregó una ley cero para permitir una definición de temperatura autoconsistente. Se han sugerido leyes adicionales, pero no han alcanzado la generalidad de las cuatro leyes aceptadas y, por lo general, no se analizan en los libros de texto estándar. esto se resolvió solo y luego se agregó una ley cero para permitir una definición de temperatura autoconsistente. Se han sugerido leyes adicionales, pero no han alcanzado la generalidad de las cuatro leyes aceptadas y, por lo general, no se analizan en los libros de texto estándar. esto se resolvió solo y luego se agregó una ley cero para permitir una definición de temperatura autoconsistente. Se han sugerido leyes adicionales, pero no han alcanzado la generalidad de las cuatro leyes aceptadas y, por lo general, no se analizan en los libros de texto estándar.
Contenido relacionado
Medición de presión
Dispersión de Rutherford
Almacenamiento de energía magnética superconductora





