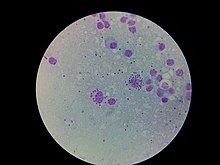
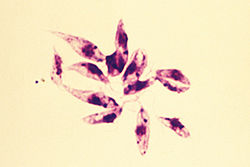
Leishmania
Leishmania es un protozoario parásito, un organismo unicelular del género Leishmania responsable de la enfermedad leishmaniasis. Se propagan por flebótomos del género Phlebotomus en el Viejo Mundo, y del género Lutzomyia en el Nuevo Mundo. Al menos 93 especies de flebotomos son vectores comprobados o probables en todo el mundo. Sus huéspedes principales son los vertebrados; Leishmania comúnmente infecta a damanes, cánidos, roedores y humanos.
Historia
Se han detectado miembros de un género antiguo del parásito Leishmania, Paleoleishmania, en flebótomos fosilizados que datan del período Cretácico temprano. La primera referencia escrita a los síntomas evidentes de la leishmaniasis cutánea apareció en el Paleotrópico en textos orientales que datan del siglo VII a. C. (supuestamente transcritos de fuentes varios cientos de años anteriores, entre 1500 y 2000 a. C.). Debido a su prevalencia amplia y persistente a lo largo de la antigüedad como una enfermedad misteriosa de resultados sintomáticos diversos, la leishmaniasis ha sido denominada con varios nombres que van desde "lepra blanca" a la "fiebre negra". Algunos de estos nombres sugieren vínculos con creencias culturales o mitologías negativas, que todavía alimentan la estigmatización social de la leishmaniasis en la actualidad.
En India, tanto la leishmaniasis cutánea como la visceral son causadas por Leishmania donovani. Los primeros registros de leishmaniasis cutánea en la India fueron de funcionarios médicos británicos a principios del siglo XIX. La enfermedad se conocía entonces como "llaga oriental" o "ebullición de Delhi"; mientras que la forma visceral se llamaba "fiebre de Burdwan [en honor a la ciudad de Burdwan]", "kala azar" (fiebre negra), o "Dumdum [una ciudad en Bengala Occidental] fiebre".
El parásito causante de la enfermedad fue identificado en 1901 como un hallazgo simultáneo de William Boog Leishman y Charles Donovan. Visualizaron de forma independiente parásitos unicelulares microscópicos (más tarde llamados cuerpos de Leishman-Donovan) que vivían dentro de las células de los órganos humanos infectados. El género parásito se clasificaría más tarde como protozoos tripanosomátidos bajo la designación filogenética Leishmania donovani. Desde entonces, varias especies se han clasificado y agrupado en dos subgéneros principales, a saber, Leishmania Viannia (generalmente ubicada en el Neotrópico) o Leishmania Leishmania (generalmente ubicada en el Paleotrópico, con la gran excepción del subgrupo L. mexicana).
Epidemiología
Leishmania afecta actualmente a 6 millones de personas en 98 países. Cada año se producen entre 0,9 y 1,6 millones de casos nuevos y se sabe que 21 especies causan enfermedades en humanos: se considera una zoonosis.
Estructura
Las especiesLeishmania son eucariotas unicelulares que tienen un núcleo bien definido y otros orgánulos celulares que incluyen cinetoplastos y flagelos. Dependiendo de la etapa de su ciclo de vida, existen en dos variantes estructurales, como:
- El amastigo la forma se encuentra en los fagocitos mononucleares y sistemas circulatorios de humanos. Es una forma intracelular y no motil, siendo carente de flagelo externo. El flagelo corto está incrustado en el extremo anterior sin proyectarse. Es oval en forma, y mide 3-6 μm de longitud y 1–3 μm de anchura. El kinetoplast y el cuerpo basal se encuentran hacia el extremo anterior.
- El promastigote forma se encuentra en el tracto alimenticio de las sandalias. Es una forma extracelular y fútil. Es considerablemente más grande y muy alargada, midiendo 15-30 μm de longitud y 5 μm de ancho. Es en forma de husillo, grabando en ambos extremos. Un flagelo largo (sobre la longitud del cuerpo) se proyecta externamente en el extremo anterior. El núcleo se encuentra en el centro, y delante de él están el kinetoplast y el cuerpo basal.
Evolución
Se debaten los detalles de la evolución de este género, pero Leishmania aparentemente evolucionó a partir de un linaje ancestral de tripanosomas. El linaje más antiguo es el de los Bodonidae, seguido del Trypanosoma brucei, este último confinado al continente africano. Los grupos Trypanosoma cruzi con tripanosomas de murciélagos, mamíferos sudamericanos y canguros sugieren un origen en el hemisferio sur. Estos clados solo están relacionados de forma lejana.
Los clados restantes en este árbol son Blastocrithidia, Herpetomonas y Phytomonas. Los cuatro géneros Leptomonas, Crithidia, Leishmania y Endotrypanum forman las ramas terminales, lo que sugiere un origen relativamente reciente. Varios de estos géneros pueden ser polifiléticos y pueden necesitar una mayor división.
Los orígenes del género Leishmania en sí no están claros. Una teoría propone un origen africano, con migración a las Américas. Otro propone la migración de las Américas al Viejo Mundo a través del puente terrestre del Estrecho de Bering hace unos 15 millones de años. Una tercera teoría propone un origen paleártico. Tales migraciones implicarían la migración posterior del vector y el reservorio o adaptaciones sucesivas a lo largo del camino. Una migración más reciente es la de L. infantum desde países mediterráneos hasta América Latina (conocido como L. chagasi), desde la colonización europea del Nuevo Mundo, donde los parásitos recogieron sus actuales vectores del Nuevo Mundo en sus respectivos ecosistemas. Esta es la causa de las epidemias ahora evidentes. Una epidemia reciente del Nuevo Mundo afecta a los perros raposeros en los Estados Unidos.
Aunque se sugirió que Leishmania podría haber evolucionado en el Neotrópico. esto es probablemente cierto para las especies pertenecientes a los subgéneros Viannia y Endotrypanum. Sin embargo, hay evidencia de que la principal evolución de los subgéneros Leishmania y Sauroleishmania es el Viejo Mundo. Mientras que las especies Mundinia parecen ser más universales en su evolución. Una teoría es que diferentes linajes se aislaron geográficamente durante diferentes períodos y esto es lo que dio lugar a este mosaicismo evolutivo. Pero no hay duda de que las Leishmaniinae son un grupo monofilético.
Un análisis de un gran conjunto de datos sugiere que Leishmania evolucionó hace entre 90 y 100 millones de años en Gondwana. Las especies que infectan a los reptiles se originaron en los clados de mamíferos.
Las especies deSauroleishmania se definieron originalmente sobre la base de que infectaban a los reptiles (lagartos) en lugar de a los mamíferos. Basándose en evidencias moleculares, se han trasladado al estado de subgénero dentro de Leishmania. Este subgénero probablemente evolucionó de un grupo que originalmente infectaba a los mamíferos.
Taxonomía
53 especies son reconocidas en este género. Se disputa el estado de varios de estos, por lo que el número final puede diferir. Al menos 20 especies infectan a los humanos. Para hacer las cosas más complejas, los híbridos podrían estar involucrados, como se informó en Brasil con un híbrido entre Leishmania (V.) guyanensis y Leishmania (V.) shawi shawi.
El género se divide actualmente en 4 subgéneros: Leishmania, Sauroleishmania, Mundinia y Viannia. La división en los dos subgéneros (Leishmania y Viannia) fue realizada por Lainson y Shaw en 1987 sobre la base de su ubicación dentro del intestino del insecto. Las especies del subgénero Viannia se desarrollan en el intestino posterior: L. (V.) braziliensis ha sido propuesta como especie tipo para este subgénero. Esta división ha sido confirmada por todos los estudios posteriores. Shaw, Camargo y Teixeira crearon el subgénero Mundinia mientras revisaban Leishmaniinae en 2016.
Endotrypanum está estrechamente relacionado con Leishmania. Algunas especies de Endotypanum son únicas porque infectan los eritrocitos de sus huéspedes (perezosos). Todas las especies están confinadas a América Central y del Sur. E. colombiensis se han encontrado infecciones en el hombre.
Sauroleishmania fue originalmente descrito por Ranquein 1973 como un género separado, pero los estudios moleculares sugieren que en realidad es un subgénero en lugar de un género separado.
La división propuesta de Leishmania en grupos Euleishmania y Paraleishmania en 2000 enfatizó la profunda distancia filogenética entre los parásitos, algunos de los cuales habían sido nombrada como especie Leishmania. La Euleishmania incluía especies actualmente ubicadas en los subgéneros Leishmania, Sauroleishmania, Mundinia y Viannia. La Paraleishmania propuesta incluía especies de Endotypanum, Leishmamnia-L. colomubensis, L. herreri, L. hertigiy L. deanei y L. equatorensis. En una revisión reciente, estas especies recibieron un estatus genérico diferente.
Ahora se reconocen cuatro subgéneros de Leishmania: Leishmania, Sauroleishmania, Viannia y Mundinia (el complejo L. enriettii). Los géneros Endotrypanum y Porcisia pertenecen a la Paraleishmania.
Hay cuatro especies de Mundinia - L. (Mundinia) enriettii, L. (Mundinia) martiniquensis, L. (Mundinia) macropodum, y L. (Mundinia) orientalis, que se encuentra en Tailandia.
L. El estado específico de archibaldi es inestable, pero está estrechamente relacionado con L. donovani.
L. herreri pertenece al género Endotypanum y no a Leishmania.
L. donovani y L. infantum están estrechamente relacionados.
Notas
La selenoenzima Seltryp parece ser exclusiva de este pedido. Se ha eliminado del subgénero Viannia.
L. deanei y L. hertigi, que infectan a los puercoespines se han trasladado al género Porcisia.
Clasificación
Subgénero Leishmania Ross, 1903 sensu Saf'janova, 1982
- Leishmania aethiopica Bray, Ashford & Bray, 1973
- Leishmania amazonensis Lainson " Shaw, 1972 (incluye garnhami Scorza et al., 1979)
- Leishmania arabica Peters, Elbihari & Evans, 1986
- Leishmania aristidesi Lainson " Shaw, 1979
- Leishmania donovani (Laveran & Mesnil, 1903)
- Leishmania forattinii Yoshida, Cuba, Pacheco, Cupolillo, Tavares, Machado, Homen " Grimaldi, 1993
- Leishmania gerbilli Wang, Qu " Guan, 1964
- Leishmania infantum Nicolle, 1908 (subespecies chagasi Cunha " Chagas, 1937)
- Leishmania killicki Rioux, Lamotte " Pratlong, 1986
- Leishmania major Yakimoff " Schokhor, 1914
- Leishmania mexicana Biagi, 1953
- Leishmania pifanoi Medina & Romero, 1959
- Leishmania tropica (Wright, 1903)
- Leishmania turanica Strelkova, Shurkhal, Kellina, Eliseev, Evans, Peters, Chapman, Le Blancq & van Eys, 1990
- Leishmania venezeulensis Bonfante-Garrido, 1980
- Leishmania waltoni Shaw, Pratlong " Dedet 2015
Subgénero Mundinia Shaw, Camargo y Teixeira 2016
- Leishmania enriettii Muniz & Medina, 1948
- Leishmania macropodum Barratt, Kaufer, Peters, Craig, Lawrence, Roberts, Lee, McAuliffe, Stark, Ellis, 2017
- Leishmania martiniquensis Desbois, Pratlong, Quist and Dedet,2014
- Leishmania orientalis Jariyapan, Daroontum, Jaiwong, Chanmol, Intakhan, Sor-Suwan, Siriyasatien, Somboon, Bates, Bates, 2018
Subgénero Sauroleishmania Ranque, 1973 sensu Saf'janova, 1982
- Leishmania adleri Heisch, 1958
- Leishmania agamae David, 1929
- Leishmania ceramodactyli Adler " Theodor ", 1929
- Leishmania gulikae Ovezmukhammedov " Saf'janova, 1987
- Leishmania gimnasionodactyli † Khodukin " Sofiev, 1940
- Leishmania helioscopi † Chodukin " Sofiev, 1940
- Leishmania hemidactyli Mackie, Gupta " Swaminath, 1923
- Leishmania hoogstraali McMillan, 1965
- Leishmania nicollei Chodukin " Sofieff, 1940
- Leishmania platycephala Telford, 2009
- Leishmania phrynocephali Chodukin " Sofieff, 1940
- Leishmania senegalensis Ranque, 1973
- Leishmania sofieffi ↑ Markov, Lukina " Markova, 1964
- Leishmania tarentolae Wenyon, 1921
- Leishmania zmeevi ↑ Andruchko " Markov 1955
- Leishmania zuckermani Paperna, Boulard, Hering-Hagenbeck " Landau, 2001
↑ Especie descrita como Sauroleishmania. Su desarrollo no es como el de otros miembros del subgénero, por lo que su posición taxonómica es dudosa.
Subgénero Viannia Lainson & Shaw 1987
- Leishmania braziliensis Vianna, 1911
- Leishmania guyanensis Floch, 1954
- Leishmania lainsoni Silveira, Shaw, Braga & Ishikawa, 1987
- Leishmania lindenbergi Silveira, Ishikawa, De Souza " Lainson, 2002
- Leishmania naiffi Lainson " Shaw, 1989
- Leishmania panamensis Lainson " Shaw, 1972
- Leishmania peruviana Velez, 1913
- Leishmania shawi Lainson, Braga " de Souza, 1989
- Leishmania utingensis Braga, Lainson, Ishikawa & Shaw 2003
Géneros relacionados
Las relaciones entre Leishmania y otros géneros como Endotrypanum, Novymonas, Porcisia y Zelonia no está claro actualmente, ya que están estrechamente relacionados. Endotrypanum colombiensis, más conocido como Leishmania colombiensis, se ha asociado con leishmaniasis tanto cutánea como visceral en Venezuela.
Género Endotrypanum
- Endotrypanum colombiensis Kreutzer, Corredor, Grimaldi, Grogl, Rowton, Young, Morales, McMahon-Pratt, Guzman " Tesh, 1991
- Endotrypanum equatorensis Grimaldi, Kreutzer, Hashiguchi, Gomet, Mimory " Tesh, 1992
- Endotrypanum herreri Zeledon, Ponce " Murillo, 1979
- Endotrypanum monterogeii Shaw, 1969
- Endotrypanum schaudinni Mesnil y Brimont, 1908
Género Novymonas Kostygov y Yurchenko 2016
- Novymonas esmeraldas Votýpka, Kostygov, Maslov y Lukeš, 2016
Género Porcisia Shaw, Camargo y Teixeira, 2016
- Porcisia deanei Lainson " Shaw, 1977
- Porcisia hertigi Herrer, 1971
Género Zelonia Shaw, Camargo y Teixeira, 2016
- Zelonia australiensis Barratt, Kaufer, Peters, Craig, Lawrence, Roberts, Lee, McAuliffe, Stark, Ellis, 2017
- Zelonia costaricensis Yurchenko, Lukes, Jirku, Zeledon, Maslov, 2006
Bioquímica y biología celular
La bioquímica y biología celular de Leishmania es similar a la de otros cinetoplástidos. Comparten las mismas características morfológicas principales: un solo flagelo que tiene una invaginación, el bolsillo flagelar, en su base; un cinetoplasto, que se encuentra en una sola mitocondria; y una matriz subpelicular de microtúbulos, que constituyen la parte principal del citoesqueleto.
Recubrimiento de lipofosfoglicanos
Leishmania posee una capa de lipofosfoglicanos sobre el exterior de la célula. El lipofosfoglicano es un desencadenante del receptor tipo toll 2, un receptor de señalización involucrado en el desencadenamiento de una respuesta inmunitaria innata en los mamíferos.
La estructura precisa del lipofosfoglucano varía según la especie y la etapa del ciclo de vida del parásito. El componente de glicano es particularmente variable y se pueden usar diferentes variantes de lipofosfoglicano como marcador molecular para diferentes etapas del ciclo de vida. Las lectinas, un grupo de proteínas que se unen a diferentes glicanos, se utilizan a menudo para detectar estas variantes de lipofosfoglicanos. Por ejemplo, la aglutinina de maní se une a un lipofosfoglicano particular que se encuentra en la superficie de la forma infecciosa de L. mayor.
El parásito utiliza el lipofosfoglicano para promover su supervivencia en el huésped y los mecanismos mediante los cuales el parásito hace esto se centran en la modulación de la respuesta inmunitaria del huésped. Esto es vital, ya que los parásitos Leishmania viven dentro de los macrófagos y necesitan evitar que los macrófagos los maten. El lipofosfoglicano tiene un papel en la resistencia al sistema del complemento, inhibiendo la respuesta del estallido oxidativo, induciendo una respuesta inflamatoria y evitando que las células T asesinas naturales reconozcan que el macrófago está infectado con el parásito Leishmania.
| Tipo | Pathogen | Ubicación |
|---|---|---|
| Leishmaniasis cutánea (localizado y difuso) infecciones aparecen como reacciones cutáneas obvias. | El más común es el Oriental Sore (causado por especies del Viejo Mundo L. major, L. tropica, y L. aethiopica). En el Nuevo Mundo, los culpables más comunes son L. mexicana. | Las infecciones cutáneas son más comunes en Afganistán, Brasil, Irán, Perú, Arabia Saudita y Siria. |
| Leishmaniasis mucocutánea las infecciones comienzan como una reacción en la picadura, y pueden pasar por metástasis en la membrana mucosa y llegar a ser fatal. | L. braziliensis | Las infecciones mucocutáneas son más comunes en Bolivia, Brasil y Perú. Las infecciones mucocutáneas también se encuentran en Karamay, China Xinjiang Uygur Región Autónoma. |
| Visceral leishmaniasis Las infecciones suelen ser reconocidas por fiebre, hinchazón del hígado y bazo y anemia. Son conocidos por muchos nombres locales, de los cuales el más común es probablemente kala azar, | Utilizado exclusivamente por especies de la L. donovani complejosL. donovani, L. infantum Sí. L. chagasi). | En las zonas tropicales y subtropicales de todos los continentes, excepto Australia, las infecciones viscerales son más comunes en Bangladesh, Brasil, India, Nepal y Sudán. Visceral leishmaniasis also found in part of China, such as Sichuan Province, Gansu Province, and Xinjiang Uygur Autonomous Region. |
Mecanismo intracelular de infección
Para evitar la destrucción por parte del sistema inmunitario y prosperar, la Leishmania 'oculta' dentro de las células de su huésped. Esta ubicación le permite evitar la acción de la respuesta inmunitaria humoral (porque el patógeno está seguro dentro de una célula y fuera del torrente sanguíneo abierto) y, además, puede evitar que el sistema inmunitario destruya a su huésped a través de señales superficiales no peligrosas que desalientan la apoptosis. Los principales tipos de células infiltradas de Leishmania son células fagocíticas como los neutrófilos y los macrófagos.
Por lo general, una célula inmunitaria fagocítica, como un macrófago, ingiere un patógeno dentro de un endosoma cerrado y luego llena este endosoma con enzimas que digieren el patógeno. Sin embargo, en el caso de Leishmania, estas enzimas no tienen efecto, permitiendo que el parásito se multiplique rápidamente. Este crecimiento desinhibido de parásitos eventualmente abruma al macrófago huésped u otra célula inmune, causando su muerte.
Transmitido por el flebótomo, los parásitos protozoarios de L. major puede cambiar la estrategia de la primera defensa inmunitaria de comer/inflamar/matar a comer/sin inflamación/no matar del fagocito huésped y corromperlo para su propio beneficio. Usan rigurosamente los granulocitos polimorfonucleares de neutrófilos (PMN) que fagocitan voluntariamente como un escondite engañoso, donde proliferan sin ser reconocidos por el sistema inmunitario y entran en los macrófagos de larga vida para establecer un 'oculto'. infección.
Adopción y supervivencia
Al producirse una infección microbiana, los PMN salen del torrente sanguíneo a través de los vasos' capa endotelial, al sitio del tejido infectado (tejido dérmico después de la picadura de mosca). Inmediatamente inician la primera respuesta inmunitaria y fagocitan al invasor mediante el reconocimiento de superficies extrañas y activadoras en el parásito. Los PMN activados secretan quimiocinas, en particular IL-8, para atraer más granulocitos y estimular la fagocitosis. Además, L. major aumenta la secreción de IL-8 por parte de los PMN. Este mecanismo también se observa durante la infección con otros parásitos intracelulares obligados. Para microbios como estos, existen múltiples mecanismos de supervivencia intracelular. Sorprendentemente, la coinyección de patógenos apoptóticos y viables provoca un curso de la enfermedad mucho más fulminante que la inyección de solo parásitos viables. Cuando la señal antiinflamatoria de la fosfatidilserina, que normalmente se encuentra en las células apoptóticas, queda expuesta en la superficie de los parásitos muertos, L. major apaga el estallido oxidativo, evitando así la destrucción y degradación del patógeno viable.
En el caso de Leishmania, la progenie no se genera en los PMN, pero de esta manera pueden sobrevivir y persistir desenredados en el sitio primario de infección. Las formas de promastigotes también liberan factor quimiotáctico (LCF) de Leishmania para reclutar activamente neutrófilos, pero no otros leucocitos, por ejemplo, monocitos o células NK. Además de eso, la producción de proteína 10 (IP10) inducible por interferón gamma (IFNγ) por PMN se bloquea en presencia de Leishmania, lo que implica el cierre de la respuesta inmune inflamatoria y protectora por parte de NK y Reclutamiento de células Th1. Los patógenos permanecen viables durante la fagocitosis ya que sus huéspedes principales, los PMN, exponen el patrón molecular asociado a células apoptóticas (ACAMP) que indica que no hay patógenos.
Persistencia y atracción
La vida útil de los granulocitos de neutrófilos es bastante corta. Circulan en el torrente sanguíneo durante aproximadamente 6 a 10 horas después de salir de la médula ósea, después de lo cual experimentan apoptosis espontánea. Se ha informado que los patógenos microbianos influyen en la apoptosis celular mediante diferentes estrategias. Obviamente, debido a la inhibición de la activación de caspasa3, L. major puede inducir el retraso de la apoptosis de los neutrófilos y prolongar su vida útil durante al menos 2-3 días. El hecho de prolongar la vida útil es muy beneficioso para el desarrollo de la infección porque las células hospedadoras finales de estos parásitos son los macrófagos, que normalmente migran a los sitios de infección en dos o tres días. Los patógenos no son monótonos; en cambio, asumen el mando en el sitio primario de infección. Inducen la producción por parte de los PMN de las quimiocinas MIP-1α y MIP-1β (proteína inflamatoria de macrófagos) para reclutar macrófagos.
Un factor importante en la prolongación de la infección es la inhibición del sistema inmunitario adaptativo. Esto ocurre especialmente durante las fases intercelulares, cuando los amastigotes buscan nuevos macrófagos para infectar y son más susceptibles a las respuestas inmunitarias. Se apunta a casi todos los tipos de fagocitos. Por ejemplo, se ha demostrado que mincle es el objetivo de L. mayor. La interacción entre mincle y una proteína liberada por el parásito da como resultado una respuesta inmune debilitada en las células dendríticas.
Teoría de la fagocitosis silenciosa
Para salvar la integridad del tejido circundante de los componentes celulares tóxicos y las enzimas proteolíticas contenidas en los neutrófilos, los macrófagos eliminan silenciosamente los PMN apoptóticos. Los PMN moribundos exponen la fosfatidilserina de la señal 'cómeme' que se transfiere a la capa exterior de la membrana plasmática durante la apoptosis. Debido a la apoptosis retardada, los parásitos que persisten en los PMN son absorbidos por los macrófagos, empleando un proceso absolutamente fisiológico y no flogístico. La estrategia de esta "fagocitosis silenciosa" tiene las siguientes ventajas para el parásito:
- Tomar células apoptóticas silencia la actividad de matanza de macrófagos que conduce a la supervivencia de los patógenos.
- Los patógenos dentro de las PMN no tienen contacto directo con los receptores de la superficie de macrófago, porque no pueden ver el parásito dentro de la célula apoptótica. Así, la activación del fagocito para la activación inmunitaria no ocurre.
Sin embargo, los estudios han demostrado que esto es poco probable, ya que se observa que los patógenos abandonan las células apoptópicas y no se conocen pruebas de absorción de macrófagos por este método.
Biología molecular
Un aspecto importante del protozoo Leishmania es su capa glicoconjugada de lipofosfoglicano (LPG). Este se mantiene unido con un ancla de membrana de fosfoinosítido y tiene una estructura tripartita que consta de un dominio lipídico, un hexasacárido neutro y una galactosa-manosa fosforilada, con una terminación en una tapa neutra. Estos parásitos no solo desarrollan la digestión posterior al flebotomo, sino que también se cree que es esencial para los estallidos oxidativos, lo que permite el paso de la infección. Las características de la digestión intracelular incluyen un endosoma que se fusiona con un lisosoma, liberando hidrolasas ácidas que degradan el ADN, el ARN, las proteínas y los carbohidratos.
Genómica
Los genomas de cuatro especies de Leishmania (L. major, L. infantum, L. donovani y L. braziliensis) han sido secuenciados, revelando más de 8300 genes que codifican proteínas y 900 genes de ARN. Casi el 40% de los genes que codifican proteínas pertenecen a 662 familias que contienen entre dos y 500 miembros. La mayoría de las familias de genes más pequeños son conjuntos en tándem de uno a tres genes, mientras que las familias de genes más grandes a menudo están dispersas en conjuntos en tándem en diferentes loci a lo largo del genoma. Cada uno de los 35 o 36 cromosomas está organizado en una pequeña cantidad de grupos de genes de decenas a cientos de genes en la misma cadena de ADN. Estos grupos se pueden organizar cabeza a cabeza (divergentes) o cola a cola (convergentes), esta última a menudo separada por genes tRNA, rRNA y/o snRNA. La transcripción de genes que codifican proteínas se inicia bidireccionalmente en las regiones de cambio de hebra divergentes entre grupos de genes y se extiende policistrónicamente a través de cada grupo de genes antes de terminar en la región de cambio de hebra que separa los grupos convergentes. Los telómeros de Leishmania suelen ser relativamente pequeños y consisten en unos pocos tipos diferentes de secuencias repetidas. Se pueden encontrar pruebas de recombinación entre varios grupos diferentes de telómeros. El L. mayor y L. infantum contienen sólo unas 50 copias de elementos relacionados con Ingi/L1Tc degenerados inactivos (DIRE), mientras que L. braziliensis también contiene varios elementos transponibles asociados a telómeros y retroelementos asociados a líderes empalmados. Los genomas de Leishmania comparten un proteoma central conservado de unos 6200 genes con los tripanosomátidos relacionados Trypanosoma brucei y Trypanosoma cruzi, pero alrededor de 1000 Leishmania Se conocen genes específicos , que en su mayoría se distribuyen aleatoriamente por todo el genoma. Existen relativamente pocas (alrededor de 200) diferencias específicas de especies en el contenido de genes entre los tres genomas secuenciados de Leishmania, pero alrededor del 8% de los genes parecen estar evolucionando a diferentes velocidades entre las tres especies, lo que indica diferencias presiones selectivas que podrían estar relacionadas con la patología de la enfermedad. Alrededor del 65% de los genes que codifican proteínas actualmente carecen de asignación funcional.
Las especies deLeishmania producen varias proteínas de choque térmico diferentes. Estos incluyen Hsp83, un homólogo de Hsp90. Un elemento regulador en el 3' UTR de Hsp83 controla la traducción de Hsp83 de manera sensible a la temperatura. Esta región forma una estructura de ARN estable que se funde a temperaturas más altas.
Inestabilidad genómica
Leishmania carece de regulación promotor-dependiente, por lo que su regulación genómica es a nivel postranscripcional mediante variaciones en el número de copias (CNV) de los transcritos, mecanismo capaz de controlar la abundancia de estos transcritos según la situación en la que se encuentra el organismo. Estos procesos provocan una gran susceptibilidad a la inestabilidad genómica en el parásito. Esto implica interacciones epistáticas entre genes, que impulsan estos cambios en la expresión génica, lo que conduce a mecanismos compensatorios en el genoma de Leishmania que dan como resultado la evolución adaptativa del parásito. Durante la investigación realizada por Giovanni Bussotti y colaboradores en el Instituto Pasteur, perteneciente a la Universidad de París, un estudio de asociación del genoma completo (GWAS) de Leishmania donovani identificó CNVs en el 14% de las regiones codificantes y en el 4% de las regiones no codificantes. Además, se realizó un estudio de evolución experimental (EE Approach) de amastigotes de L. donovani obtenidos de casos clínicos de hámsteres. Al extraer estos amastigotes de organismos infectados y cultivarlos in vitro durante 36 semanas (3800 generaciones), se demostró cómo la inestabilidad genómica de este parásito es capaz de adaptarse a situaciones complicadas, como el cultivo in vitro. Se detectó una deleción de 11 kb en el gen que codifica para Ld1S_360735700, una quinasa relacionada con NIMA con funciones clave en la correcta progresión de la mitosis. Con el avance de las generaciones de cultivos in vitro se hace más notoria la pérdida de la quinasa, disminuyendo la tasa de crecimiento del parásito, pero la inestabilidad genómica de Leishmania consigue, mediante mecanismos compensatorios, atenuar esta reducción del crecimiento para que el cultivo in vitro se mantenga.. En primer lugar, como adaptación del cultivo a la pérdida de esta quinasa, se detectó un aumento en la expresión de otra quinasa ortóloga (Ld1S_360735800) cuya región codificante es adyacente a la de la quinasa perdida. En segundo lugar, se observó una reducción en la expresión de 23 transcritos relacionados con la biogénesis flagelar. Así la adaptación en Leishmania lleva al parásito a eliminar de sus necesidades el movimiento flagelar, ya que no es necesario en cultivo in vitro, conservando la energía invertida en este movimiento para aumentar la tasa de crecimiento y compensar la pérdida de la quinasa. Finalmente, se observó la coamplificación de grupos de proteínas ribosómicas, ARN ribosómico (ARNr), ARN de transferencia (ARNt) y ARN pequeño nucleolar (ARNsno). El aumento de la expresión de estos grupos conduce a un aumento de la biogénesis ribosomal y la biosíntesis de proteínas. Esto es más evidente en el caso de los ARN nucleolares pequeños (snoRNA), para los cuales se observó la amplificación de un grupo grande de 15 snoRNA en el cromosoma 33. La función de estos ácidos nucleicos es la metilación y la inclusión de pseuouridina en los ribosomas. En este caso, se observó un aumento de estas modificaciones en las subunidades grandes de los ribosomas de los individuos en cultivo, concretamente en el PTC (centro de peptidil transferasa) y en el túnel de entrada del ARNm al ribosoma para la síntesis de proteínas. Estos cambios conducen a un aumento en la biogénesis ribosómica, lo que da como resultado una mayor síntesis de proteínas y una mayor tasa de crecimiento. En conclusión, la pérdida de la quinasa se compensa con la inestabilidad genómica de Leishmania donovani aumentando la expresión de otra quinasa ortóloga, disminuyendo la biogénesis flagelar y aumentando la biogénesis ribosomal. Estas compensaciones hacen que la tasa de crecimiento del cultivo se vea lo menos afectada posible por la pérdida inicial de la quinasa, y el parásito se adapte perfectamente al cultivo in vitro, que no es su hábitat natural.
Reproducción sexual
El sistema reproductivo de un patógeno microbiano es uno de los procesos biológicos básicos que condicionan la ecología del microorganismo y la propagación de enfermedades. En 2009 Akopyants et al. demostró que L. major tiene un ciclo sexual, incluido un proceso meiótico. Se forma una progenie híbrida que tiene complementos genómicos completos de ambos padres. El apareamiento solo ocurre en el vector de la mosca de la arena, y los híbridos pueden transmitirse al huésped mamífero por la picadura de la mosca de la arena. En L. braziliensis los apareamientos en la naturaleza son predominantemente entre individuos relacionados, lo que resulta en una endogamia extrema. La tasa de cruzamiento entre diferentes cepas de Leishmania en el vector del flebótomo depende de la frecuencia de coinfección. Tales eventos de cruzamiento lejano parecen ser raros en L. mayor y L. donovani.
L. infantum produce proteínas BRCA1 y RAD51 que interactúan entre sí para promover la reparación recombinacional homóloga. Estas proteínas juegan un papel clave en la meiosis. Por lo tanto, los eventos meióticos brindan la ventaja adaptativa de una reparación recombinacional eficiente de los daños en el ADN, incluso cuando no conducen a cruces lejanos.
Contenido relacionado
Adrenoleucodistrofia
Quinolona
Absorción