Lactona
Las lactonas son ésteres carboxílicos cíclicos que contienen una estructura de 1-oxacicloalcano-2-ona (−C(=O)−O−), o análogos que tienen insaturación o heteroátomos que reemplazan uno o más átomos de carbono del anillo.
Las lactonas se forman por esterificación intramolecular de los correspondientes ácidos hidroxicarboxílicos, que tiene lugar de forma espontánea cuando el anillo que se forma es de cinco o seis miembros. Las lactonas con anillos de tres o cuatro miembros (α-lactonas y β-lactonas) son muy reactivas, lo que dificulta su aislamiento. Normalmente se requieren métodos especiales para la síntesis en laboratorio de lactonas de anillos pequeños, así como de aquellas que contienen anillos de más de seis miembros.
Nomenclatura
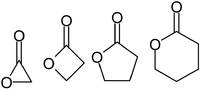
Las lactonas suelen denominarse según la molécula del ácido precursor (aceto = 2 átomos de carbono, propio = 3, butiro = 4, valero = 5, capro = 6, etc.), con un sufijo -lactona y un prefijo de letra griega que especifica el número de átomos de carbono en el heterociclo: es decir, la distancia entre los grupos -OH y -COOH relevantes a lo largo de dicho esqueleto. El primer átomo de carbono después del carbono en el grupo -COOH en el compuesto original se denomina α, el segundo se denominará β, y así sucesivamente. Por lo tanto, los prefijos también indican el tamaño del anillo de lactona: α-lactona = anillo de 3 miembros, β-lactona = 4 miembros, γ-lactona = 5 miembros, etc. Las lactonas macrocíclicas se conocen como macrolactonas.
El otro sufijo utilizado para denotar una lactona es -olida, que se utiliza en nombres de clases de sustancias como butenolida, macrólida, cardenolida o bufadienolida.
Para obtener los nombres preferidos de la IUPAC, las lactonas se nombran como pseudocetonas heterocíclicas agregando el sufijo "uno", "diona", "tiona", etc. y los prefijos multiplicativos apropiados al nombre del hidruro heterocíclico original.
Etimología
El nombre lactona deriva del anillo compuesto llamado lactida, que se forma a partir de la deshidratación del ácido 2-hidroxipropanoico (ácido láctico) CH3-CH(OH) -COOH. El ácido láctico, a su vez, deriva su nombre de su aislamiento original de la leche agria (latín: lac, lactis). El nombre fue acuñado en 1844 por el químico francés Théophile-Jules Pelouze, quien lo obtuvo por primera vez como un derivado del ácido láctico. Una reacción de deshidratación interna dentro de la misma molécula de ácido láctico habría producido alfa-propiolactona, una lactona con un anillo de 3 miembros.
En 1880, el químico alemán Wilhelm Rudolph Fittig amplió el nombre "lactona" a todos los ésteres carboxílicos intramoleculares.
Fuentes naturales
Las lactonas naturales son principalmente lactonas γ y δ saturadas e insaturadas y, en menor medida, lactonas macrocíclicas. Las γ- y δ-lactonas son ésteres intramoleculares de los correspondientes hidroxiácidos grasos. Contribuyen al aroma de frutas, mantequilla, queso y otros alimentos. La ciclopentadecanolida es responsable del olor a almizcle del aceite de raíz de angélica. De las lactonas bicíclicas naturales, las ftalidas son responsables de los olores de los aceites de apio y apio, y la cumarina de la aspérula. Las lactonas están presentes en la madera de roble y contribuyen al perfil de sabor de las cervezas añejadas en barrica.
Los anillos de lactona se encuentran ampliamente como bloques de construcción en la naturaleza, como en el ácido ascórbico, kavain, nepetalactona, gluconolactona, hormonas (espironolactona, mevalonolactona), enzimas (lactonasa), neurotransmisores (butirolactona, avermectinas), antibióticos (macrólidos como eritromicina; anfotericina B), fármacos contra el cáncer (vernolepina, epotilonas), fitoestrógenos (lactonas del ácido resorcílico, glucósidos cardíacos).
Síntesis

Muchos métodos en la síntesis de ésteres también se pueden aplicar a la de las lactonas. En una síntesis industrial de oxandrolona, el paso clave de formación de lactona es una reacción orgánica: la esterificación.

En la halolactonización, un alqueno es atacado por un halógeno a través de la adición electrofílica con el intermedio catiónico capturado intramolecularmente por un ácido carboxílico adyacente.
Los métodos específicos incluyen la esterificación de Yamaguchi, la macrolactonización de Shiina, la macrolactonización de Corey-Nicolaou, la oxidación de Baeyer-Villiger y la abstracción nucleófila.

Las γ-lactonas γ-octalactona, γ-nonalactona, γ-decalactona, γ-undecalactona se pueden preparar con buen rendimiento en un proceso de un solo paso mediante la adición de radicales de alcoholes grasos primarios al ácido acrílico, usando di-terc- peróxido de butilo como catalizador.
Reacciones
La estructura más estable para las lactonas son las γ-lactonas de 5 miembros y las δ-lactonas de 6 miembros porque, como en todos los ciclos orgánicos, los anillos de 5 y 6 miembros minimizan la tensión de los ángulos de enlace. Las γ-lactonas son tan estables que, en presencia de ácidos diluidos a temperatura ambiente, los 4-hidroxiácidos (R-CH(OH)-(CH2)2- COOH) sufren inmediatamente una esterificación espontánea y una ciclación a lactona. Las β-lactonas existen, pero solo pueden fabricarse mediante métodos especiales. Las α-lactonas se pueden detectar como especies transitorias en experimentos de espectrometría de masas.
Las reacciones de las lactonas son similares a las de los ésteres, como se ejemplifica con la gamma-lactona en las siguientes secciones:
Hidrólisis
Al calentar una lactona con una base (hidróxido de sodio), la lactona se hidrolizará a su compuesto principal, el compuesto bifuncional de cadena lineal. Al igual que los ésteres de cadena lineal, la reacción de hidrólisis-condensación de las lactonas es una reacción reversible, con equilibrio. Sin embargo, la constante de equilibrio de la reacción de hidrólisis de la lactona es menor que la del éster de cadena lineal, es decir, los productos (hidroxiácidos) son menos favorecidos en el caso de las lactonas. Esto se debe a que aunque las entalpías de la hidrólisis de ésteres y lactonas son casi iguales, la entropía de la hidrólisis de lactonas es menor que la entropía de los ésteres de cadena lineal. Los ésteres de cadena lineal dan dos productos tras la hidrólisis, lo que hace que el cambio de entropía sea más favorable que en el caso de las lactonas, que dan un solo producto.
Reducción
Las lactonas se pueden reducir a dioles usando hidruro de litio y aluminio en éter seco. La reacción de reducción romperá primero el enlace éster de la lactona y luego reducirá el grupo aldehído (-CHO) al grupo alcohol (-OH). Por ejemplo, las gamma-lactonas se reducirán a butano-1,4-diol, (CH2(OH)-(CH2)2-CH2(OH).
Aminólisis
Las lactonas también reaccionan con el amoníaco etanólico, que primero romperá el enlace éster y luego reaccionará con el grupo ácido -COOH, debido a las propiedades básicas del amoníaco, para formar un grupo difuncional, es decir, alcohol y amida. Las gamma-lactonas reaccionarán para producir CH2(OH)-(CH2)2-CO-NH2.
Polimerización
Las lactonas forman fácilmente poliésteres de acuerdo con la fórmula y se ha demostrado que también se oligomerizan sin catalizador:
Reacción de Michael
Las lactonas sesquiterpénicas, que se encuentran en muchas plantas, pueden reaccionar con otras moléculas a través de una reacción de Michael.
Usos
Sabores y fragancias
Las lactonas contribuyen significativamente al sabor de la fruta y de los productos lácteos sin fermentar y fermentados y, por lo tanto, se utilizan como sabores y fragancias. Algunos ejemplos son la γ-decalactona (4-decanolida), que tiene un sabor característico a melocotón; δ-decalactona (5-decanolida), que tiene un sabor cremoso a coco/melocotón; γ-dodecalactona (4-dodecanolida), que también tiene un sabor a coco/afrutado, descripción que también encaja con γ-octalactona (4-octanolida), aunque también tiene un carácter herbáceo; γ-nonalactona, que tiene un intenso sabor a coco de esta serie, a pesar de no estar presente en el coco, y γ-undecalactona.
Las lactonas macrocíclicas (ciclopentadecanolida, 15-pentadec-11/12-enolida) tienen olores similares a las cetonas macrocíclicas de origen animal (muscona, civetona), pero se pueden preparar más fácilmente, por ejemplo, por despolimerización de la cadena lineal correspondiente. poliésteres. El reemplazo de una unidad de metileno por oxígeno apenas afecta el olor de estos compuestos, y se producen oxalactonas con anillos de 15 a 17 miembros además de ciclopentadecanolida (p. ej., 12-oxa-16-hexadecanolida).
Química prebiótica
Se ha demostrado que las lactonas plausibles desde el punto de vista prebiótico, como la ε-caprolactona y la δ-valerolactona, se oligomerizan sin el uso de catalizadores que forman oligómeros que pueden haber sido relevantes durante el origen de la vida.
Plásticos
La policaprolactona es un plástico importante.
Ejemplos
- β-propiolactona
- γ-butyrolactone (GBL)
- D-glucono-δ-lactone (E575)
- ε-caprolactone
- Macrolides
- Kavalactones
Dilactonas
- Ácido ellagico (Dilactona de ácido hexahidroxidifenico)
- Dilactona de ácido Flavogallónico se puede encontrar en Rhynchosia volubilis semillas y en Shorea laeviforia
- Lactide
- Dilactona de ácido tergal se puede encontrar en Rhynchosia volubilis semillas
- La dilactona de ácido valónico puede ser aislada de la madera del corazón Shorea laeviforia
- Latón de etileno (Musk T), un almizcle sintético ampliamente utilizado
Referencias y notas
- ^ "lactones", Compendio de Terminología Química, 2.3.3, Unión Internacional de Química Pura y Aplicada, 2014-02-24, pág. 817
- ^ Francis A. Carey; Robert M. Giuliano (2011), Química Orgánica (8a ed.), McGraw-Hill, págs. 798 a 799
- ^ Steven A. Hardinger. "Glosario ilustrado de la química orgánica". Departamento de Química " Bioquímica, UCLA.
- ^ Nomenclatura de Química Orgánica: Recomendaciones de IUPAC y Nombres Preferidos 2013 (Libro Azul). Cambridge: The Royal Society of Chemistry. 2014. p. 822. doi:10.1039/9781849733069-00648. ISBN 978-0-85404-182-4.
- ^ Pelouze, J. (9 de diciembre de 1844). "Mémoire sur l'acide lactique" [Memoir on lactic acid]. Comptes rendus (en francés). 19: 1219–1227.De la p. 1223: "Indépendamment de la lactide dont je viens de rappeler l'existence dans les produits de la distllation de l'acide lactique, celui-ci donne encore, par sa décomposition, une autre substance, que je propose d'appeler lactona, parce qu'elle me paraît être à l'acide lactique ce que l'acétone est à l'acide acétique." (Independientemente de la lactida de la que acabo de recordar la existencia en los productos de la destilación del ácido láctico, esto [es decir, ácido láctico] da más, por su descomposición, otra sustancia que propongo llamar lactona, porque me parece ser a ácido láctico lo que acetona es a ácido acético.)
- Reimpresión: Pelouze, J. (1845). "Mémoire sur l'acide lactique" [Memoir on lactic acid]. Annales de Chimie et de Physique3a serie (en francés). 13: 257-268.; véase la página 262.
- Traducción en inglés: Pelouze, J. (15 de enero de 1845). "Investigaciones sobre ácido láctico". The Chemical Gazette. 3 (54): 29–35.; véase la página 31.
- Menten, Pierre de (2013). Dictionnaire de chimie: Une approche étymologique et historiqueDictionary of Chemistry: an etymological and historical approach] (en francés). Bruselas, Bélgica: de boeck. p. 183. ISBN 9782804181758.
- ^ Fittig, Rudolph (1880). "Untersuchungen über ungesättige Säuren, dritte Abhandlung" [Investigaciones en ácidos insaturados, tercer artículo]. Annalen der Chemie und Pharmacie (en alemán). 200: 1–96. doi:10.1002/jlac.18802000102. De la p. 62: "Es ist wünschenswerth, für diese Gruppe von Verbindungen, deren bis jetzt einfachster Repräsentant der im Vorstehenden beschriebene Körper ist, eine allŠgemeine Bezeichnχungsweise zu haben, und da der Name "Lactidze (Es deseable que este grupo de compuestos —cuyo representante más simple hasta ahora ha sido la sustancia que se describe en el precedente— tenga una designación general, y puesto que el nombre "lactida" no es aplicable porque entonces el lactido arquetípico no sería un lactido, por lo tanto sugerimos el nombre "lactone" como la designación de este grupo [de compuestos]).
- ^ a b c d Karl-Georg Fahlbusch; et al. (2007), "Flavors and Fragrances", Enciclopedia de Ullmann de Química Industrial (7a edición), Wiley, págs. 74 a 78
- ^ Cerveza artesanal y coser. Barrel-aging.
- ^ Desarrollo de un proceso comercial para producir oxandrolona John E. Cabaj, David Kairys, y Thomas R. Benson Org. Process Res. Dev.; 2007; 11 3) pp 378–388; (Article) doi:10.1021/op060231 b
- ^ La secuencia de reacción completa es la bromación a una haloketona (no mostrada), la reacción de eliminación con cloruro de litio a una oxidación orgánica sola por tetroxido de osmio y tetraaceta de plomo con anular y finalmente la reducción del aldehído al alcohol con formación de borohídrido sodio e intramolecular de lactona
- ^ Sintesis orgánicas, Coll. Vol. 7, p.164 (1990); Vol. 64, p.175 (1986) Artículo
- ^ Detlef Schröder, Norman Goldberg, Waltraud Zummack, Helmut Schwarz, John C. Poutsma y Robert R. Squires (1997), Generación de α-acetolactona y el acetoxil diradical •CH2COO• en la fase de gas. International Journal of Mass Spectrometry and Ion Processes, Volumes 165-166, November issue, Pages 71-82. doi:10.1016/S0168-1176(97)00150-X
- ^ Wilhelm Riemenschneider; Hermann M. Bolt (2007), "Esters, Organic", Enciclopedia de Ullmann de Química Industrial (7th ed.), Wiley
- ^ Chandru, Kuhan; Jia, Tony Z.; Mamajanov, Irena; Bapat, Niraja; Cleaves, H. James (2020-10-16). "Oligomerización prebiótica y autoasamblema de monómeros xenobiológicos estructuralmente diversos". Scientific Reports. 10 (1): 17560. Código:2020 NatSR..1017560C. doi:10.1038/s41598-020-74223-5. ISSN 2045-2322.7567815. PMID 33067516.
- ^ a b c d Berger, R.G., ed. (2007). Flavours y fragancias química, bioprocesamiento y sostenibilidad. Berlín: Springer. ISBN 9783540493396. Retrieved 2 de julio 2015.
- ^ Mehta, Bhavbhuti M.; Kamal-Eldin, Afaf; Iwanski, Robert Z., eds. (2012). Efectos de fermentación en propiedades alimentarias. Boca Raton: Taylor & Francis. p. 74. ISBN 9781439853351. Retrieved 2 de julio 2015.
- ^ Marsili, Ray, ed. (2007). Análisis de sabor orientado a sensores. Boca Raton, FL: CRC/Taylor ' Francis. p. 242. ISBN 9781420017045. Retrieved 2 de julio 2015.
- ^ Chandru, Kuhan; Mamanov, Irena; Cleaves, H. James; Jia, Tony Z. (enero 2020). "Polyesters como un sistema modelo para construir biologías primitivas de la química prebiótica no biológica". Vida. 10 (1): 6. Bibcode:2020Life...10....6C. doi:10.3390/life10010006. PMC7175156. PMID 31963928.
Contenido relacionado
Termoplástico
Warfarina
Guerras de transferencia