La enfermedad de Chagas
La enfermedad de Chagas, también conocida como tripanosomiasis americana, es una enfermedad parasitaria tropical causada por Trypanosoma cruzi. Se transmite principalmente por insectos de la subfamilia Triatominae, conocidos como "kissins". Los síntomas cambian a lo largo de la infección. En la etapa inicial, los síntomas generalmente no están presentes o son leves y pueden incluir fiebre, ganglios linfáticos inflamados, dolores de cabeza o hinchazón en el sitio de la picadura. Después de cuatro a ocho semanas, las personas que no reciben tratamiento entran en la fase crónica de la enfermedad, que en la mayoría de los casos no produce más síntomas. Hasta el 45% de las personas con infecciones crónicas desarrollan una enfermedad cardíaca entre 10 y 30 años después de la enfermedad inicial, lo que puede provocar insuficiencia cardíaca. Las complicaciones digestivas, incluido un esófago agrandado o un colon agrandado, también pueden ocurrir en hasta el 21 % de las personas, y hasta el 10 % de las personas pueden experimentar daño en los nervios.
T. cruzi se transmite comúnmente a los humanos y otros mamíferos por la picadura de una chinche. La enfermedad también se puede propagar a través de transfusión de sangre, trasplante de órganos, consumo de alimentos o bebidas contaminados con los parásitos y transmisión vertical (de una madre a su bebé). El diagnóstico de la enfermedad temprana se realiza encontrando el parásito en la sangre con un microscopio o detectando su ADN mediante la reacción en cadena de la polimerasa. La enfermedad crónica se diagnostica al encontrar anticuerpos para T. cruzi en la sangre.
La prevención se centra en eliminar las chinches y evitar sus picaduras. Esto puede implicar el uso de insecticidas o mosquiteros. Otros esfuerzos preventivos incluyen la detección de sangre utilizada para transfusiones. Las infecciones tempranas se pueden tratar con los medicamentos benznidazol o nifurtimox, que generalmente curan la enfermedad si se administran poco después de que la persona se infecta, pero se vuelven menos efectivos cuanto más tiempo la persona ha tenido la enfermedad de Chagas. Cuando se usa en enfermedades crónicas, la medicación puede retrasar o prevenir el desarrollo de síntomas en etapa terminal. El benznidazol y el nifurtimox a menudo causan efectos secundarios, que incluyen trastornos de la piel, irritación del sistema digestivo y síntomas neurológicos, que pueden provocar la interrupción del tratamiento. A partir de 2019, se están desarrollando nuevos medicamentos para la enfermedad de Chagas y se han estudiado vacunas experimentales en modelos animales. A partir de 2022, no se ha desarrollado una vacuna humana.
Se estima que 6.5 millones de personas, principalmente en México, América Central y América del Sur, tienen la enfermedad de Chagas a partir de 2019, lo que resulta en aproximadamente 9490 muertes anuales. La mayoría de las personas con la enfermedad son pobres y no se dan cuenta de que están infectadas. Las migraciones de población a gran escala han llevado la enfermedad de Chagas a nuevas regiones, que incluyen los Estados Unidos y muchos países europeos. La enfermedad afecta a más de 150 tipos de animales.
La enfermedad fue descrita por primera vez en 1909 por el médico brasileño Carlos Chagas, de quien toma su nombre. La enfermedad de Chagas se clasifica como una enfermedad tropical desatendida.
Signos y síntomas
La enfermedad de Chagas se presenta en dos etapas: una etapa aguda, que se desarrolla una o dos semanas después de la picadura del insecto, y una etapa crónica, que se desarrolla durante muchos años. La etapa aguda a menudo no presenta síntomas. Cuando están presentes, los síntomas suelen ser menores y no específicos de ninguna enfermedad en particular. Los signos y síntomas incluyen fiebre, malestar general, dolor de cabeza y agrandamiento del hígado, el bazo y los ganglios linfáticos. A veces, las personas desarrollan un nódulo inflamado en el sitio de la infección, que se denomina "signo de Romaña" si es en el párpado, o un "chagoma" si está en otra parte de la piel. En casos raros (menos del 1% al 5%), las personas infectadas desarrollan una enfermedad aguda grave, que puede implicar inflamación del músculo cardíaco, acumulación de líquido alrededor del corazón e inflamación del cerebro y los tejidos circundantes, y puede poner en peligro la vida. La fase aguda suele durar de cuatro a ocho semanas y se resuelve sin tratamiento.
A menos que se traten con medicamentos antiparasitarios, las personas permanecen infectadas con T. cruzi después de recuperarse de la fase aguda. La mayoría de las infecciones crónicas son asintomáticas, lo que se conoce como enfermedad de Chagas crónica indeterminada. Sin embargo, durante décadas con la enfermedad, aproximadamente el 30-40% de las personas desarrollan disfunción orgánica (enfermedad de Chagas crónica determinada), que afecta con mayor frecuencia al corazón o al sistema digestivo.
La manifestación a largo plazo más común es la enfermedad cardíaca, que ocurre en el 14-45 % de las personas con enfermedad de Chagas crónica. Las personas con enfermedad cardíaca de Chagas a menudo experimentan palpitaciones cardíacas y, a veces, desmayos, debido a la función cardíaca irregular. Por electrocardiograma, las personas con cardiopatía chagásica presentan con mayor frecuencia arritmias. A medida que avanza la enfermedad, los ventrículos del corazón se agrandan (miocardiopatía dilatada), lo que reduce su capacidad para bombear sangre. En muchos casos, el primer signo de la cardiopatía chagásica es insuficiencia cardíaca, tromboembolismo o dolor torácico asociado con anomalías en la microvasculatura.
También es común en la enfermedad de Chagas crónica el daño al sistema digestivo, que afecta al 10-21 % de las personas. La ampliación del esófago o del colon son los problemas digestivos más comunes. Las personas con esófago agrandado a menudo experimentan dolor (odinofagia) o dificultad para tragar (disfagia), reflujo ácido, tos y pérdida de peso. Las personas con colon agrandado a menudo experimentan estreñimiento y pueden desarrollar una obstrucción grave del intestino o de su suministro de sangre. Hasta el 10% de las personas con infección crónica desarrollan daño en los nervios que puede provocar entumecimiento y reflejos o movimientos alterados. Si bien la enfermedad crónica generalmente se desarrolla durante décadas, algunas personas con enfermedad de Chagas (menos del 10%) progresan al daño cardíaco directamente después de la enfermedad aguda.
Los signos y síntomas difieren para las personas infectadas con T. cruzi a través de rutas menos comunes. Las personas infectadas por la ingestión de parásitos tienden a desarrollar una enfermedad grave dentro de las tres semanas posteriores al consumo, con síntomas que incluyen fiebre, vómitos, dificultad para respirar, tos y dolor en el pecho, el abdomen y los músculos. Las personas infectadas congénitamente suelen tener pocos o ningún síntoma, pero pueden tener síntomas leves no específicos o síntomas graves como ictericia, dificultad respiratoria y problemas cardíacos. Las personas infectadas a través de trasplantes de órganos o transfusiones de sangre tienden a tener síntomas similares a los de las enfermedades transmitidas por vectores, pero es posible que los síntomas no se manifiesten durante un período de una semana a cinco meses. Las personas con infección crónica que se vuelven inmunodeprimidas debido a la infección por VIH pueden tener una enfermedad particularmente grave y distinta, caracterizada más comúnmente por inflamación en el cerebro y el tejido circundante o abscesos cerebrales. Los síntomas varían ampliamente según el tamaño y la ubicación de los abscesos cerebrales, pero generalmente incluyen fiebre, dolores de cabeza, convulsiones, pérdida de sensibilidad u otros problemas neurológicos que indican sitios particulares de daño en el sistema nervioso. Ocasionalmente, estas personas también experimentan inflamación cardíaca aguda, lesiones en la piel y enfermedades del estómago, intestino o peritoneo.
Causa
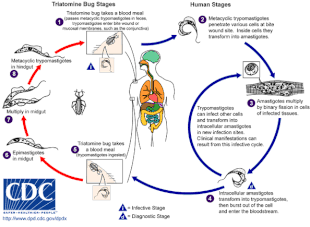
La enfermedad de Chagas es causada por una infección con el parásito protozoario T. cruzi, que generalmente se introduce en los humanos a través de la picadura de insectos triatominos, también llamados "kissing bugs". Cuando el insecto defeca en el sitio de la picadura, T. cruzi llamadas tripomastigotes ingresan al torrente sanguíneo e invaden varias células huésped. Dentro de una célula huésped, el parásito se transforma en una forma replicativa llamada amastigote, que se somete a varias rondas de replicación. Los amastigotes replicados se transforman nuevamente en tripomastigotes, que revientan la célula huésped y se liberan al torrente sanguíneo. Los tripomastigotes luego se diseminan por todo el cuerpo a varios tejidos, donde invaden las células y se replican. Durante muchos años, los ciclos de replicación del parásito y la respuesta inmunitaria pueden dañar gravemente estos tejidos, en particular el corazón y el tubo digestivo.
Transmisión
T. cruzi puede ser transmitida por varios insectos triatominos de los géneros Triatoma, Panstrongylus y Rhodnius. Los principales vectores de la infección humana son las especies de insectos triatominos que habitan en las viviendas humanas, a saber, Triatoma infestans, Rhodnius prolixus, Triatoma dimidiata y Panstrongylus megistus. Estos insectos son conocidos por varios nombres locales, incluyendo vinchuca en Argentina, Bolivia, Chile y Paraguay, barbeiro (el barbero) en Brasil, pito en Colombia, chinche en Centroamérica y chipo en Venezuela. Los insectos tienden a alimentarse por la noche, prefiriendo superficies húmedas cerca de los ojos o la boca. Un insecto triatomino puede infectarse con T. cruzi cuando se alimenta de un huésped infectado. T. cruzi se replica en el tracto intestinal del insecto y se elimina en las heces del insecto. Cuando un triatomino infectado se alimenta, perfora la piel y ingiere sangre, defecando al mismo tiempo para dejar espacio para la nueva comida. La picadura suele ser indolora, pero causa picazón. Rascarse la picadura introduce la T. cruzi- cargadas de heces en la herida de la mordedura, iniciando la infección.
Además de la propagación clásica por vectores, la enfermedad de Chagas puede transmitirse a través del consumo de alimentos o bebidas contaminados con insectos triatominos o sus heces. Dado que el calentamiento o el secado matan los parásitos, las bebidas y especialmente los jugos de frutas son la fuente de infección más frecuente. Esta vía oral de transmisión ha estado implicada en varios brotes, en los que provocó síntomas inusualmente graves, probablemente debido a una infección con una mayor carga de parásitos que a la picadura de un insecto triatomino.
T. cruzi puede transmitirse independientemente del insecto triatomino durante una transfusión de sangre, después de un trasplante de órganos oa través de la placenta durante el embarazo. La transfusión con la sangre de un donante infectado infecta al receptor en 10 a 25% de las veces. Para evitar esto, las donaciones de sangre se analizan para T. cruzi en muchos países con enfermedad de Chagas endémica, así como en los Estados Unidos. De manera similar, el trasplante de órganos sólidos de un donante infectado puede transmitir T. cruzi al destinatario. Esto es especialmente cierto para el trasplante de corazón, que transmite T. cruzi 75-100% de las veces, y menos para el trasplante de hígado (0-29%) o riñón (0-19%). Una madre infectada puede transmitir T. cruzi a su hijo a través de la placenta; esto ocurre hasta en un 15% de los nacimientos de madres infectadas. A partir de 2019, el 22,5% de las nuevas infecciones ocurrieron por transmisión congénita.
Fisiopatología
En la fase aguda de la enfermedad, los signos y síntomas son causados directamente por la replicación de T. cruzi y la respuesta del sistema inmunitario. Durante esta fase, T. cruzi se puede encontrar en varios tejidos en todo el cuerpo y circulando en la sangre. Durante las semanas iniciales de la infección, la replicación del parásito se controla mediante la producción de anticuerpos y la activación de la respuesta inflamatoria del huésped, en particular las células que se dirigen a los patógenos intracelulares, como las células NK y los macrófagos, impulsadas por moléculas de señalización de la inflamación como el TNF. -α e IFN-γ.
Durante la enfermedad de Chagas crónica, se desarrolla daño a largo plazo en los órganos a lo largo de los años debido a la replicación continua del parásito y al daño del sistema inmunitario. Temprano en el curso de la enfermedad, T. cruzi se encuentra con frecuencia en las fibras musculares estriadas del corazón. A medida que avanza la enfermedad, el corazón generalmente se agranda, con regiones sustanciales de fibra muscular cardíaca reemplazadas por tejido cicatricial y grasa. Las áreas de inflamación activa están dispersas por todo el corazón y cada una alberga células inmunitarias inflamatorias, típicamente macrófagos y células T. Al final de la enfermedad, los parásitos rara vez se detectan en el corazón y pueden estar presentes solo en niveles muy bajos.
En el corazón, el colon y el esófago, la enfermedad crónica conduce a una pérdida masiva de terminaciones nerviosas. En el corazón, esto puede contribuir a las arritmias y otras disfunciones cardíacas. En el colon y el esófago, la pérdida del control del sistema nervioso es el principal impulsor de la disfunción orgánica. La pérdida de nervios afecta el movimiento de los alimentos a través del tracto digestivo, lo que puede provocar el bloqueo del esófago o el colon y la restricción del suministro de sangre.
Diagnóstico
La presencia de T. cruzi en la sangre es diagnóstico de la enfermedad de Chagas. Durante la fase aguda de la infección, puede detectarse por examen microscópico de sangre fresca anticoagulada, o su capa leucocitaria, en busca de parásitos móviles; o por preparación de frotis de sangre finos y gruesos teñidos con Giemsa, para la visualización directa de parásitos. El examen de frotis de sangre detecta parásitos en 34 a 85% de los casos. La sensibilidad aumenta si se utilizan técnicas como la centrifugación de microhematocrito para concentrar la sangre. En el examen microscópico de frotis de sangre teñidos, T. cruzi los tripomastigotes aparecen como organismos en forma de S o U con un flagelo conectado al cuerpo por una membrana ondulante. Un núcleo y una estructura más pequeña llamada cinetoplasto son visibles dentro del cuerpo del parásito; el cinetoplasto de T. cruzi es relativamente grande, lo que ayuda a distinguirlo de otras especies de tripanosomas que infectan a los humanos.
Alternativamente, T. cruzi El ADN puede detectarse mediante la reacción en cadena de la polimerasa (PCR). En la enfermedad de Chagas aguda y congénita, la PCR es más sensible que la microscopía y es más confiable que las pruebas basadas en anticuerpos para el diagnóstico de la enfermedad congénita porque no se ve afectada por la transferencia de anticuerpos contra T. cruzi de una madre a su bebé (inmunidad pasiva). PCR también se usa para monitorear T. cruzi en receptores de trasplantes de órganos y personas inmunodeprimidas, lo que permite detectar la infección o la reactivación en un estadio temprano.
En la enfermedad de Chagas crónica, la concentración de parásitos en la sangre es demasiado baja para ser detectada de manera confiable por microscopía o PCR, por lo que el diagnóstico generalmente se realiza mediante pruebas serológicas, que detectan anticuerpos de inmunoglobulina G contra <span class="nowrap" T. cruzi en la sangre. Se requieren dos resultados serológicos positivos, utilizando diferentes métodos de prueba, para confirmar el diagnóstico. Si los resultados de la prueba no son concluyentes, se pueden usar métodos de prueba adicionales, como Western blot.
Hay disponibles varias pruebas de diagnóstico rápido para la enfermedad de Chagas. Estas pruebas son fáciles de transportar y pueden ser realizadas por personas sin capacitación especial. Son útiles para evaluar a un gran número de personas y evaluar a las personas que no pueden acceder a los centros de atención médica, pero su sensibilidad es relativamente baja y se recomienda usar un segundo método para confirmar un resultado positivo.
T. cruzi se pueden cultivar a partir de muestras de sangre mediante hemocultivo, xenodiagnóstico o mediante la inoculación de animales con la sangre de la persona. En el método de hemocultivo, los glóbulos rojos de la persona se separan del plasma y se agregan a un medio de crecimiento especializado para estimular la multiplicación del parásito. Puede tomar hasta seis meses para obtener el resultado. El xenodiagnóstico consiste en alimentar con sangre a los insectos triatominos y luego examinar sus heces en busca del parásito entre 30 y 60 días después. Estos métodos no se utilizan de forma rutinaria, ya que son lentos y tienen poca sensibilidad.
Prevención
Los esfuerzos para prevenir la enfermedad de Chagas se han centrado en gran medida en el control de vectores para limitar la exposición a los insectos triatominos. Los programas de rociado de insecticidas han sido el pilar del control de vectores, consistentes en rociar las casas y las áreas circundantes con insecticidas residuales. Esto se hizo originalmente con insecticidas organoclorados, organofosforados y carbamatos, que fueron reemplazados en la década de 1980 con piretroides. Estos programas han reducido drásticamente la transmisión en Brasil y Chile, y han eliminado los principales vectores de ciertas regiones: Triatoma infestans de Brasil, Chile, Uruguay y partes de Perú y Paraguay, así como Rhodnius prolixus de América Central. El control de vectores en algunas regiones se ha visto obstaculizado por el desarrollo de resistencia a los insecticidas entre los insectos triatominos. En respuesta, los programas de control de vectores han implementado insecticidas alternativos (por ejemplo, fenitrotión y bendiocarb en Argentina y Bolivia), el tratamiento de animales domésticos (que también se alimentan de insectos triatominos) con pesticidas, pinturas impregnadas de pesticidas y otros enfoques experimentales. En áreas con chinches triatominos, la transmisión de T. cruzi se puede prevenir durmiendo debajo de los mosquiteros y mejorando las viviendas para evitar que los triatominos colonicen las casas.
Anteriormente, la transfusión de sangre era el segundo modo de transmisión más común de la enfermedad de Chagas. T. cruzi puede sobrevivir en sangre almacenada refrigerada, y puede sobrevivir a la congelación y descongelación, lo que le permite persistir en sangre completa, glóbulos rojos concentrados, granulocitos, crioprecipitados y plaquetas. El desarrollo y la implementación de pruebas de detección en bancos de sangre ha reducido drásticamente el riesgo de infección durante la transfusión de sangre. Casi todas las donaciones de sangre en los países de América Latina se someten a pruebas de detección de Chagas. La detección generalizada también es común en países no endémicos con poblaciones significativas de inmigrantes de áreas endémicas, incluido el Reino Unido (implementado en 1999), España (2005), Estados Unidos (2007), Francia y Suecia (2009), Suiza (2012) y Bélgica (2013). Las pruebas serológicas, típicamente ELISA, se utilizan para detectar anticuerpos contra T. cruziproteínas en sangre de donante.
Otros modos de transmisión han sido el objetivo de los programas de prevención de la enfermedad de Chagas. El tratamiento de T. cruzi-infectadas durante el embarazo reduce el riesgo de transmisión congénita de la infección. Con este fin, muchos países de América Latina han implementado exámenes de detección de T. cruzi, y la Organización Mundial de la Salud recomienda examinar a todos los niños nacidos de madres infectadas para evitar que la infección congénita se convierta en una enfermedad crónica. De manera similar a las transfusiones de sangre, muchos países con enfermedad de Chagas endémica examinan órganos para trasplante con pruebas serológicas.
No existe una vacuna contra la enfermedad de Chagas. Se han probado varias vacunas experimentales en animales infectados con T. cruzi y fueron capaces de reducir la cantidad de parásitos en la sangre y el corazón, pero ninguna vacuna candidata se había sometido a ensayos clínicos en humanos hasta 2016.
Administración
La enfermedad de Chagas se maneja con medicamentos antiparasitarios para eliminar T. cruzi del cuerpo y tratamiento sintomático para abordar los efectos de la infección. A partir de 2018, el benznidazol y el nifurtimox fueron los medicamentos antiparasitarios de elección para tratar la enfermedad de Chagas, aunque el benznidazol es el único medicamento disponible en la mayor parte de América Latina. Para cualquiera de los medicamentos, el tratamiento generalmente consiste en dos o tres dosis orales por día durante 60 a 90 días. El tratamiento antiparasitario es más eficaz en las primeras etapas de la infección: elimina T. cruzi del 50 al 80 % de las personas en la fase aguda, pero solo del 20 al 60 % de las que se encuentran en la fase crónica. El tratamiento de las enfermedades crónicas es más eficaz en niños que en adultos, y la tasa de curación de las enfermedades congénitas se aproxima al 100% si se tratan durante el primer año de vida. El tratamiento antiparasitario también puede retrasar la progresión de la enfermedad y reducir la posibilidad de transmisión congénita. Eliminación de T. cruzi no cura el daño cardíaco y gastrointestinal causado por la enfermedad de Chagas crónica, por lo que estas condiciones deben tratarse por separado. No se recomienda el tratamiento antiparasitario en personas que ya hayan desarrollado una miocardiopatía dilatada.
El benznidazol generalmente se considera el tratamiento de primera línea porque tiene efectos adversos más leves que el nifurtimox y su eficacia se comprende mejor. Tanto el benznidazol como el nifurtimox tienen efectos secundarios comunes que pueden dar lugar a la suspensión del tratamiento. Los efectos secundarios más comunes del benznidazol son erupción cutánea, problemas digestivos, disminución del apetito, debilidad, dolor de cabeza y problemas para dormir. Estos efectos secundarios a veces se pueden tratar con antihistamínicos o corticosteroides, y generalmente se revierten cuando se interrumpe el tratamiento. Sin embargo, el benzidazol se suspende hasta en el 29% de los casos. Nifurtimox tiene efectos secundarios más frecuentes y afecta hasta al 97,5% de las personas que toman el medicamento. Los efectos secundarios más comunes son pérdida de apetito, pérdida de peso, náuseas y vómitos, y varios trastornos neurológicos que incluyen cambios de humor, insomnio, parestesia y neuropatía periférica. El tratamiento se suspende hasta en el 75% de los casos. Ambos medicamentos están contraindicados para su uso en mujeres embarazadas y personas con insuficiencia hepática o renal. A partir de 2019, se ha informado resistencia a estos medicamentos.
Complicaciones
En la etapa crónica, el tratamiento consiste en manejar las manifestaciones clínicas de la enfermedad. El tratamiento de la miocardiopatía chagásica es similar al de otras formas de enfermedad cardíaca. Se pueden recetar bloqueadores beta e inhibidores de la ECA, pero es posible que algunas personas con la enfermedad de Chagas no puedan tomar la dosis estándar de estos medicamentos porque tienen presión arterial baja o frecuencia cardíaca baja. Para controlar los latidos cardíacos irregulares, a las personas se les pueden recetar medicamentos antiarrítmicos, como amiodarona, o se les puede implantar un marcapasos. Se pueden usar anticoagulantes para prevenir la tromboembolia y el accidente cerebrovascular. La enfermedad cardíaca crónica causada por Chagas es una razón común para la cirugía de trasplante de corazón. Debido a que los receptores de trasplantes toman medicamentos inmunosupresores para prevenir el rechazo de órganos, se los controla mediante PCR para detectar la reactivación de la enfermedad. Las personas con enfermedad de Chagas que se someten a un trasplante de corazón tienen tasas de supervivencia más altas que el receptor de trasplante de corazón promedio.
La enfermedad gastrointestinal leve se puede tratar sintomáticamente, como usar laxantes para el estreñimiento o tomar un fármaco procinético como metoclopramida antes de las comidas para aliviar los síntomas esofágicos. La cirugía para cortar los músculos del esfínter esofágico inferior (cardiomiotomía) se puede realizar en casos más graves de enfermedad esofágica, y se puede requerir la extirpación quirúrgica de la parte afectada del órgano para megacolon y megaesófago avanzados.
Epidemiología


En 2019, aproximadamente 6,5 millones de personas en todo el mundo tenían la enfermedad de Chagas, con aproximadamente 173 000 nuevas infecciones y 9490 muertes cada año. La enfermedad generó una carga económica mundial anual estimada en 7200 millones de USD en 2013, el 86 % de la cual la soportan los países endémicos. La enfermedad de Chagas provoca la pérdida de más de 800.000 años de vida ajustados por discapacidad cada año.
El área endémica de la enfermedad de Chagas se extiende desde el sur de los Estados Unidos hasta el norte de Chile y Argentina, con Bolivia (6,1 %), Argentina (3,6 %) y Paraguay (2,1 %) con la mayor prevalencia de la enfermedad. Dentro de América Latina continental, la enfermedad de Chagas es endémica en 21 países: Argentina, Belice, Bolivia, Brasil, Chile, Colombia, Costa Rica, Ecuador, El Salvador, Guayana Francesa, Guatemala, Guayana, Honduras, México, Nicaragua, Panamá, Paraguay, Perú, Surinam, Uruguay y Venezuela. En áreas endémicas, debido en gran parte a los esfuerzos de control de vectores y la detección de donaciones de sangre, las infecciones y muertes anuales han disminuido en un 67 % y más de un 73 % respectivamente desde sus picos en la década de 1980 hasta 2010. La transmisión por insectos vectores y la transfusión de sangre se ha reducido por completo. interrumpida en Uruguay (1997), Chile (1999) y Brasil (2006), y en Argentina, la transmisión vectorial había sido interrumpida en 13 de las 19 provincias endémicas hasta 2001. Durante la crisis humanitaria de Venezuela, la transmisión vectorial ha ha comenzado a ocurrir en áreas donde anteriormente se había interrumpido, y las tasas de seroprevalencia de la enfermedad de Chagas han aumentado. Las tasas de transmisión también han aumentado en la región del Gran Chaco debido a la resistencia a los insecticidas y en la cuenca del Amazonas debido a la transmisión oral.
Si bien la tasa de la enfermedad de Chagas transmitida por vectores ha disminuido en la mayor parte de América Latina, la tasa de enfermedades de transmisión oral ha aumentado, posiblemente debido al aumento de la urbanización y la deforestación, que acerca a las personas a los triatominos y altera la distribución de las especies de triatominos.. La enfermedad de Chagas de transmisión oral es motivo de especial preocupación en Venezuela, donde se han registrado 16 brotes entre 2007 y 2018.
Chagas existe en dos zonas ecológicas diferentes: en la región del Cono Sur, el vector principal vive dentro y alrededor de los hogares humanos. En Centroamérica y México, la principal especie vectora vive tanto en el interior de las viviendas como en áreas deshabitadas. En ambas zonas, Chagas ocurre casi exclusivamente en áreas rurales, donde T. cruzi también circula en animales salvajes y domésticos. T. cruzi comúnmente infecta a más de 100 especies de mamíferos en América Latina, incluidas las zarigüeyas (Didelphis spp.), armadillos, titíes, murciélagos, varios roedores y perros, todos los cuales pueden ser infectados por los vectores o por vía oral al comer insectos triatominos y otros animales infectados. Para los animales entomófagos, este es un modo común. Didelphis spp. son únicos en el sentido de que no requieren triatominos para la transmisión, completando el ciclo de vida a través de su propia orina y heces. La transmisión veterinaria también ocurre por transmisión vertical a través de la placenta, transfusión de sangre y trasplantes de órganos.
Países no endémicos
Aunque Chagas se considera tradicionalmente una enfermedad de las zonas rurales de América Latina, la migración internacional ha dispersado a las personas con la enfermedad a numerosos países no endémicos, principalmente en América del Norte y Europa. A partir de 2020, aproximadamente 300 000 personas infectadas viven en los Estados Unidos, y en 2018 se estimó que entre 30 000 y 40 000 estadounidenses tenían cardiomiopatía de Chagas. La gran mayoría de los casos en los Estados Unidos ocurren en inmigrantes de América Latina, pero la transmisión local es posible. Once especies de triatominos son nativas de los Estados Unidos, y algunos estados del sur tienen ciclos persistentes de transmisión de enfermedades entre insectos vectores y reservorios animales, que incluyen ratas de bosque, zarigüeyas, mapaches, armadillos y zorrillos. Sin embargo, la infección adquirida localmente es muy rara: solo se documentaron 28 casos entre 1955 y 2015. A partir de 2013, el costo del tratamiento en los Estados Unidos se estimó en US $ 900 millones anuales (costo global $ 7 mil millones), que incluye hospitalización y Dispositivos médicos como marcapasos.
La enfermedad de Chagas afecta aproximadamente a entre 68 000 y 123 000 personas en Europa a partir de 2019. España, que tiene una alta tasa de inmigración de América Latina, tiene la prevalencia más alta de la enfermedad. Se estima que entre 50.000 y 70.000 españoles viven con la enfermedad de Chagas, lo que representa la mayoría de los casos europeos. La prevalencia varía ampliamente dentro de los países europeos debido a los diferentes patrones de inmigración. Italia tiene la segunda prevalencia más alta, seguida de los Países Bajos, el Reino Unido y Alemania.
Historia
T. cruzi probablemente circulaba entre los mamíferos sudamericanos mucho antes de la llegada de los humanos al continente. T. cruzi se ha detectado en restos humanos antiguos en América del Sur, desde una momia Chinchorro de 9000 años de antigüedad en el desierto de Atacama, hasta restos de varias edades en Minas Gerais, hasta un 1100 años de antigüedad. momia tan al norte como el Desierto de Chihuahua, cerca del Río Grande. Muchos relatos escritos tempranos describen síntomas consistentes con la enfermedad de Chagas, con descripciones tempranas de la enfermedad a veces atribuidas a Miguel Díaz Pimenta (1707), Luís Gomes Ferreira (1735) y Theodoro J. H. Langgaard (1842).
La descripción formal de la enfermedad de Chagas fue realizada por Carlos Chagas en 1909 después de examinar a una niña de dos años con fiebre, ganglios linfáticos inflamados y agrandamiento del bazo y el hígado. Al examinar su sangre, Chagas vio tripanosomas idénticos a los que había identificado recientemente en el intestino posterior de insectos triatominos y los llamó Trypanosoma cruzi en honor a su mentor, el médico brasileño Oswaldo Cruz. Envió triatominos infectados a Cruz en Río de Janeiro, quien demostró que la picadura del triatomino infectado podía transmitir T. cruzi a los monos tití también. En solo dos años, 1908 y 1909, Chagas publicó descripciones de la enfermedad, el organismo que la causaba y el insecto vector requerido para la infección. Casi inmediatamente después, por sugerencia de Miguel Couto, entonces profesor de la Faculdade de Medicina do Rio de Janeiro, la enfermedad se conocía ampliamente como "enfermedad de Chagas". Chagas' El descubrimiento le dio renombre nacional e internacional, pero al destacar las insuficiencias de la respuesta del gobierno brasileño a la enfermedad, Chagas atrajo críticas hacia sí mismo y hacia la enfermedad que lleva su nombre, sofocando la investigación sobre su descubrimiento y probablemente frustrando su nominación. para el Premio Nobel en 1921.
En la década de 1930, Salvador Mazza reavivó la investigación sobre la enfermedad de Chagas y describió más de mil casos en la provincia argentina del Chaco. En Argentina, la enfermedad se conoce como mal de Chagas-Mazza en su honor. Las pruebas serológicas para la enfermedad de Chagas se introdujeron en la década de 1940, demostrando que la infección con T. cruzi estaba muy extendida en América Latina. Esto, combinado con los éxitos en la eliminación del vector de la malaria mediante el uso de insecticidas, impulsó la creación de campañas de salud pública enfocadas en tratar las casas con insecticidas para erradicar los insectos triatominos. La década de 1950 vio el descubrimiento de que el tratamiento de la sangre con cristal violeta podía erradicar el parásito, lo que llevó a su uso generalizado en los programas de detección de transfusiones en América Latina. Los programas de control a gran escala comenzaron a tomar forma en la década de 1960, primero en São Paulo, luego en varios lugares de Argentina y luego en programas a nivel nacional en toda América Latina. Estos programas recibieron un gran impulso en la década de 1980 con la introducción de insecticidas piretroides, que no dejaban manchas ni olores después de la aplicación y eran más duraderos y rentables. Los organismos regionales dedicados al control de la enfermedad de Chagas surgieron con el apoyo de la Organización Panamericana de la Salud, con el lanzamiento de la Iniciativa del Cono Sur para la Eliminación de la Enfermedad de Chagas en 1991, seguida de la Iniciativa de los países andinos (1997), Iniciativa de la países de América (1997), y la Iniciativa de los países amazónicos (2004).
Investigación
Tratamientos
Fexinidazol, un fármaco antiparasitario aprobado para el tratamiento de la tripanosomiasis africana, ha mostrado actividad contra la enfermedad de Chagas en modelos animales. A partir de 2019, se encuentra en ensayos clínicos de fase II para la enfermedad de Chagas crónica en España. Otros candidatos a fármacos incluyen GNF6702, un inhibidor del proteosoma que es efectivo contra la enfermedad de Chagas en ratones y está siendo sometido a estudios preliminares de toxicidad, y AN4169, que ha tenido resultados prometedores en modelos animales.
Se han probado varias vacunas experimentales en animales. Además de las vacunas de subunidades, algunos enfoques han implicado la vacunación con T atenuada. cruzi parásitos u organismos que expresan algunos de los mismos antígenos que T. cruzi pero no causan enfermedades humanas, como Trypanosoma rangeli o Phytomonas serpens. También se ha explorado la vacunación con ADN. A partir de 2019, la investigación de vacunas se ha limitado principalmente a modelos de animales pequeños.
Pruebas de diagnóstico
A partir de 2018, las pruebas de diagnóstico estándar para la enfermedad de Chagas tenían una capacidad limitada para medir la eficacia del tratamiento antiparasitario, ya que las pruebas serológicas pueden seguir siendo positivas durante años después de T. cruzi se elimina del cuerpo y la PCR puede dar resultados falsos negativos cuando la concentración del parásito en la sangre es baja. Se están investigando varios biomarcadores potenciales de respuesta al tratamiento, como inmunoensayos contra T. cruzi antígenos, pruebas de citometría de flujo para detectar anticuerpos contra diferentes etapas de la vida de T. cruzi, y marcadores de cambios fisiológicos provocados por el parásito, como alteraciones en la coagulación y el metabolismo de los lípidos.
Otra área de investigación es el uso de biomarcadores para predecir la progresión de enfermedades crónicas. Los niveles séricos del factor de necrosis tumoral alfa, el péptido natriurético auricular y cerebral y la enzima convertidora de angiotensina 2 se han estudiado como indicadores del pronóstico de la miocardiopatía chagásica.
T. cruzi, el antígeno de fase aguda (SAPA, por sus siglas en inglés), que puede detectarse en la sangre mediante ELISA o Western blot, se ha utilizado como indicador de infección aguda y congénita temprana. Un ensayo para T. cruziantígenos en orina se ha desarrollado para diagnosticar enfermedades congénitas.
Contenido relacionado
Extrapiramidal
Muerte
Vaginosis bacteriana