Carbonato de calcio
(leer más)
En química, un isómero estructural (o isómero constitucional en la nomenclatura IUPAC) de un compuesto es otro compuesto cuya molécula tiene el mismo número de átomos de cada elemento, pero con lazos lógicamente distintos entre ellos. El término metámero se usaba anteriormente para el mismo concepto.
Por ejemplo, butanol H3C−(CH 2)3−OH, metil propil éter H3C−(CH2)2− O−CH3, y éter dietílico (H3CCH2−)2O tienen el misma fórmula molecular C4H10O pero son tres isómeros estructurales distintos.
El concepto se aplica también a iones poliatómicos con la misma carga total. Un ejemplo clásico es el ion cianato O=C=N− y el ion fulminato C−≡N+−O−. También se extiende a los compuestos iónicos, de modo que (por ejemplo) el cianato de amonio [NH4]+[O=C=N]− y urea (H2N−)2C=O se consideran estructurales isómeros, al igual que el formiato de metilamonio [H3C−NH 3]+[HCO2]− y acetato de amonio [NH4]+[H3C−CO2]−.
La isomería estructural es el tipo de isomería más radical. Se opone al estereoisomerismo, en el que los átomos y el esquema de enlace son los mismos, pero solo es diferente la disposición espacial relativa de los átomos. Ejemplos de estos últimos son los enantiómeros, cuyas moléculas son imágenes especulares entre sí, y las versiones cis y trans del 2-buteno.
Entre los isómeros estructurales, se pueden distinguir varias clases que incluyen isómeros esqueléticos, isómeros posicionales (o regioisómeros), isómeros funcionales , tautómeros y topoisómeros estructurales.
Un isómero esquelético de un compuesto es un isómero estructural que difiere de él en los átomos y enlaces que se considera que componen el "esqueleto" de la molécula. Para los compuestos orgánicos, como los alcanos, eso generalmente significa los átomos de carbono y los enlaces entre ellos.
Por ejemplo, hay tres isómeros esqueléticos de pentano: n-pentano (a menudo llamado simplemente "pentano"), isopentano (2-metilbutano) y neopentano (dimetilpropano).
 |  | |
| n-Pentane | Isopentane | Neopentane |
Si el esqueleto es acíclico, como en el ejemplo anterior, se puede usar el término isomerismo de cadena.
Isómeros de posición (también isómeros de posición o regioisómeros) son isómeros estructurales que pueden verse como diferentes solo en la posición de un grupo funcional, sustituyente o alguna otra característica en un "padre" estructura.
Por ejemplo, reemplazar uno de los 12 átomos de hidrógeno -H por un grupo hidroxilo -OH en la molécula principal de n-pentano puede dar cualquiera de los tres isómeros de posición diferentes:
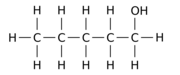 | 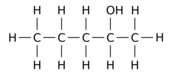 | 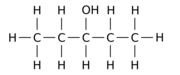 |
| Pentan-1-ol | Pentan-2-ol | Pentan-3-ol |
isómeros funcionales son isómeros estructurales que tienen diferentes grupos funcionales, lo que da como resultado propiedades químicas y físicas significativamente diferentes.
Un ejemplo es el par propanal H3C–CH2–C(=O)-H y acetona H3C– C(=O)–CH3: el primero tiene una función –C(=O)H, lo que lo convierte en un aldehído, mientras que el segundo tiene una función C–C(=O)–C grupo, eso lo convierte en una cetona.
Otro ejemplo es el par etanol H3C–CH2–OH (un alcohol) y dimetil éter H3C–O –CH2H (un éter). Por el contrario, el 1-propanol y el 2-propanol son isómeros estructurales, pero no isómeros funcionales, ya que tienen el mismo grupo funcional significativo (el hidroxilo -OH) y ambos son alcoholes.
Además de la química diferente, los isómeros funcionales suelen tener espectros infrarrojos muy diferentes. El espectro infrarrojo está determinado en gran medida por los modos de vibración de la molécula, y los grupos funcionales como el hidroxilo y los ésteres tienen modos de vibración muy diferentes. Por lo tanto, el 1-propanol y el 2-propanol tienen espectros infrarrojos relativamente similares debido al grupo hidroxilo, que es bastante diferente al del metil etil éter.
En química, normalmente se ignoran las distinciones entre isótopos del mismo elemento. Sin embargo, en algunas situaciones (por ejemplo, en espectroscopia Raman, RMN o microondas) se pueden tratar diferentes isótopos del mismo elemento como elementos diferentes. En el segundo caso, se dice que dos moléculas con el mismo número de átomos de cada isótopo pero esquemas de unión distintos son isotopómeros estructurales.
Así, por ejemplo, el eteno no tendría isómeros estructurales bajo la primera interpretación; pero reemplazar dos de los átomos de hidrógeno (1H) por átomos de deuterio (2H) puede producir cualquiera de los dos isotopómeros estructurales (1,1-dideuteroeteno y 1,2- dideuteroeteno), si ambos átomos de carbono son el mismo isótopo. Si, además, los dos carbonos son isótopos diferentes (por ejemplo, 12C y 13C), habría tres isótopómeros estructurales distintos, ya que 1-13 C-1,1-dideuteroeteno sería diferente de 1-13C-2,2-dideuteroeteno). Y, en ambos casos, el isotopómero estructural 1,2-dideutero ocurriría como dos estereoisotopómeros, cis y trans.
Dos moléculas (incluidos los iones poliatómicos) A y B tienen la misma estructura si cada átomo de A puede emparejarse con un átomo de B del mismo elemento, de forma biunívoca, de modo que para cada enlace en A hay un enlace en B, del mismo tipo, entre átomos correspondientes; y viceversa. Este requisito se aplica también a los enlaces complejos que involucran tres o más átomos, como el enlace deslocalizado en la molécula de benceno y otros compuestos aromáticos.
Dependiendo del contexto, se puede requerir que cada átomo esté emparejado con un átomo del mismo isótopo, no solo del mismo elemento.
Se puede decir entonces que dos moléculas son isómeros estructurales (o, si los isótopos importan, isotopómeros estructurales) si tienen la misma fórmula molecular pero no tienen la misma estructura.
La simetría estructural de una molécula se puede definir matemáticamente como una permutación de los átomos que intercambia al menos dos átomos pero no cambia la estructura de la molécula. Entonces se puede decir que dos átomos son estructuralmente equivalentes si existe una simetría estructural que lleva uno al otro.
Así, por ejemplo, los cuatro átomos de hidrógeno del metano son estructuralmente equivalentes, porque cualquier permutación de ellos preservará todos los enlaces de la molécula.
Del mismo modo, los seis hidrógenos del etano (C
2H
6) son estructuralmente equivalentes entre sí, al igual que los dos carbonos; porque cualquier hidrógeno puede intercambiarse con cualquier otro, ya sea mediante una permutación que intercambie solo esos dos átomos, o mediante una permutación que intercambie los dos carbonos y cada hidrógeno en un grupo metilo con un hidrógeno diferente en el otro metilo. Cualquiera de las operaciones conserva la estructura de la molécula. Este es también el caso de los átomos de hidrógeno ciclopentano, aleno, 2-butino, hexametilentetramina, prismano, cubano, dodecaedrano, etc.
Por otro lado, los átomos de hidrógeno del propano no son todos estructuralmente equivalentes. Los seis hidrógenos unidos al primer y tercer carbono son equivalentes, como en el etano, y los dos unidos al carbono medio son equivalentes entre sí; pero no hay equivalencia entre estas dos clases de equivalencia.
Las equivalencias estructurales entre los átomos de una molécula principal reducen el número de isómeros posicionales que se pueden obtener reemplazando esos átomos por un elemento o grupo diferente. Así, por ejemplo, la equivalencia estructural entre los seis hidrógenos del etano C
2H
6 significa que solo hay un isómero estructural de etanolC
2H
5OH, no 6. Los ocho hidrógenos del propano C
3H
8 se dividen en dos clases de equivalencia estructural (las seis en los grupos metilo y la dos en el carbono central); por lo tanto, solo hay dos isómeros posicionales de propanol (1-propanol y 2-propanol). Del mismo modo, solo hay dos isómeros posicionales de butanol y tres de pentanol o hexanol.
Una vez que se realiza una sustitución en una molécula principal, su simetría estructural generalmente se reduce, lo que significa que los átomos que antes eran equivalentes pueden no serlo más. Así, la sustitución de dos o más átomos equivalentes por el mismo elemento puede generar más de un isómero posicional.
El ejemplo clásico son los derivados del benceno. Sus seis hidrógenos son todos estructuralmente equivalentes, al igual que los seis carbonos; porque la estructura no cambia si los átomos se permutan en formas que corresponden a voltear la molécula o rotarla en múltiplos de 60 grados. Por lo tanto, reemplazar cualquier hidrógeno por cloro produce solo un clorobenceno. Sin embargo, con ese reemplazo, las permutaciones atómicas que movían ese hidrógeno ya no son válidas. Sólo queda una permutación, que corresponde a darle la vuelta a la molécula manteniendo fijo el cloro. Los cinco hidrógenos restantes caen en tres clases de equivalencia diferentes: el opuesto al cloro es una clase en sí mismo (llamado posición para), los dos más cercanos al cloro forman otra clase ( orto), y los dos restantes son de la tercera clase (meta). Por lo tanto, una segunda sustitución de hidrógeno por cloro puede producir tres isómeros posicionales: 1,2- u orto-, 1,3- o meta- y 1,4- o para-diclorobenceno.
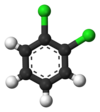 |  |  |
| ortho-Diclorobenceno | meta-Diclorobenceno | para-Diclorobenceno |
| 1,2-Dichlorobenzene | 1,3-Dichlorobenzene | 1,4-Dichlorobenzene |
Por la misma razón, solo hay un fenol (hidroxibenceno), pero tres bencenodioles; y un tolueno (metilbenceno), pero tres toluoles y tres xilenos.
Por otro lado, el segundo reemplazo (por el mismo sustituyente) puede preservar o incluso aumentar la simetría de la molécula y, por lo tanto, puede preservar o reducir el número de clases de equivalencia para el próximo reemplazo. Por lo tanto, los cuatro hidrógenos restantes en meta-diclorobenceno aún se dividen en tres clases, mientras que los de orto- se dividen en dos y los de para - son todos equivalentes de nuevo. Aún así, algunas de estas 3 + 2 + 1 = 6 sustituciones terminan dando la misma estructura, por lo que solo hay tres triclorobencenos estructuralmente distintos: 1,2,3-, 1,2,4- y 1,3,5-.
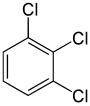 |  |  |
| 1,2,3-Triclorobenceno | 1,2,4-Trichlorobenzene | 1,3,5-Triclorobenceno |
Si los sustituyentes en cada paso son diferentes, normalmente habrá más isómeros estructurales. El xilenol, que es benceno con un sustituyente hidroxilo y dos sustituyentes metilo, tiene un total de 6 isómeros:
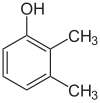 | 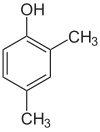 | 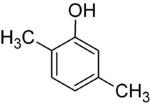 |
| 2,3-Xylenol | 2,4-Xylenol | 2,5-Xylenol |
 |  |  |
| 2,6-Xylenol | 3,4-Xylenol | 3,5-Xylenol |
Enumerar o contar los isómeros estructurales en general es un problema difícil, ya que se deben tener en cuenta varios tipos de enlaces (incluidos los deslocalizados), estructuras cíclicas y estructuras que posiblemente no se puedan realizar debido a restricciones geométricas o de valencia, y no tautómeros separables.
Por ejemplo, hay nueve isómeros estructurales con fórmula molecular C3H6O que tienen diferentes conectividades de enlace. Siete de ellos son estables al aire a temperatura ambiente, y se dan en la siguiente tabla.
Dos isómeros estructurales son los tautómeros enólicos de los isómeros de carbonilo (propionaldehído y acetona), pero estos no son estables.
(leer más)
(leer más)
(leer más)